- •Зависимость термодинамической реакционной способности веществ от температуры.
- •Реакционная способность металла в водных средах.
- •Оценка реакционной способности с помощью диаграммы Пурбе (е, рН).
- •Реакционная способность комплексных (координационных) соединений.
- •ΣГидрадные комплексы.
- •Карбонильные комплексы.
- •Комплексы с нулевым зарядом.
- •Типы связей в комплексных соединениях.
- •Строение комплексов.
- •Устойчивость комплексов.
- •Типы реакций между комплексными соединениями.
- •Гетероциклы
- •Краун-эфиры.
- •Применение краун-эфиров.
- •Криптанды.
- •1) Понятия реакционной способности.
Реакционная способность – это способность химических соединений вступать в химические реакции с другими веществами, при этом учитывается как разнообразность химических реакций, так и скорость их протекания.
Например:Галогены с большой реакционной способностью и высокой скоростью.
F, Cl, Br, I
H2 + Cl2 → 2HCl
2Al + 3I2 → 2AlI3
С другой стороны, благородные газы с низкой реакционной способностью: неон, аргон, гелий, криптон, ксенон. Щелочные металлы обладают высокой реакционной способностью: литий, натрий, калий, цезий, франций.
2K + 2H2O → 2KOH + H2
Благородные металлы (Au, Ag, Pt, Pd, Ru, Os, Ir, Ro) вступают в небольшое количество химических реакции с крайне низкой скоростью.
Количественной мерой реакционной способностью является константа скорости для необратимой (К), и константа равновесия для обратимых (Кравн.). В органической химии возможно сравнивать реакционную способность внутри одного гомологического ряда при реакции с одним и тем же веществом при одинаковых условиях.
CnH2n+2
+ Cl2
→ CnH2n+1Cl
+ HCl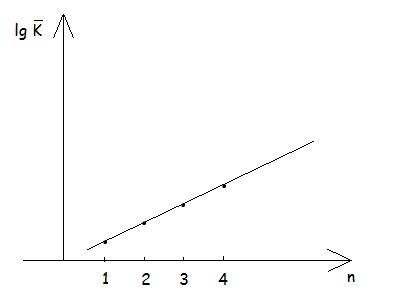
В неорганической химии количественно сравнить реакционной способности невозможно.
Зависимость термодинамической реакционной способности веществ от температуры.
Рассмотрим на примере самопроизвольного протекания химической реакции. Условия для этого при постоянном давлении является убыль энергии Гиббса.
∆G < 0
∆G = ∆H - T∆S
Рассмотрим влияние знака ∆H и ∆S на возможность самопроизвольного протекания реакции.
∆H < 0, ∆S < 0, ∆G < 0
реакция протекает с выделением тепла.
При любых Т реакция протекает в прямых направлениях
∆G < 0
2Ств + О2(г) → 2СО2 + Q
∆H > 0, ∆S < 0, ∆G > 0
При любых Т течение химической реакции в прямом направлении невозможно. Энтропия падает.
N2(г) + 2О2(г) → 2NO2(г)
реакция невозможна при любых Т.
∆H < 0, ∆S < 0
Тепло выделяется, реакция экзотермическая падает. При низких Т будет преобладать энтальпийный фактор, реакция идет в прямом направлении. При высоких Т работает ∆S – реакция идет в обратом направлении.
∆G = 0
∆H - T∆S = 0
∆H = T∆S
Травн. = ∆H/∆S [КДж/моль] / [Дж/моль]
Травн. – всегда положительная, поэтому ∆H и ∆S должны быть одинакового знака. Примерно в 103 разница имеется Травн. примерно 1000.
CaO(тв). +CO2(г) → СaCO3(тв)
∆H > 0, ∆S > 0
При высоких Т преобладает ∆S , ∆G < 0реакция течет самопроизвольно.
При низких Т преобладает ∆H реакция в прямом направлении не идет.
Синтез-газ:
СН4(г) + H2O(г) = CO(г) + 3Н2(г)
∆S > 0, тепло поглощается, отсюда следует ∆H > 0.
K
= K0
*
 (скорость)
(скорость)
Реакционная способность металла в водных средах.
∆E=Eок-Eвост>0
Металл реагируют с H2O в зависимости от pH.
pH= -lg[H+]
В H2O всегда присутствует 2 окислителя:
Катион H+
H+-2℮→H2
Зависимость
потенциала от pH
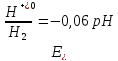
Растворенный О2
|
E,B pH |
0 |
7 |
|
|
0
|
-0,42 |
|
|
1,23 |
0,81 |

Рассмотрим растворы 2-х типов:
1) нейтральная pH=7
2) Кислая pH<7, pH=0.

Совместили значения E металла с E окислителями, а именно с катионами H + и растворенным О2. В следствии этого все металлы разделятся на 5 групп:
Металлы взаимодействуют даже с нейтральными растворами при отсутствии кислорода. Это щелочноземельные и щелочные металлы. Абсолютно термодинамические неустойчивые металлы – 1 группа.
0 > E Men+/Me > - 0,42 В
Эти металлы устойчивы в обескислороженной нейтральной воде, но реагируют с кислотами.
E Ni2+/Ni = -0,25 B
E Pb2+/Pb = -0,2 B
E Sn2+/Sn = -0,15 B
0 B < E Men+/Me < 0,81 В
Эти металлы устойчивы в обескислороженных кислотах, но взаимодействуют с кислотосодержащими нейтральными растворами.
Cu2+ + 2ē = Cu Е = 0,34 В
Эти металлы полу благородные.
1,23 B > E Men+/Me > 0,81 B
Эти металлы устойчивы в обескислороженных кислотах, устойчивы в нейтральных кислотосодержащих растворах, но взаимодействуют с растворами кислотах, содержащих кислород. К этой группе относятся платиноиды.
Pt, Pd E ≈ 1,1 B
Металлы устойчивые во всех средах, даже в кислотосодержащих растворенных растворах.
E Men+/Me > 1,23 В
E Au+/Au = 1,5 В
4 и 5 группы – благородные металлы.
Примечание 1
Рассмотренный ряд активности металлов говорит о термодинамической возможности протекания реакций. Однако у скорости, то есть о кинетике протекания реакции по нему судить нельзя, поскольку скорость реакции определяется энергией активацией.

 =
=
 [A] [B]
[A] [B]
 =
=

Например, потенциал Al отрицательнее потенциала Fe, однако в нейтральных средах алюминий значительно устойчивее, чем железо. Но если мы поместим алюминий и железо в щелочной реакции, то в нем скорость растворения алюминия выше, чем у железа.
Примечание 2
В практической реальности редко встречается чистая вода. В растворе всегда содержится катионы, анионы, ПАВ, комплексообразующие агенты. При этом потенциалы реакции, а также кинетика могут серьезно изменится.
Например:
Au + 4HCl + HNO3 → H[Au+3Cl+4] + NO + 2H2O
Au+3 + 3ē =Au E = 1,5 B
[AuCl4]- + 3ē = Au + 4Cl-
При промышленной добыче золота используют растворения его в водных растворах цианидов.
4Au + O2 + 8Na(CN)-1 + 2 H2O = 4Na[Au(CN)2]- + 4NaOH
Примечание 3
Потенциал реакции окисления металла зависит от его концентрации и во многих случаях его даже трудно определить.
Например, железо коррозирует в водном растворе NaCl.
Fe0 - 2ē = Fe2+
Fe2+
+ O2
+ 10 H2O
→ Fe(OH)3
+ 8H+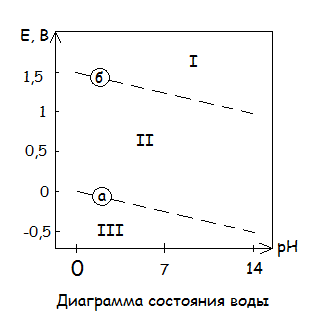
E Fe+2/Fe = -0,44 + 0,03lg[Fe2+ ]
В силу этих примечаний, приведенный ряд активностей металла нужно использовать с осторожностью.