
- •Зависимость термодинамической реакционной способности веществ от температуры.
- •Реакционная способность металла в водных средах.
- •Оценка реакционной способности с помощью диаграммы Пурбе (е, рН).
- •Реакционная способность комплексных (координационных) соединений.
- •ΣГидрадные комплексы.
- •Карбонильные комплексы.
- •Комплексы с нулевым зарядом.
- •Типы связей в комплексных соединениях.
- •Строение комплексов.
- •Устойчивость комплексов.
- •Типы реакций между комплексными соединениями.
- •Гетероциклы
- •Краун-эфиры.
- •Применение краун-эфиров.
- •Криптанды.
- •1) Понятия реакционной способности.
ΣГидрадные комплексы.
H-: B, Al, Ga, In, Tl – комплексообразователи.
Так же:
- Сильные восстановители:
Na[AlH4]
+ 4H2O
→ NaOH +2H2
+Al(OH)3
Такие комплексы используются в органической химии как очень сильные восстановители.
Получают при высоких температурах, например:
LiH + AlCl3 → Li[AlH4] +3LiCl
Карбонильные комплексы.
В качестве лиганда используется CO: С = O
Нуль-валентные комплексы – это комплексы, в которых центральный атом в степени окисления равен нулю.
Эти вещества имеют молекулярную кристаллическую решётку и поэтому являются жидкостями, либо легкоплавкими веществами.
|
Вещество |
Tпл., оС |
|
[Mn2(CO)10] |
154 |
|
[Re2(CO)10] |
177 |
|
[Fe(CO)5] |
-20 |
|
[Co2(CO)8] |
51 |
|
[Ni(CO)4 |
-19 |
Эти комплексы практически не растворимы в воде, потому что они неполярные.
CCl4 – тетрахлоругдерод
Очень важное свойство карбонильных комплексов, что они распадаются при высоких температурах:
[Ni(CO)4]
→ Ni
+ 4CO
Широко используются для получения чистых металлов, таких как Fe, Ni, Co.
Для этого карбонильный комплекс нагревается и испаряется. При этом все примеси остаются в жидкости, а испаряется чистый карбонил металла.
Затем газообработанный карбонил подвергается разложению при высокой температуре, при этом получается порошок очень чистого металла (в частности Ni, который в технике так и называется – карбонильный никель).
Из карбонильного никеля проводят электропроводящие краски.
π-комплексы.
Это комплексные соединения в которых роди лигандов фигурируют ненасыщенные органические молекулы.
Исторически первый π-комплекс открыл датский химик Цезе в 1827г. при кипячении.
K2[PtCl4] +lH3CH2OH → K2[PtCl3C2H4] + KCl + H2O
В настоящее время получено огромное количество комплексов такого типа, и наиболее известными из них являются сендвичные комплексы, например ферроцен.
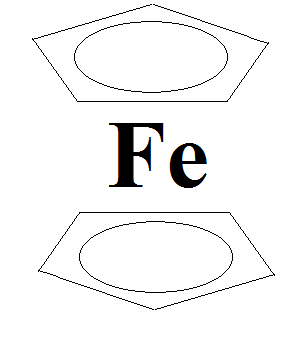
В качестве лиганда выступает пятичленное органическое кольцо сопряжённой связью.


Катион железа связан с π-электронами этой сопряжённой связи, причём она делокалиованна.
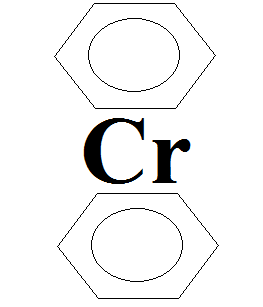
Аналогично существует такое же соединение – дибензол хром.
Большое практическое значение имеют ингибиторы коррозии, в которых имеются фрагменты молекул с ненасыщенной связью (фрагменты бензила, пиридин, перелидин)
Эти молекулы адсорбируются на поверхности железа, образуют поверхностный π-комплес, и со временем на поверхности железа создаётся фазовая плёнка, которая защищает железо от коррозии.
Комплексы с нулевым зарядом.
В зависимости от типа лигандов, комплекс может иметь положительный, отрицательный и нулевой заряд.
[Cu(NH3)4]2+, [FeF6]3-
Комплекс может иметь нулевой заряд.



Такие комплексы, как правило, малоактивны и, часто, нерастворимы. Наиболее известны из такого типа комплексов комплекс никеля (II) с димитилтриоксином (ярко-малинового цвета). Нерастворим в воде и используется для количественного анализа с содержанием никеля.



Типы связей в комплексных соединениях.
В зависимости от строения лиганда могут реализовываться три типа связей между лигандами и комплексообразователями.
σ-донорная связь
реализуется практически во всех случаях
π-донорная связь
π-акцепторная связь
σ-донорная
NH3, NCS, NR3
σ-доноры, слабые π-доноры
F-, OH-, H2O, ROH, R2O
σ, π-доноры, слабые π-акцепторы
Cl-, Br-, I-, SH-, SCN-
σ-доноры, π- акцепторы
CN, CO, NO, PR3, NO2-
σ-доноры, π-акцепторы
C6H6, C2H4
Наиболее прочные комплексы образуют лиганды σ-доноры, π-акцепторы образуются за счёт неподелённой электронной пары лиганд и свободной орбитали иона металла.
π-акцепторная связь за счёт ненасыщенной связи лиганд и неподелённой электронной пары металла.
