
- •Особенности термодинамики как науки.
- •Основные определения термодинамики.
- •Координаты и потенциалы.
- •Пример 3. Химические реакции и фазовые превращения.
- •Правило знаков для потенциалов:
- •Теплота и работа. Внутренняя энергия.
- •Работа на деформацию (деформационная работа).
- •Взаимодействия равновесное и неравновесное. Процессы статические и нестатические.
- •Уравнения состояния системы.
- •Уравнения состояния реальных газов.
- •Работа и теплота. Свойства работы и теплоты.
- •Характеристические функции.
- •Дифференциальные соотношения термодинамики.
- •Отличительные особенности типов дифференциальных соотношений.
- •2. Теория теплоёмкости разнородных систем.
- •2.1. Виды теплоемкостей.
- •2.2. Общая формула для теплоемкостей однородных систем.
- •2.3. Теплоёмкость идеального газа.
- •2.4. Зависимость теплоёмкости от давления, объёма и температуры.
- •2.5.Исследование теплоемкостей идеального газа.
- •2.6.Исследование зависимости изохорной и изобарной теплоёмкостей идеального газа от величины температуры.
- •2.7.Зависимость теплоёмкости от температуры. Истинная и средняя теплоёмкости.
- •3.Вычисление энтропии.
- •3.1.Энтопия. Общие формулы для энтропии идеального а реального газов.
- •3.2.Уравнение адиабаты реального газа в общем виде.
- •4.Исследование термодинамических процессов.
- •4.1.Политропный (политропический) процесс.
- •4.2.Метод определения показателя политропы по двум точкам.
- •4.3.Теплоемкость в политропном проессе.
- •4.4.Работа, теплота и внутренняя энергия в политропном процессе.
- •Исследование изопроцессов. Работа, теплота и внутренняя энергия в изопроцессах.
- •Второй закон термодинамики.
2.7.Зависимость теплоёмкости от температуры. Истинная и средняя теплоёмкости.
Опытные значения теплоёмкостей при различных температурах представляются в виде таблиц, графиков и эмпирических функций.
Различают истинную и среднюю теплоемкости.
Истинная теплоемкость C-это теплоемкость для заданной температуры.
В инженерных расчетах часто используется среднее значение теплоемкости в заданном интервале температур (t1;t2).
Средняя
теплоемкость обозначается двояко:
 ,
, .
.
Недостаток последнего обозначения является незаданность диапазона температур.
Истинная и средняя теплоемкости связаны соотношением:
 (81)
(81)
Истинная теплоемкость-это предел, к которому стремится средняя теплоемкость, в заданном диапазоне температур t1…t2, при ∆t=t2-t1
Как показывает опыт, у большинства газов истинные теплоемкости возрастают с ростом температуры. Физическое объяснение этого возрастания заключается в следующем:
Известно, что температура газа не связана колебательным движением атомов и молекул, а зависит от кинетической энергии Ek поступательного движения частиц. Но по мере роста температуры подводимая к газу теплота всё более и более перераспределяется в пользу колебательного движения, т.е. рост температуры при одинаковом подводе теплоты по мере роста температуры замедляется.
Типичная зависимость теплоемкости от температуры:
c=c0
+ at
+ bt2
+ dt3
+ … (82)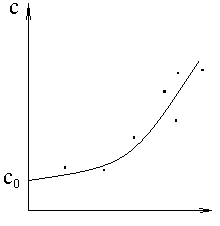
где c0, a, b, d – эмпирические коэффициенты.
c – Истинная теплоёмкость, т.е. значение теплоёмкости для заданной температуры T.
Для теплоемкости битоппроксимирующей кривой- это полином в виде ряда по степеням t.
Аппроксимирующая кривая проводится с использованием специальных методов, например, методом наименьших квадратов. Суть этого метода в том, что при его использовании все точки примерно равноудалены от аппроксимирующей кривой.
Для инженерных расчётов, как правило, ограничиваются двумя первыми слагаемыми в правой части, т.е. полагают зависимость теплоёмкости от температуры линейной c=c0 + at (83)




Средняя теплоемкость графически определяется как средняя линия заштрихованной трапеции, как известно средняя линия трапеции определяется как полусумма оснований.
Формулы применяются, если известна эмпирическая зависимость.
В тех случаях, когда зависимость теплоёмкости от температуры не удаётся удовлетворительно аппроксимировать к зависимости c=c0+at, можно воспользоваться следующей формулой:
 (85)
(85)
Эта формула применяется в тех случаях, когда зависимость c от t существенно нелинейна.
Из молекулярно-кинетической теории газов известно
U
= 12,56T
 ,U
- внутренняя энергия одного киломоля
идеального газа.
,U
- внутренняя энергия одного киломоля
идеального газа.
Ранее было получено для идеального газа:
 ,
,
 ,
,
Из полученного результата следует, что теплоемкость, полученная с использованием МКТ, от температуры не зависит.
Уравнение Майера: cp-cv=R,
cp=cv+R=12,56+8,31420,93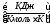 .
.
Как и предыдущем случае по МКТ газов молекулярная изобарная теплоемкость от температуры не зависит.
Понятию идеального газа в наибольшей степени соответствуют одноатомные газы при малых давлениях, на практике приходится иметь дело с 2-х, 3-х … атомными газами. Например, воздух, который по объёму состоит из 79% азота (N2), 21% кислорода (O2) (в инженерных расчетах инертные газы не учитываются в силу малости их содержания) .
Можно для оценочных расчётов пользоваться следующей таблицей:
|
Газ |
cv |
cp,
|
|
одноатомный |
12,56 |
20,93 |
|
двухатомный |
20,93 |
29,31 |
|
трехатомный |
29,31 |
37,68 |
У реальных газов, в отличие от идеального, теплоёмкости могут зависеть не только от температуры, но и от объёма и давления системы.

