
- •4. Примеры 59
- •Глава 1.
- •8. Основные диффузионные критерии подобия установившихся процессов массоотдачи.
- •При отсутствии экспериментальных данных коэффициент диффузии (молекулярной) газа а в газе в (или газа в в газе а) может быть вычислен по формуле:
- •Коэффициент диффузии в жидкости Dж при 20с можно вычислить по приближенной формуле:
- •Материальный баланс абсорбера (рис. 1.2).
- •Определение диаметра насадочного абсорбера.
- •Определение высоты насадочного абсорбера.
- •Критериальные формулы для расчета коэффициентов массоотдачи в насадочных абсорберах с неупорядоченной насадкой (навалом) при пленочном режиме.
- •Примеры
- •II. В условиях равновесия с газовой фазой, в которой парциальное давление ацетилена равняется 107 мм рт. Ст., вода по закону Генри должна иметь концентрацию ацетилена (в мольных долях):
- •2) Для определения числа единиц переноса методом графического интегрирования по данным табл. 1.4 и рис. 1.6 составляем табл. 1.5.
-
Критериальные формулы для расчета коэффициентов массоотдачи в насадочных абсорберах с неупорядоченной насадкой (навалом) при пленочном режиме.
а) Для газовой фазы:
![]() .
(1.45)
.
(1.45)
Здесь
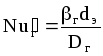 ;
;
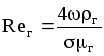 ;
;
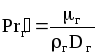 ;
г-
коэффициент массоотдачи для газа,
;
г-
коэффициент массоотдачи для газа,
 ;
Dг-
коэффициент диффузии поглощаемого
компонента в газе, м2/с.
Остальные обозначения - см. формулы
(1.36) и (1.38).
;
Dг-
коэффициент диффузии поглощаемого
компонента в газе, м2/с.
Остальные обозначения - см. формулы
(1.36) и (1.38).
Уравнение (1.45) справедливо при значениях Reг от 10 до 10 000.
б) Для жидкой фазы:
![]() ,
(1.46)
,
(1.46)
где
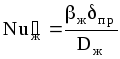 ;
;![]() ;
;
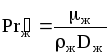 ;
ж
- коэффициент
массоотдачи для жидкости, м/с;
;
ж
- коэффициент
массоотдачи для жидкости, м/с;
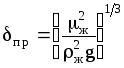 -так
называемая приведенная толщина жидкой
пленки, м; Dж-
коэффициент диффузии поглощаемого
компонента в жидкости, м2/с;
L - массовый расход жидкости, кг/с.
-так
называемая приведенная толщина жидкой
пленки, м; Dж-
коэффициент диффузии поглощаемого
компонента в жидкости, м2/с;
L - массовый расход жидкости, кг/с.
Выражение для критерия Reж получено следующим путем.
Обозначения-см. уравнения (1.36) и (1.38).
Омываемый жидкостью периметр сечения абсорбера находим из уравнения (1.38):
П=F/Нн=S. (1.47)
Скорость течения пленки жидкости через насадку:
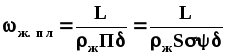 ,
(1.48)
,
(1.48)
где - средняя толщина пленки, м.
Эквивалентный диаметр жидкой пленки:
dпл=4П/П=4. (1.49)
Подставляя эти значения в выражение для критерия Reж, получаем:
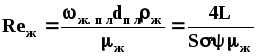 .
(1.50)
.
(1.50)
16. Определение диаметра и высоты тарельчатой абсорбционной колонны проводится так же, как и для тарельчатых ректификационных колонн-см. гл. 2. Диаметр тарельчатого абсорбера рассчитывают по уравнениям (2.16) и (2.17). Высоту тарельчатой части абсорбера Нт определяют по уравнению (2.18). Требуемое число тарелок находят графически с применением кинетических зависимостей для расчета коэффициентов массопередачи или ВЕП. При приближенных расчетах для определения числа тарелок находят графически число ступеней изменения концентрации (рис. 1.4) и затем число тарелок n по уравнению (2.19).
Примеры
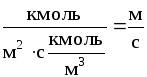
Пример 1.1. Жидкая смесь содержит 58,8% (мол.) толуола и 41,2% (мол.) четыреххлористого углерода (ч. х. у.). Определить относительную массовую концентрацию толуола X (в кг толуола/кг ч. х. у.) и его объемную массовую концентрацию Сx (в кг/м3).
Р е ш е н и е . Относительная массовая концентрация толуола:
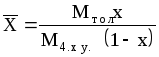 ,
,
где Мтол- мольная масса толуола (92 кг/кмоль); Мч.х.у.- то же четыреххлористого углерода (154 кг/кмоль); x - мольная доля толуола.
Имеем:
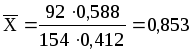 кг
толуола/кг ч. х. у.
кг
толуола/кг ч. х. у.
Чтобы рассчитать объемную массовую концентрацию толуола Сx, необходимо знать плотность смеси см. Для расчета плотности предварительно найдем массовую долю толуола x.
По табл. 1.2:
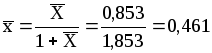 .
.
Далее по табл. IV находим: плотность толуола тол=870 кг/м3, плотность четыреххлористого углерода ч.х.у.=1630 кг/м3.
Считая, что изменение объема при смешении не происходит, т. е. объем смеси равен сумме объемов компонентов, находим объем одного кг смеси
![]() м3,
м3,
откуда плотность смеси:
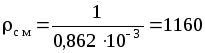 кг/м3.
кг/м3.
Можно рассчитать см и так:
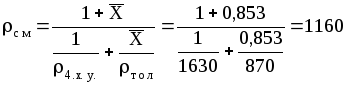 кг/м3.
кг/м3.
Объемная массовая концентрация толуола:
Сx=x=11600,461=535 кг/м3.
Пример 1.2. Воздух атмосферного давления при температуре 34С насыщен водяным паром. Определить парциальное давление воздуха, объемный и массовый % пара в воздушно-паровой смеси и его относительную массовую концентрацию, считая оба компонента смеси идеальными газами. Атмосферное давление 745 мм рт. ст. Определить также плотность воздушно-паровой смеси, сравнить ее с плотностью сухого воздуха.
Р е ш е н и е. По табл XXXVIII находим, что при t= 34C давление насыщенного водяного пара составляет 39,9 мм рт. ст. Это давление является парциальным давлением водяного пара рп в воздушно-паровой смеси, а парциальное давление воздуха равняется:
pв=П - pп=745-39,9 705 мм рт. ст.
Мольная (объемная) доля водяного пара в меси:
y=pп/П=39,9/745=0,0535.
Массовая доля пара:
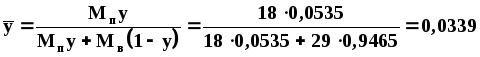
Относительная массовая концентрация
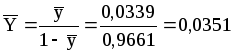 кг
пара/кг воздуха.
кг
пара/кг воздуха.
Плотность воздушно-паровой смеси рассчитываем как сумму плотностей компонентов, взятых каждая при своем парциальном давлении:
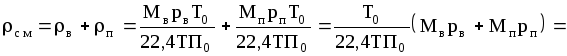
=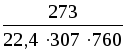 =(29705+1839,9)=1,105
кг/м3.
=(29705+1839,9)=1,105
кг/м3.
Можно рассчитать плотность смеси иначе.
Мольная масса смеси:
Мсм=Мпy+Мв(1-y)=180,0535+290,9465=28,4 кг/кмоль.
Плотность смеси при П=745 мм рт. ст. и t=34C:
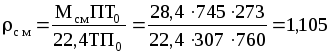 кг/м3
кг/м3
Плотность сухого воздуха при тех же давлении и температуре:
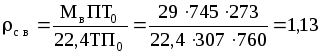 кг/м3.
кг/м3.
Пример 1.3. При температуре 25С приведены в соприкосновение: воздух атмосферного давления, содержащий 14% (об.) ацетилена (С2Н2), и вода, содержащая растворенный ацетилен в количестве: а) 0,2910-3 кг на 1 кг воды; б) 0,15310-3 кг на 1 кг воды. Определить: 1) из какой фазы в какую будет переходить ацетилен; 2) движущую силу этого процесса перехода в начальный момент времени (в относительных мольных концентрациях). Атмосферное давление 765 мм рт. ст. Равновесные концентрации ацетилена в газовой и в жидкой фазах определяются законом Генри.
Р е ш е н и е . Закон Генри [уравнение (1.2)]:
p=Еx.
По табл, XLI находим, что при t=25С коэффициент Генри Е=1,01106 мм рт. ст.
Парциальное давление ацетилена в воздухе по уравнению (1.1):
p=yП=0,14765=107 мм рт. ст.
а) Мольная доля ацетилена в воде при X=0,2910-3кг ацетилена/кг воды (табл. 1.2):
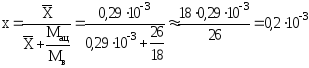 .
.
Ответы на вопросы примера могут быть получены двумя путями.
I. В условиях равновесия парциальное давление ацетилена в газовой фазе над жидкостью с x=0,210-3 по закону Генри должно составлять:
p=Еx=1,011060,210-3=202 мм рт. ст.
Имеющееся в действительности над этой жидкостью парциальное давление ацетилена меньше: p=107 мм рт. ст. Чтобы в процессе массопередачи система газ-жидкость приближалась к состоянию равновесия, парциальное давление ацетилена в газовой фазе должно увеличиваться, т. е. он будет переходить из воды в воздух.
Движущая сила этого процесса перехода (отклонение от состояния равновесия) в начальный момент времени будет равна: в единицах парциального давления ацетилена
p=p-p=202-107=95 мм рт. ст.
в мольных долях
y=y-y=
![]() -0,14=0,264-0,14=0,124;
-0,14=0,264-0,14=0,124;
в относительных мольных концентрациях
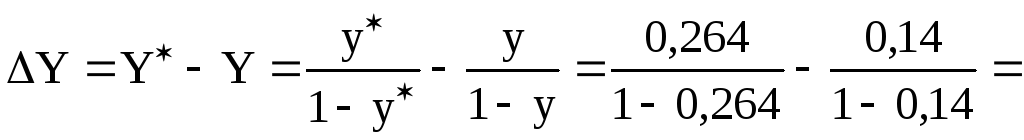
=0,359-0,163=0,196 кмоль ацетилена/кмоль воздуха.
