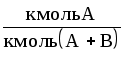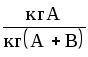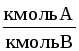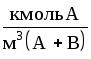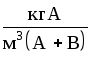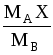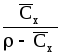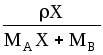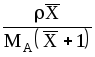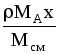- •4. Примеры 59
- •Глава 1.
- •8. Основные диффузионные критерии подобия установившихся процессов массоотдачи.
- •При отсутствии экспериментальных данных коэффициент диффузии (молекулярной) газа а в газе в (или газа в в газе а) может быть вычислен по формуле:
- •Коэффициент диффузии в жидкости Dж при 20с можно вычислить по приближенной формуле:
- •Материальный баланс абсорбера (рис. 1.2).
- •Определение диаметра насадочного абсорбера.
- •Определение высоты насадочного абсорбера.
- •Критериальные формулы для расчета коэффициентов массоотдачи в насадочных абсорберах с неупорядоченной насадкой (навалом) при пленочном режиме.
- •Примеры
- •II. В условиях равновесия с газовой фазой, в которой парциальное давление ацетилена равняется 107 мм рт. Ст., вода по закону Генри должна иметь концентрацию ацетилена (в мольных долях):
- •2) Для определения числа единиц переноса методом графического интегрирования по данным табл. 1.4 и рис. 1.6 составляем табл. 1.5.
МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА
РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЖЕВСКАЯ ГОСУДАРСТВЕННАЯ СЕЛЬСКОХОЗЯЙСТВЕННАЯ АКАДЕМИЯ
КАФЕДРА “ПРОЦЕССЫ И АППАРАТЫ”
УТВЕРЖДАЮ:
Проректор по учебной работе
доцент __________ А. И. Любимов
“_____”_____________ 1998 г.
Основы массопередачи. Абсорбция. Ректификация
Методическое руководство к решению примеров и задач по курсу “Процессы и аппараты”
Ижевск -1998 г.
Составитель:
Иванов В. И. - к. т. н., заведующий кафедрой “Процессы и аппараты.” ИжГСХА.
Рецензент:
Касаткин В. В. - Заведующий кафедрой “Механизация переработки сельскохозяйственной прдукции.”
Ответственный за выпуск - заведующий кафедрой “Процессы и аппараты” к. т. н., доцент Иванов В. И.
Одобрено и рекомендовано к изданию методической комиссией факультета механизации сельского хозяйства ИжГСХА.
(протокол №______от”____”________199__г.)
_______________________________________
Зак. Тир. п. л. ИжГСХА 199__г.
СОДЕРЖАНИЕ
1. Глава 1. Основы массопередачи. Абсорбция.
Основные зависимости и расчетные формулы 2
2. Примеры 21
3. Глава 2. Перегонка и ректификация.
Основные зависимости и расчетные формулы 50
4. Примеры 59
Глава 1.
Основы массопередачи. Абсорбция
Основные зависимости и расчетные формулы
-
Способы выражения состава фаз двухкомпонентных систем жидкость-газ (пар) представлены в табл. 1.1.
Формулы для пересчета концентраций (в жидкой фазе) даны в табл.1.2. Для газовой (паровой) фазы справедливы те же соотношения, но с заменой обозначений x на y, X на Y, СX на Сy
-
Концентрация компонента в газовой фазе может быть выражена так же через его парциальное давление. На основании уравнений Клайперона и Дальтона мольная (объемная) доля у любого компонента смеси идеальных газов равняется:
y=р/П, (1.1)
где р-парциальное давление компонента газовой смеси; П=рА+рВ+рС+...-общее давление смеси газов или паров, равное сумме парциальных давлений всех компонентов.
-
Законы межфазного равновесия для идеальных растворов.
а) Закон Генри:
р=Еx, (1.2)
где р-парциальное давление компонента в газовой фазе; над равновесной с газом жидкостью; x-мольная доля компонента в жидкости; Е-коэффициент Генри, зависящий от температуры и от природы газа и жидкости.
Значения Е для водных растворов некоторых газов даны в табл.XLI.
Подставляя в уравнение (1.2) значение р= yП по уравнению (1.1), получаем:
y=mx. (1.3)
Т а б л и ц а 1.1.
|
Концентрация |
Обозначение концентрации компонента А |
|
|
в жидкой фазе |
в газовой или паровой фазе |
|
|
Мольная
доля,
|
x |
y |
|
Массовая
доля
|
x |
y |
|
Относительная
мольная концентрация (доля),
|
X |
Y |
|
Относительная
массовая концентрация (доля),
|
X |
Y |
|
Объемная
мольная концентрация,
|
СX |
Сy |
|
Объемная
массовая концентрация,
|
СX |
Сy |
Здесь y-мольная доля компонента в газовой фазе, равновесной с жидкостью; m=Е/П-безразмерный коэффициент (коэффициент распределения), постоянный для данной системы газ-жидкость при t=const и П=const
Если применительно к двухфазной трехкомпонентной системе (газовая фаза: А+В, жидкая фаза А+С), подставить в уравнение равновесия (1.3) значения x и y ( для компонента А, выраженные через его относительные концентрации X и Y, X и Y (табл. 1.2), получим:
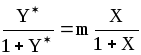 ;
(1.4)
;
(1.4)
Т а б л и ц а 1.2
|
Выражение концентрации компонента А |
x |
x |
X |
X |
Cx |
Cx |
|
x |
- |
или
|
|
|
или
|
или
|
|
x |
|
- |
|
|
|
|
|
X |
|
|
- |
|
|
|
|
X |
|
|
|
- |
|
|
|
Cx |
|
|
|
|
- |
|
|
Cx |
|
x |
|
|
МАСx |
- |
МА,
МВ,
Мсм-мольные
массы компонентов и смеси, кг/кмоль;
Мсм=
МАx+
МВ(1-x);
-плотность
смеси, кг/м3.
Для смеси идеальных газов:
![]() .
.

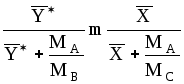 ,
(1.5)
,
(1.5)
где МА- мольная масса распределенного между фазами компонента А; МВ-то же второго компонента бинарной газовой смеси; МС-то же второго компонента бинарной жидкой смеси.
При малых концентрациях распределенного компонента в газе и в жидкости, когда Y 1 и X 1, в знаменателях уравнения (1.4) величинами Y и X можно пренебречь, и оно получает вид:
Y =mX. (1.6)
Аналогично при Y
![]() и X
и X
![]() из уравнения (1.5) получим:
из уравнения (1.5) получим:
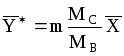 (1.6а)
(1.6а)
б) закон Рауля:
р=Рx, (1.7)
где р-парциальное давление компонента в парогазовой смеси над жидкостью в условиях равновесия; Р-давление насыщенного пара чистого компонента- однозначная функция температуры; Р=f(t); x-мольная доля компонента в жидкости.
При подстановке в уравнение (1.7) значения р= yП из уравнения (1.1) получаем:
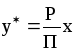 ,
(1.8)
,
(1.8)
где y-мольная доля компонента в парогазовой фазе, равновесной с жидкостью.
Для двухкомпонентной смеси, когда оба ее компонента следуют закону Рауля, уравнение (1.8) приводится к виду:
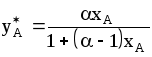 .
(1.9)
.
(1.9)
Здесь =РА/РВ-коэффициент относительной летучести; РА-давление насыщенного пара более летучего (низкокипящего) компонента при той же температуре; РВ- давление насыщенного пара менее летучего (высококипящего) компонента при той же температуре.
-
Многочисленные экспериментальные данные о равновесных составах жидкости и пара для различных растворов имеются в справочнике* . Для некоторых бинарных смесей данные о равновесных составах жидкости и пара при П=const приведены в табл. XLVII и на рис. XXI и XXII.
-
Причиной (движущей силой) процесса массопередачи-перехода какого-либо компонента из одной фазы в другую (например, из жидкой фазы Фx с мольной концентрацией переходящего компонента x в газовую фазу Фy с мольной концентрацией y) является неравновесность соприкасающихся фаз, их отклонение от состояния динамического равновесия. В химической термодинамике устанавливается, что величина этого отклонения, при равенстве температур и давлений фаз, определяется разностью химических потенциалов переходящего компонента (x-y), которая и является движущей силой процесса массопередачи. При равновесии фаз потенциалы x и y равны.
Заменяя потенциал
x
равным ему потенциалом равновесной
газовой смеси
![]() ,
получим для движущей силы процесса
массопередачи выражение
,
получим для движущей силы процесса
массопередачи выражение
x-y=![]() -y.
-y.
Аналогично, заменяя
потенциал y
равным ему потенциалом равновесной
жидкой фазы
![]() ,
получим:
,
получим:
x-y=x-![]() .
.
Из последних равенств
следует, что движущая сила процесса
(x-y)
может быть выражена двумя способами:
либо как разность химических потенциалов,
взятых по газовой фазе, либо как разность
потенциалов, взятых по жидкой фазе. При
этом необходимо помнить, что газовая
фаза с потенциалом
![]() и концентрацией y,
так же как и жидкая фаза с потенциалом
и концентрацией y,
так же как и жидкая фаза с потенциалом
![]() и концентрацией x,-фазы
гипотетические, в реальном процессе
массопередачи отсутствующие - см. рис.
1.1.
и концентрацией x,-фазы
гипотетические, в реальном процессе
массопередачи отсутствующие - см. рис.
1.1.
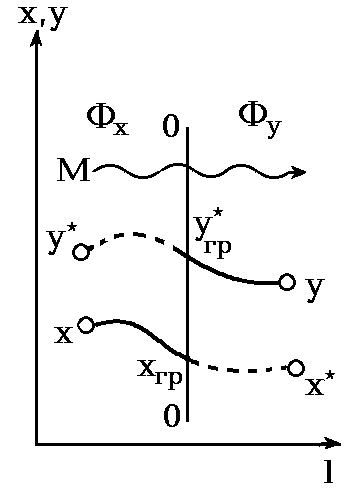
Рис 1.1. Схема процесса массопередачи:
00-граница раздела фаз.
В технических расчетах применяют не химические потенциалы, а более простые, легко определяемые величины-концентрации, с помощью которых также может быть охарактеризовано отклонение фаз Фx и Фy от состояния равновесия. Однако, в отличие от разности химических потенциалов (x-y), которая равна нулю при равновесии фаз, разность концентраций (x-y), в общем случае не равная нулю при равновесии , не может служить мерой отклонения фаз от равновесного состояния, т. е. движущей силой процесса массопередачи. При технических расчетах движущую силу процесса массопередачи-отклонение системы от состояния равновесия-выражают поэтому как разность концентраций (y-y) или (x-x). Так как концентрации могут быть выражены в различных единицах, то движущая сила процесса массопередачи может иметь различные значения-см. пример 1.3.
-
В соответствии с двумя возможными способами выражения движущей силы процесса массопередачи по газовой фазе (y=y-y) или по жидкой фазе (x=x-x)-уравнение массопередачи, аналогичное уравнению теплопередачи, может быть написано в двух видах:
М=КyyсрF (1.10)
или
М=КxxсрF (1.11)
Здесь М-расход компонента, переходящего из одной фазы в другую, кмоль/с; F-площадь поверхности массопередачи, м2; Кy-коэффициент массопередачи, отнесенный к движущей силе y, выраженной через мольные доли компонента в газовой фазе, кмоль/(м2с) ; Кx - коэффициент массопередачи, отнесенный к движущей силе x выраженной через мольные доли компонента в жидкой фазе, кмоль/(м2с); xср и yср-соответствующие средние для всего процесса движущие силы (см. ниже).
В последних уравнениях вместо мольных расходов и концентраций могут быть массовые, а вместо yср могут быть Yср; Сyср и рср; соответственно вместо xср могут быть Xср или Сxср.
-
При определенных допущениях (отсутствие диффузионного сопротивления при переходе компонента через поверхность раздела фаз, существование равновесия на этой поверхности, линейность уравнения равновесия y=mx или y=mx+b) получаются следующие зависимости между коэффициентами массопередачи Кy и Кx и фазовыми коэффициентами массопередачи y и x :
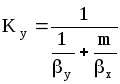 ;
(1.12)
;
(1.12)
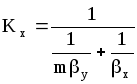 ,
(1.13)
,
(1.13)
где m-тангенс угла наклона линии равновесия. Коэффициенты массоотдачи и массопередачи выражены в кмоль/(м2с).
Знаменатели последних уравнений представляют собой общее диффузионное сопротивление, равное сумме диффузионных сопротивлений газовой и жидкой фаз.
Когда основное
диффузионное сопротивление сосредоточено
в газовой фазе, т. е. при
![]()
![]() ,
,
Кy y . (1.14)
Когда основное
диффузионное сопротивление сосредоточено
в жидкой фазе, т. е. при
![]()
![]() ,
,
Кx x . (1.15)
Из уравнений (1.12) и (1.13) следует, что
Кy =Кx/m (1.16)