
РГЗ №2
.pdf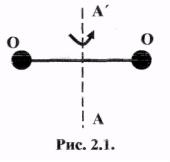
Задачи для самостоятельного решения.
2.1.Найти отношение средних квадратичных скоростей молекул гелия и водорода при одинаковых температурах.
2.2.Средняя квадратичная скорость молекул некоторого газа равна 500 м/с при давление 4·105 Па. Найти плотность газа.
2.3.Найти среднюю арифметическую и среднюю квадратичную скорости молекул газа, плотность которого при давлении 2·105 Пa равна 0,8 г/м2 .
2.4.Во сколько раз средняя квадратичная скорость пылинок, взвешенных в воздухе, меньше средней квадратичной скорости молекул воздуха?
Масса пылинки 10-8 г. Воздух считать однородным газом с молярной массой 29г/моль.
2.5.Два одинаковых сосуда содержат одинаковое число молекул кисло-
рода. Сосуды соединены краном. В первом сосуде средняя квадратичная скорость молекул равна 400 м/с, во втором — 500 м/с. Какой будет эта скорость, если открыть кран, соединяющий сосуды?
2.6.При какой температуре средняя квадратичная скорость атомов гелия станет равной второй космической скорости на Земле?
2.7.При какой температуре молекулы кислорода имеют такую же среднюю квадратичную скорость, как и молекулы водорода при температуре 100 K?
2.8.Колба объемом 4 л содержит некоторый газ массой 0,6 г под давлением 200 кПа. Определить среднюю квадратичную скорость молекул газа.
2.9.Смесь гелия и аргона находится при температуре 1,2·10 К. Определить среднюю квадратичную скорость и среднюю кинетическую энергию атомов гелия и аргона.
2.10.Определить среднюю арифметическую скорость молекул газа, если их средняя квадратичная скорость равна 1 км/с.
2.11.При 0° С вычислить среднюю квадратичную скорость теплового движения молекулы: 1) водорода; 2) азота; 3) кислорода.
2.12.Найти средний квадратичный импульс молекулы водорода Н2 при температуре
27° С.
2.13.При какой температуре средняя квадратичная скорость молекул кислорода равна средней квадратичной скорости молекул азота при температуре 100° С?
2.14.На рис. 2.1 изображена молекула кислорода. Найти значение средней
квадратичной частоты вращения молекулы кислорода при 27° С. Момент инерции молекулы кислорода относительно оси АА' равен 19,2·10-40 г·см3
2.15. Найти кинетическую энергию теплового движения всех молекул кислорода, занимающих объем 5,5 л при давлении 2·105 Па. Колебаниями атомов в молекулах пренебречь.
2.16.Газ, состоящий из жестких двухатомных молекул, находится при температуре 300 К. Вычислить среднюю квадратичную угловую скорость молекулы, если ее момент инерции
2,1·10-39 г·см .
2.17.Считать, что воздух состоит из молекул азота, кислорода, водорода и углекислого газа. Молекулы какого из газов обладают наибольшей средней скоростью?
2.18.Сравнить средние квадратичные скорости молекул двух газов с параметрами: a) p1= 600 кПа, р=1,2 кг/м3; б) Р2=400 кПа, ρ2=0,8 кг/м3.

2.19.При какой температуре средняя кинетическая энергия теплового движения атомов гелия будет достаточна для того, чтобы атомы гелия преодолели земное тяготение и навсегда покинули земную атмосферу?
2.20.Частицы гуммигута диаметром 10-6 м участвуют в броуновском движении. Плотность гуммигута 1.2·103 кг·м3. Найти среднюю квадратичную скорость частиц при
17° С.
2.21.В момент взрыва атомной бомбы температура достигает 107° С. Считать, что при этой температуре молекулы полностью диссоциированы на атомы, а атомы ионизированы. Найти при этих условиях среднюю квадратичную скорость иона водорода.
2.22.Пользуясь распределением Максвелла и понятием относительной скорости а как
отношения скорости молекулы υ к наиболее вероятной скорости υв, получить распределение в приведенном виде:
dN(a)=N× 4 ×e−a 2 ×a2da.

 π
π
2.23. Определить вероятность того, что какая-нибудь молекула кислорода при температуре 0° С имеет скорость, точно равную наиболее вероятной скорости. 2.24. Перейти от распределения Максвелла для молекул по интервалам скоростей к распределению молекул по интервалам энергий:
|
|
|
|
|
|
|
|
1 |
|
|
|
−2ε |
||
4 |
2 |
|
|
|
ε2 |
|
|
|||||||
|
|
|
|
|
2υ |
2 |
|
|||||||
dN(ε) = N × |
|
|
|
× |
|
|
|
|
|
|
× e |
â |
|
dε |
|
|
|
|
3 |
|
|
|
|
||||||
π |
× υâ |
3 |
|
|||||||||||
|
|
|
|
m 2 |
|
|
|
|
||||||
где ε — кинетическая энергия молекулы, υB - наиболее вероятная скорость.
2.25. Доказать, что максимум функции распределения молекул по интервалам энергий:
|
|
|
|
|
|
1 |
|
|
|
|
−2ε |
|
|||||
|
4 |
2 |
|
|
|
ε2 |
|
|
|
|
|||||||
dN(ε) = N × |
|
× |
|
|
|
×e 2υâ 2 dε |
|||||||||||
|
|
|
3 |
|
|
|
3 |
||||||||||
|
|
π |
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
m |
|
× υâ |
|
|
|
|
|
|
|
||||
|
|
|
|
2 |
|||||||||||||
соответствует скорости |
υ = |
υ |
â |
|
. |
||||||||||||
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
||||
2.26.Сколько процентов молекул кислорода обладает скоростями, отличающимися от наиболее вероятной не более чем на 1%?
2.27.Сколько процентов молекул кислорода обладает скоростями, отличающимися от средней квадратичной скорости не более чем на 1%?
2.28.Какая часть молекул азота при нормальных условиях имеет скорости, лежащие в интервале от 99 м/с до 101 м/с?
2.29.При какой температуре число молекул азота, обладающих скоростями в интервале от 299 м/с до 301 м/с, равно числу молекул, обладающих скоростями в интервале от
599 м/с до 601 м/с?
2.30.Сколько процентов молекул азота при температуре 280 К обладает скоростями в интервале от 500 м/с до 510 м/с?
2.31.Сколько процентов молекул кислорода обладает скоростями, отличающимися от наиболее вероятной не более чем на 10 м/с, при температуре 0° С.
2.32.Водород находится при температуре 273 К. Определить отношение числа молекул водорода, обладающих скоростями в интервале от 2000 м/с до 2001 м/с, к числу молекул, обладающих скоростями от 1000 м/с до 1001 м/с.
2.33.Определить температуру при которой функция распределения молекул кислорода по скоростям имеет максимум при скорости 500 м/с.
2.34.Сколько процентов молекул кислорода обладает скоростями, отличающимися от наиболее вероятной скорости не более чем на 10 м/с, при температуре 300° С?
2.35.Найти температуру кислорода, при которой скоростям молекул 400 м/с и 600 м/с соответствуют одинаковые значения функции распределения Максвелла.
2.36.Определить высоту горы, если давление на ее вершине равно половине давления на уровне моря. Температуру считать одинаковой и равной 273 К.
2.37.Определить показания барометра на высоте Останкинской телевизионной башни равной 540 м. Температуру считать одинаковой и равной 280 К.
2.38.При подъеме аэростата барометр изменил свое показание на 11 кПа. На какой высоте находится аэростат, если на поверхности Земли барометр показывал 0,1 МПа? Температуру воздуха считать одинаковой и равной 290 К.
2.39.Чему равна концентрация молекул воздуха на высоте 2км над уровнем моря? Давление на уровне моря 101 кПа, а температура 10° С. Изменением температуры с высотой пренебречь.
2.40.Пылинки массой 10-10 г взвешены в воздухе. Определить толщину слоя воздуха, в пределах которого концентрация пылинок различается не более чем на 1%. Температуру воздуха во всем объеме считать равной 27° С.
2.41.У поверхности Земли концентрация молекул водорода почти в 106 раз меньше, чем концентрация молекул азота. На какой высоте при 0° С концентрация молекул водорода и молекул азота будут равны?
2.42.При наблюдении в микроскоп взвешенных частиц гуммигута обнаружено, что их среднее число в слоях, расстояние между которыми 40 мкм, отличается друг от друга в 2
раза. Диаметр частиц 0,4 мкм, а их плотность на 0,20 г/см больше плотности окружающей жидкости. Температура среды 290 К. Определить по этим данным число Авогадро.
2.43.Найти массу водяного пара, заключенного в столбе атмосферного воздуха сечением 1,0 м2 и высотой 4,15 км. Температура воздуха во всех слоях постоянна и равна 15° С. Парциальное давление паров воды на поверхности Земли 103 Па.
2.44.Толщина слоя воздуха, в пределах которого концентрация взвешенных в воздухе пылинок различается не более чем на 1%, равна 4,2 мм. Определить массу пылинки. Температуру воздуха считать одинаковой и равной 300 К.
2.45.На высоте 123 км от поверхности Земли концентрация молекул водорода и азота равны. Вычислить отношение концентрации молекул водорода и азота у поверхности Земли.
2.46.При наблюдении в микроскоп взвешенных в воде частиц гуммигута оказалось, что среднее число их в слоях, расстояние между которыми 40 мкм, отличается друг от друга в 2 раза. Плотность гуммигута 1,2 г/см3. Температура среды 290 К. Определить диаметр частиц.
III.ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ.
1.Первое начало термодинамики:
Q = E + A ,
где Q - количество теплоты, сообщенное термодинамической системе,
E - изменение внутренней энергии термодинамической системы, A - работа, совершенная термодинамической системой.

2. Работа газа
V2
A = ∫ PdV ,
V1
где V1 и V2 – объемы начального и конечного состояния газа. 3. Внутренняя энергия идеального газа
E = mμ Cμ vT ,
где CμV - молярная теплоемкость газа при постоянном объеме. 4. Количество теплоты
|
|
|
|
|
|
T2 |
|
|||
|
|
|
|
|
|
Q = ∫vCμ dT , |
|
|||
|
|
|
|
|
|
T1 |
|
|||
где T1 и T2 – |
температура начального и конечного состояния газа, |
|||||||||
v – количество молей газа, Cμ |
- молярная теплоемкость газа в процессе. |
|||||||||
5. Теплоемкости идеального газа при постоянном объеме и давлении: |
||||||||||
|
|
|
|
CμV = |
i |
R , |
Cμp = |
i + 2 |
R , |
Cμp = CμV + R . |
|
|
|
|
|
||||||
|
|
|
2 |
|
2 |
|
|
|||
6. Уравнение адиабатного (происходящего без теплообмена) процесса |
||||||||||
|
|
|
|
|
|
PV γ |
= const , |
|
||
где γ = |
Cμp |
= |
i + 2 |
|
|
|
|
|||
|
|
- коэффициент Пуассона. |
|
|||||||
CμV |
|
|
||||||||
|
|
i |
|
|
|
|
||||
7. Уравнение политропного (происходящего при постоянной теплоемкости) процесса
PV n = const ,
где n – показатель политропы.
Примеры решения задач.
Задача1. Газообразный водород, находившийся при нормальных физических условиях в
закрытом сосуде объемом V=5,0 л, охладили на |
T = 55Ê . Найти приращение внутренней |
|||||||||||||
энергии газа и количество отданного им тепла. |
|
|
|
|
|
|||||||||
Дано: |
|
|
|
|
|
|
|
|
Решение |
Q = E + A |
|
|||
P =1,0 ×105 Ïà |
|
Из первого начала термодинамики |
(1) |
|||||||||||
|
||||||||||||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T0 = 273Ê |
|
Для изохорного процесса |
Q = DE = vCμV DT , |
|
||||||||||
V = 5,0 ×10−3 ì 3 |
|
так как работа газа А=0. |
|
|
|
|
|
|||||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T = 55Ê |
|
Учитывая, что CμV = |
i |
R , а vR = |
P0V0 |
, как следствие из |
|
|||||||
|
|
|
|
|||||||||||
|
|
|
|
|
2 |
|
|
|
|
T0 |
|
|
||
Q, E − ? |
|
|
|
|
|
|
|
|
|
|
||||
|
уравнения состояния идеального газа, окончательно получим |
|||||||||||||
|
|
|
|
|
Q = DE = |
i |
P V |
DT . |
|
(2) |
||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
2 |
|
0 |
0 T |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
Для молекулярного водорода число степеней свободы молекулы i = 5. |
|
|||||||||||||
Проверка размерности: |
|
|
|
|
|
|
|
|
|
|
|
|||
[P]×[V ]= Ïà × ì 3 = |
Í |
|
ì 3 = Í × ì = Äæ . |
|
|
|
|
|
|
|
||||
|
2 |
|
|
|
|
|
|
|
||||||
|
|
ì |
|
|
|
|
|
|
|
|
|
|
||

Вычисления:
|
5 |
|
|
|
55 |
|
|
|
Q = DE = |
|
×1,0 ×105 ×5,0 ×10 |
−3 × |
- |
|
|
= -252 Äæ . |
|
2 |
273 |
|||||||
|
|
|
|
|
|
Ответ: Q = E = −0,25êÄæ .
Задача 2. Три моля идеального газа при температуре T1 = 300Ê изотермически
расширили в 4 раза, а затем изохорно нагрели так, что его давление стало равно первоначальному. За весь процесс газу сообщили количество тепла Q = 67,0êÄæ .
Определить коэффициент Пуассона для этого газа.
Дано: |
|
|
|
|
|
|
|
|
|
|
|
|
Решение |
|
|
|
|
|
|
|
|
|
|
|
|
||
T1 = 300Ê |
|
|
|
|
|
В процессе изотермического расширение газа из |
|||||||
n = V2 V1 = 4 |
|
|
|
|
|
состояния I (P1 ,V1 ) |
в состояние II (P2 ,V2 ) к газу |
||||||
P1 = P3 |
|
|
|
|
|
подводится тепло |
Q12 = A12 = vRT ln(V2 V1 ) . |
||||||
Q = 6,7 ×104 Äæ |
|
|
|
|
|
В процессе изохорного нагрева к газу подводится |
|||||||
|
|
|
|
|
|
количество теплоты Q23 = DE = vCμV (T3 -T1 ). |
|||||||
γ −? |
|
|
|
|
|
||||||||
|
|
|
|
|
Для нахождения T3 воспользуемся уравнениями |
||||||||
изохорного и изотермического процессов: |
|
|
|
||||||||||
T = T |
P1 |
, |
PV = P V . |
|
|
|
|||||||
|
|
|
|
|
|
||||||||
3 |
1 P |
|
|
1 1 |
2 2 |
|
|
|
|||||
|
2 |
|
|
|
|
|
|
|
|
||||
Для T3 получим T = T |
V2 |
|
= nT . |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||||
3 |
1 V |
|
1 |
|
|
|
|
|
|
||||
|
1 |
|
|
|
|
|
|
|
|
|
|||
Коэффициент Пуассона связан с числом степеней свободы молекулы |
|||||||||||||
газа соотношением |
γ = |
Cμp |
= |
|
i + 2 |
. |
|
|
|
||||
CμV |
|
i |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
Из полученного выражения следует, что i = |
2 |
. |
|||||||||||
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
γ -1 |
||
Для Q23 окончательно получаем
Q23 = vRT1 (n -1) .
γ -1
При переходе газа из состояния I в состояние III затрачивается количество теплоты
|
|
|
|
|
|
|
|
|
|
|
n -1 |
|
|
||||
Q = Q |
|
+ Q |
|
|
|
= vRT ln n |
+ |
|
|
|
. |
(1) |
|||||
|
|
|
γ |
||||||||||||||
12 |
|
|
23 |
|
|
|
|
|
|
|
|||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
||||||
Из (1) выразим коэффициент Пуассона |
|
|
|
|
|
|
|
|
|
|
|||||||
γ =1+ |
|
n -1 |
. |
|
|
|
|
|
|
|
|
|
|||||
|
Q |
|
|
|
- ln n |
|
|
|
|
|
|
|
|
|
|||
|
|
vRT1 |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Убедимся, что соотношение |
|
Q |
|
|
|
является безразмерной величиной: |
|
||||||||||
|
vRT |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
[Q] |
|
= |
|
|
|
Äæ |
|
|
|
|
|
. |
|
||||
[v]×[R]×[T ] |
ìîëü |
× |
|
Äæ |
|
|
× Ê |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
ìîëü |
× Ê |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||

Вычисления:
|
γ =1+ |
|
|
4 -1 |
|
|
=1,4 . |
|
||||
|
|
×104 |
|
|
|
|
||||||
|
|
6,7 |
|
- ln 4 |
|
|||||||
|
3×8,31×300 |
|
||||||||||
|
|
|
|
|
|
|||||||
Ответ: γ =1,4 . |
|
|
|
|
|
|
|
|
|
|
|
|
Задача 3. Объем одного моля идеального газа с коэффициентом Пуассона γ = 5 3 |
||||||||||||
изменяют по закону VT = a, где а – |
положительная константа. Найти количество теплоты, |
|||||||||||
полученное газом в этом процессе, если его температура возросла на |
T = 60Ê . |
|||||||||||
Дано: |
|
|
|
|
|
|
|
|
|
|
Решение |
|
|
|
|
|
|
|
|
|
|
|
|
||
γ = 5 3 |
|
В процессе изменяются все макроскопические параметры |
||||||||||
v =1ìîëü |
|
состояния идеального газа P, V и T. Малое изменение |
||||||||||
T = 60Ê |
|
количества теплоты согласно первому началу термодинамики |
||||||||||
|
|
|
|
δQ = dE + δA = CμV dT + PdV , |
|
|||||||
Q −? |
|
|
|
(1) |
||||||||
|
|
где CμV = |
i |
R = |
R |
. |
|
|||||
|
|
|
|
|||||||||
|
|
|
|
|
2 |
|
|
γ -1 |
|
|||
Выразим уравнение процесса в параметрах P и V. Для этого воспользуемся уравнением состояния газа и условием задачи:
PV = RT ,T = a .
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
|
|
|||
Исключая температуру, получим: |
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
P = |
aR |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
V 2 |
|
|
|
|
|
|
|
|
|
||||
Подставляя (2) в (1), приходим к выражению |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
δQ = |
R |
|
dT + R |
a |
|
dV . |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
γ -1 |
|
V 2 |
|
|
|
||||||
Интегрируя (3), получаем |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
R |
a |
|
a |
R |
|
|
|
|
|
|
|
2 - γ |
||||||||
Q = γ -1 DT + R V |
- V |
|
= γ -1 DT - RDT = |
|
γ -1 RDT . |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||
Проверка размерности: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
[v]×[R]×[T ] |
= ìîëü |
× |
|
|
Äæ |
|
× Ê = Äæ . |
||||||||||||
|
|
|
|
|
|
|
|||||||||||||||
|
|
ìîëü |
× Ê |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Вычисления:
Q = 2 - 5 3 ×8,31×60 = 250 Äæ . 5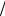 3 -1
3 -1
Ответ: 0,25кДж.
(2)
(3)
Задача 4. Найти молярную теплоемкость идеального газа в политропном процессе = const , если n = 3, а показатель адиабаты для этого газа γ = 5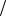 3 .
3 .
Решение Воспользуемся первым началом термодинамики в дифференциальной форме
|
δQ = dE +δA , |
|
(1) |
|
|
||
Cμn −? |
где δQ = vCμn dT , dE = vCμV dT , |
δA = PdV . |
(2) |
|
Подставим (2) в (1), учитывая, что |
P = d V n , |
где d = const : |
Cμn = CμV + |
1 d |
|
dV |
|
||||
|
|
|
|
|
|
. |
(3) |
|
v V |
n |
|
||||||
|
|
|
dT |
|
||||
В полученном выражении определим производную dV 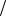 dT . Для этого воспользуемся
dT . Для этого воспользуемся
уравнениями политропического процесса и состояния идеального газа, и выразим уравнение процесса в параметрах V и T:
|
|
|
|
|
|
|
|
|
TV n−1 = |
d |
. |
|
|
|
(4) |
|||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
vR |
|
|||||
Дифференцируя (4), получаем |
|
|
|
dT |
= |
d |
|
1- n |
и подставим в (3): |
|||||||||||
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
dV vR V n |
|
|||||||
Cμn = CμV + |
|
R |
= |
|
R |
- |
R |
|
= |
|
R(n - γ ) |
. |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||
1 |
- n |
γ -1 n -1 (γ -1)(n -1) |
|
|||||||||||||||||
Проверка размерности: |
]= [R]= |
|
|
|
. |
|
|
|
|
|
|
|||||||||
|
|
|
[Cμ |
Äæ |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
ìîëü |
× Ê |
|
|
|
|
|
|
|
|
|||
Предельные случаи: 1) при n = 0 получаем P = const, т.е. теплоемкость дли изобарного
процесса Cµn = Cµp;
2) при n = γ получаем S = const, т.е. теплоемкость адиабатного
процесса Cµn = 0.
|
|
3 - 5 / 3 |
|
Äæ |
|
|
||||
Вычисления: Cμn |
= R × |
|
|
|
|
= 8,31 |
|
|
. |
|
(5 / 3 |
-1)(3 |
-1) |
ìîëü |
× Ê |
||||||
|
|
|
|
|||||||
Ответ: Cμn = 8,31 |
Äæ |
|
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|||
|
ìîëü × Ê |
|
|
|
|
|
|
|||
Задачи для самостоятельного решения.
3.1.Для газообразного ацетона (СН3СОСНз) определить коэффициент Пуассона.
3.2.Определить удельные теплоемкости двухатомного газа, если платность его при нормальных условиях 1,43·10-3 г/см3.
3.3.Вычислить удельные теплоемкости смеси 2 молей азота и 5 молей гелия.
3.4.Молярная масса газа равна 18 г/моль. Коэффициент Пуассона равен 1,33. Вычислить удельные теплоемкости этого газа.
3.5.Какой из указанных газов при комнатной температуре имеет наибольшую удельную теплоемкость: 1) О2; 2) H2; 3) Не; 4) Ne; 5) I2?
3.6.Найти молярные теплоемкости смеси 0,5 молей паров воды и 0,2 моля азота.
3.7.Приняв массу атома гелия равной 6,6·10-27 кг, определить удельную теплоемкость гелия при постоянном объеме.
3.8.Удельная теплоемкость влажного воздуха при постоянном объеме равна
1,2·103 Дж/кг·К. Определить относительную влажность воздуха. Молярная масса сухого воздуха 29 г/моль. Температура 300 К.
3.9.Вычислить коэффициент Пуассона газовой смеси, состоящей из 3,0 молей гелия и 2,0 молей водорода.
3.10.Молярная масса газа равна 32 г/моль. Определить удельные теплоемкости газа при постоянном объеме и постоянном давлении, если коэффициент Пуассона для газа равен
1,4.
3.11.Чему равны удельные теплоемкости газа, плотность которого при нормальных условиях равна 1,76·10-3 г/см3?
3.12.Вычислить удельные теплоемкости для углекислого газа.
3.13.Вычислить коэффициент Пуассона для смеси, состоящей из 2,0 молей кислорода и 3,0 молей углекислого газа.
3.14.Вычислить удельные теплоемкости Cv и Ср для смеси, состоящей из 7 г азота и 20 г аргона.
3.15.Удельная теплоемкость газа при постоянном давлении Ср=970 Дж/кг·К, а молярная масса равна 30 г/моль. Определить число степеней свободы молекулы этого газа.
3.16.Определите молярную массу газа, если разность между удельными теплоемкостями
Ср-Cv =260 Дж/кг·К.
3.17.Определить удельные теплоемкости Cv и Ср, если для газа коэффициент Пуассона равен 1,4, а плотность при нормальных условиях 1,25 кг/м3 .
3.18.Отношение удельных теплоемкостей смеси, состоящей из азота и 5 молей аммиака, равно 1,35. Определить число молей азота в смеси.
3.19.Определить удельные теплоемкости смеси, состоящей из 1 моля азота, 4 молей метана и 8 г аргона.
3.20.Воздух содержит 25% водяного пара. Определить удельную теплоемкость при постоянном объеме влажного воздуха. Для сухого воздуха молярную массу принять равной 29 г/моль.
3.21.Найти удельные теплоемкости воздуха, считая, что в его состав входит 76% азота, 23% кислорода, 1% аргона.
3.22.Количество теплоты, необходимое для нагревания газа на 25 К при постоянном давлении, равно 500 Дж. Количество теплоты, выделяемое этим газом при охлаждении на 75 К при постоянном объеме, равно 1,07 кДж. Определить коэффициент Пуассона.
3.23.При изотермическом сжатии 14 г азота, взятого при 20° С, была совершена работа 2200 Дж. Во сколько раз возросло давление газа?
3.24.В закрытом сосуде находится 14 г азота при давлении 105 Па и температуре 27° С. После нагревания давление повысилось до 5·105 Па. Какое количество теплоты сообщено
газу? Определить приращение внутренней энергии.
3.25.Из баллона, содержащего водород под давлением 106 Па и при температуре 18° С, выпустили половину находящегося в нем газа. Считая процесс адиабатным, определить конечную температуру и давление.
3.26.При изобарном расширении водород совершил работу 4000 Дж. Какое количество
теплоты подведено к газу? Определить приращение его внутренней энергии.
3.27.В адиабатном процессе внутренняя энергии кислорода уменьшилась на 2000 Дж. Найти работу, совершенную газом и массу газа. Начальная температура газа 47° С, его объем увеличился в 10 раз.
3.28.Углекислый газ массой 3,2 кг имеет температуру -17° С. Объем газа изотермически уменьшают в 3 раза. Какую работу совершил газ? Как изменилась внутренняя энергия газа? Какое количество теплоты выделилось?
3.29.При изобарном расширении 2 кг кислорода совершена работа 98 Дж. Определить приращение внутренней энергии газа. Какое количество теплоты получил газ? До какой температуры нагрели газ? Начальная температура 0° С.
3.30.Какое количество теплоты надо сообщить кислороду, находящемуся в сосуде объемом 30 л при температуре 27° С и давлении 400 мм рт. ст., чтобы нагреть газ на 120° С? Определить приращение внутренней энергии газа и совершенную газом работу.
3.31.Водяной пар при изобарном расширении совершил работу, равную 2100 Дж. Какое количество теплоты подвели к пару? Как изменилась его внутренняя энергии?
3.32.При нормальных условиях 1 моль азота расширяется адиабатно до V2= 7V1. Вычислить работу газа.
3.33. При адиабатном сжатии 10 г водорода температура повысилась на 100° С. Определить работу, затраченную на сжатие.
3.34. Водород под давлением 105 Па занимает объем 5 л. Газ адиабатно сжали до объема в 1 л. Вычислить работу, совершенную в этом процессе.
3.35.Водород массой 4 г нагрет при постоянном давлении на 50° С. Определить количество теплоты, переданное газу, приращение его внутренней энергии и работу, совершенную газом.
3.36.При изобарном расширении двухатомный газ совершил работу 2·10 Дж. Какое количество теплоты подвели к газу?
3.37.Кислород массой 4 г находится при нормальных условиях. При изотермическом расширении объем газа увеличился до 12 л. Вычислить работу, совершенную газом, и сообщенное ему количество теплоты.
3.38.При изобарном расширении внутренняя энергия трехатомного газа увеличилась на 1000 Дж. Какую работу совершил газ? Какое количество теплоты сообщили газу?
3.39.При изохорном охлаждении киломоля трехатомного газа давление уменьшается в 3 раза. Затем газ изобарно расширяется так, что в конечном состоянии его температура
равна первоначальной. Изобразить процесс на диаграмме Р, V. Вычислить Q, U и А. Температура газа равна 27° С.
3.40.Двухатомный газ расширяется изобарно. Какая часть теплоты расходуется на увеличение его внутренней энергии, а какая на совершенную им работу?
3.41.Баллон, содержащий 20 г водорода и 1 г гелия, нагрели на 50° С. Определить приращение внутренней энергии смеси и сообщенное количество теплоты.
3.42.Газ, расширяясь, переходит из одного и того же состояния от объема V1 до объема V2: а) изобарно; б) адиабатно; в) изотермически. В каких процессах газ совершает наименьшую и наибольшую работу?
3.43.Один моль идеального газа находился при нормальных условиях. При изотермическом расширении газу подвели 2,27 кДж теплоты. Какую работу совершит этот газ, расширяясь изобарно до того же объема, что и в первом случае?
3.44.Моль идеального газа изотермически сжимают до объема в 2,7 раза меньше начального и отводят от газа 2,24 кДж количества теплоты. Какую работу необходимо совершить, чтобы изобарно газ вернуть в состояние с объемом, равным начальному?
3.45.Идеальный газ, расширяясь один раз изобарно, другой раз изотермически из одного и того же состояния, увеличивает объем в 5 раз. Определить отношение работ газа изобарного и изотермического расширения.
3.46.Кислород, расширяясь один раз изотермически, другой раз адиабатно из одного и того же состояния, увеличивает объем в 4 раза. Определить отношение работ газа изотермического и адиабатного расширения.
3.47.Один моль идеального газа, взятого при температуре 300 К, изотермически увеличивает объем в 2 раза, затем газ изохорно нагревают до начального давления. За весь процесс газу сообщают количество теплоты, равное 7,96 кДж. Найти коэффициент Пуассона.
3.48.Найти молярную теплоемкость идеального газа в процессе, при котором температура газа пропорциональна квадрату его объема. Молярная теплоемкость газа при постоянном объеме известна.
3.49.Найти молярную теплоемкость идеального газа в процессе, при котором температура газа обратно пропорциональна его объему. Молярная теплоемкость газа при постоянном объеме известна.
3.50.Объем 3 молей гелия изменяется по закону V=αT4, где α>0. Определить количество теплоты, полученное газом в этом процессе, если его температура увеличилась на 40 К.
3.51.Работа идеального газа пропорциональна приращению его внутренней энергии. Найти уравнение данного процесса Р = f (V).
3.52.Определить молярную и удельную теплоемкости кислорода в процессе
pV2=const.
3.53. В политропном процессе pV2 =const азоту сообщили количество теплоты, равное 3,0 кДж. Какую работу совершил газ?

3.54.В политропном процессе pV1,2 =const кислород нагревается. При этом он отдает количество теплоты 5,0 кДж. Определить работу, совершаемую газом.
3.55.В политропном процессе pV2 =const два моля кислорода нагревают на 40 К. Определить количество теплоты, сообщенное газу.
3.56. Определить молярную и удельную теплоемкости азота в процессе
TV0,2=const.
3.57.В политропном процессе TV0,2=const два моля азота нагревают на 30 К. Определить, какое количество теплоты отводится от газа.
3.58.Один моль гелия совершает процесс, в котором температура меняется по закону
T=To+αV, где Т0=200 К, α=104 К/м3. Определить количество теплоты, сообщенное газу при расширении от 10 л до 20 л.
3.59.Один моль кислорода совершает процесс, в котором давление изменяется по закону
p=po+αV, где ро=0,1 МПа, α=10 кПа/м3. Определить количество теплоты, сообщенную газу при расширении от 10 л до 20 л.
3.60.Один моль неона совершает политропный процесс с показателем n=1,5. Приращение температуры газа равно T = -26 К. Найти: а) количество теплоты, полученное газом; б) работу, совершенную газом; в) изменение внутренней его энергии.
3.61.Идеальный двухатомный газ расширяется так, что давление в процессе изменяется по закону p=αV, где α=107 Па/м3. Объем газа в начальном состоянии 1 л, в конечном 3 л. Вычислить: а) изменение внутренней энергии газа; б) работу, совершенную газом в процессе; в) молярную теплоемкость газа.
3.62.Идеальный газ совершает процессы: а) pVγ=const; б) pV=const; в) pV2=const. В каком из этих процессов при увеличении объема газа внутренняя энергия газа увеличится?
3.63.Идеальный газ совершает процессы: а) pV2=const; б) pV=const; в) pV1/2=const. В каком из этих процессов при равном приращении объема газ совершает максимальную работу?
3.64.Принимая, что воздух поднимаясь в атмосфере, расширяется как идеальный газ, определить изменение его температуры при увеличении высоты. На сколько уменьшится его температура при подъеме на высоту 1км?
IV. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ.
1.Коэффициент полезного действия (КПД) тепловой машины
η= A = 1− QX ,
|
QÍ |
QÍ |
где A – |
работа, совершенная тепловой машиной за цикл, |
|
QН – |
количество теплоты, полученное от нагревателя за цикл, |
|
QX – |
количество теплоты, переданное холодильнику за цикл. |
|
2. КПД цикла Карно
η = 1− TX ,
TÍ
где TX – температура холодильника, TН – температура нагревателя. 3. Приращение энтропии термодинамической системы
dS = δQ , T
где δQ - количество теплоты, переданное системе. 4. Первое начало термодинамики:
TdS = dE + pdV . 5. Связь между энтропией и статистическим весом:
S = k ln Ω ,
где F – статистический вес.
