
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Ивановский государственный энергетический университет имени В.И. Ленина»
Кафедра ХХТЭ
Курсовая работа на тему:
«Расчёт процессов и аппаратов для ВПУ паровых котлов среднего давления»
Выполнила: студентка гр. III-3х
Зайцева Ю.С.
Проверил: Ларин А.Б.
Иваново 2013
Расчет показателей качества воды для установки обратного осмоса
Исходная вода
Исходной обычно служит природная вода, примерный химический состав примесей которой приведен в табл. 4. В качестве примера взята вода поступающая на химводоочистку расходом 300 м3/ч.
Таблица 4. Химический состав примесей воды
|
Показатель |
Жесткость, мг-экв/л |
Концентрация ионов, мг/л |
Що, мг-экв/л |
Ок, мгО/л | |||||||||
|
Жо |
ЖСа |
Na++K+ |
SO42- |
Cl- |
NO3- |
SiO22- |
ГДП |
|
| ||||
|
Численное значение |
4,3 |
3,0 |
2,8 |
13,5 |
25,5 |
- |
10 |
- |
3,3 |
8,3 | |||
Проверка анализа исходной воды выполняется по уравнению электронейтральности:
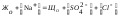 ,
,
4,3 + 2,8/23=3,3 + 13,5/48 + 25,5/35,5
4,42≠4,3.
Ошибка химического анализа должна быть не более 2 % и в данном случае составляет:
 =2,71
% > 2 %
=2,71
% > 2 %
Так как сумма катионов больше суммы анионов, то корректируем
[
 =
=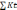
 - Що – [Cl-] –
[
- Що – [Cl-] –
[
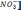
Жо+ [Na+] = Що+
[
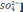 + [Cl-]
+ [Cl-]
4,3 + 2,8/23 = 3,3 + 0,4 + 25,5/35,5
[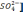
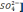 = 4,42 – 3,3 – 25,5/35,5 = 0,4 мг(экв)/л
= 4,42 – 3,3 – 25,5/35,5 = 0,4 мг(экв)/л
Ош=
 =0%<2%
=0%<2%
ЖCa2+=[Сa2+]
Жо=[Сa2+]+[Mg2+]= ЖCa2++ ЖMg2+ => [Mg2+]= ЖMg2+ = Жо- ЖCa2+=1,3 мг(экв)/л
[HCO3- ]=Що= Жк=3,3 мг(экв)/л
Жо=Жк+Жнк => Жнк= Жо- Жк=1,0 мг(экв)/л
Для дальнейших расчетов данные табл. 4 следует переписать с пересчетом концентраций ионов в мг-экв/л и моль/л (см. табл. 5).
Расчет характеристики «стабильность» воды производится сравнением равновесной и фактической концентрации углекислоты в воде. Поскольку значения рН исходной воды не задано, принимаем рН=7. Для определения активностей ионов в воде найдем ионную силу (μ) и коэффициенты активности γI и γII.
=0,5(Сi zi2)=0,5([Ca2+](Z Ca2+)2+ [Mg2+](Z Mg2+)2+[Na+](Z Na+)2+[SO42-](Z SO2-)2+[Cl-](Z Cl-)2 +[HCO3-](Z HCO-)2)=0,5(1,5×22+0,65×22+0,122×12+0,141×22+0,718×12+3,3×12)=13,304×10-3
 ,
,
где, Сi – концентрации ионов, моль/л; z – заряд i-го иона.
Для нашего случая μ=13,304×10-3; γI=0,888; γII=0,621. Равновесная концентрация углекислоты определяется равновесием следующих химических реакций:
Н2СО3 →;← НСО3– + Н+,
НСО3– →;← СО32– + Н+,
СО32– + Ca2+ →;← CaСО3 ↓(тв).
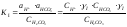 ,
,
pH=7; ан+=10-7
Равновесная концентрация углекислоты равна:
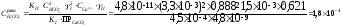 моль/л
моль/л
где
КI
и КII
– константы диссоциации углекислоты
по I
и II
ступеням;
 – произведение растворимости СaCO3;
– произведение растворимости СaCO3;
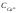 ,
,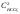 – концентрации ионов кальция и
бикарбонатов, моль/л.
– концентрации ионов кальция и
бикарбонатов, моль/л.
Фактическая концентрация углекислоты определяется из уравнения диссоциации по первой ступени: Н2СО3 →;← НСО3– + Н+ по закону действующих масс в формуле (1), откуда
 моль/л (1)
моль/л (1)
Таблица 5. Пересчет концентраций ионных примесей воды по табл. 4
|
Показатель |
Концентрация ионов, мг-экв/л | ||||||
|
Ca2+ |
Mg2+ |
Na++K+ |
SO42- |
Cl- |
HCO3- |
SiO22- | |
|
Концентрации: а) мг-экв/л; б) моль/л |
3,0 1,5 |
1,3 0,65 |
0,122 0,122 |
0,281 0,141 |
0,718 0,718 |
3,3 3,3 |
0,333 0,167 |
Для
нашего случая:
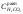 =1,8
=1,8 моль/л;
моль/л;
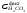 =
=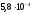 моль/л.
моль/л.
Таким
образом, исходная вода – агрессивная,
т.к.
 <
< .
.
Расчет удельной электропроводности исходной воды может быть выполнен по методике, приведенной в книге Чебанова С.Н., Ларина Б.М. «Водоподготовка и водный режим тепловых электростанций», гл. 20, с. 321 – 322.
В данном случае могут быть использованы следующие выражения для расчета средних значений эквивалентных электропроводностей:
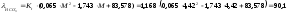 Ом-1·см-1·экв-1;
Ом-1·см-1·экв-1;
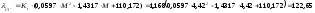 Ом-1·см1·экв-1;
Ом-1·см1·экв-1;
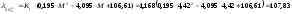 Ом-1·см-1·экв-1;
Ом-1·см-1·экв-1;
где М=ΣKt=ΣAn=4,42 – минерализация воды, мг-экв/л;
Кt = 1+0,024(t–18 °С)=1+0,024∙(25−18)=1,168 – температурный коэффициент электропроводности при температуре раствора t ºС.
Тогда удельная электропроводность (χ, мкСм/см) определяется так:

Где
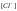 и
и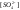 – концентрации хлоридов и сульфатов,
мг-экв/л.
В рассматриваемом примере
имеем:
– концентрации хлоридов и сульфатов,
мг-экв/л.
В рассматриваемом примере
имеем:
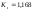 ;
;
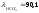 Ом-1·см-1·экв-1;
Ом-1·см-1·экв-1;
 Ом-1·см-1·экв-1;
Ом-1·см-1·экв-1;
 Ом-1·см-1·экв-1.
Ом-1·см-1·экв-1.
Удельная электропроводность воды:
 мкСм/см.
мкСм/см.
Осветленная и умягченная вода
Принципиальная схема предочистки и умягчения воды может быть представлена по рис. 8
 Рис.
8. Принципиальная схема
Рис.
8. Принципиальная схема
осветления и умягчения воды:
1 – подогреватель сырой (исходной) воды; 2 – осветлитель; 3 – бак осветленной воды; 4 – насос подачи осветленной воды на механические фильтры; 5 – механические фильтры; 6 – Na-катионитные фильтры
В подогревателе 1 исходная вода подогревается до температуры 30÷50 ºС для ускорения химических реакций. В осветлителе производится коагуляция коллоидных (органических) примесей и удаление шлама и грубодисперсных (взвешенных) примесей. Обычно при ЩО > 2 мг-экв/л рекомендуется наряду с коагуляцией производить известкование воды в осветлителе 2 в целях снижения щелочности (или всех форм углекислоты) в воде. Обычно при этом уменьшается общая жесткость и кремнесодержание воды. Переливом вода из осветлителя поступает в бак осветленной воды 3, откуда насосом 4 прокачивается через механические 5 и Na-катионитные фильтры 6. При этом из воды удаляется «проскочивший» из осветлителя шлам и удаляются катионы накипеобразователи (Ca2+, Mg2+) в обмен на Na+из катионита. Умягченная вода накапливается в баке и расходуется на технологические нужды, в том числе, на питание установок обратного осмоса в целях обессоливания.
В рассматриваемом примере щелочность природной воды по табл. 4 равна 2,6 мг-экв/л, т.е. более 2 мг-экв/л, и в этом случае рекомендуется совмещение коагуляции воды с ее известкованием в осветлителе. Принципиальная схема осветлителя для коагуляции с известкованием приведена на рис. 9.

Рис. 9. Схема осветлителя типа ВТИ для известкования и коагуляции воды:
1 – подача обрабатываемой воды; 2 – воздухоотделитель; 3 – распределительная система; 4 – опускная труба; 5 – тангенциальный ввод воды; 6 – смеситель; 7 – подача раствора ИМ; 8 – подача раствора коагулянта; 9 – шламоприемные окна; 10 – шламоуплотнитель; 11 – слой контактной среды; 12 – водозаборное устройство; 13 – сборный желоб с отверстиями; 14 – выход осветленной воды; 15 – зона осветления; 16 – зона контактной среды; 17 – периодическая продувка; 18 – непрерывная продувка
В качестве коагулянта используется обычно сульфат железа (II), кристаллогидрат которого имеет химическую формулу FeSO4·7H2O. Известь вводится в виде известкового молока – суспензии Ca(OH)2 в воде. В ряде случаев используется насыщенный раствор Ca(OH)2, чтобы избежать процесса растворения твердого Ca(OH)2 и ускорить химические реакции.
Химические реакции, протекающие в воде при известковании, изложены в книге Чебанова С.Н. и Ларина Б.М. «Водоподготовка и водный режим тепловых электростанций», гл. 5, с. 81 – 89. Там же на с. 322 – 324 приведены расчетные уравнения для определения требуемой дозы извести и коагулянта, количества и качества образующегося щлама. Показатели качества осветленной воды при разных схемах осветления воды могут быть определены по табл. 6.
Таблица 6. Показатели качества осветленной воды после разных схем предочистки
|
Показатель |
-М- |
-К-М- |
-К-И-М- |
-К-И-С-М- |
|
Остаток коагулянта, мг/л |
– |
<0,2 |
<0,1 |
<0,1 |
|
Снижение окисляемости, % |
0 |
50–75 |
40–50 |
40-50 |
|
Снижение содержания кремниевой кислоты, % |
0 |
10–20 |
30–40 |
30–40 |
|
Свободная углекислота, мг/л |
|
|
0 |
0 |
|
Щелочность общая, мг-экв/л: гидратная карбонатная бикарбонатная |
0 0
|
0 0
|
0,7–1,3 0,1–0,2 0,6–1,2 0 |
1–1,5 0,1–0,2 0,8–1,4 0 |
|
Жесткость общая, мг-экв/л, в т.ч. Жнк ЖMg |
|
|
0
(1–0,2)· |
1–1,5 0
(1–0,2) |
|
Сульфаты, мг-экв/л |
|
|
|
|
|
Взвешенные в-ва, мг/л |
2 |
2 |
2 |
2 |
|
Прозрачность "шрифт", см |
40 |
40 |
40 |
40 |
|
рН |
рНисх |
рНисх– (0,1÷0,5) |
9,5–10,5 |
9,5–10,5 |
|
Солесодержание, мг/л |
Sисх |
Sисх +ЭкDк |
Sисх–Эк·Dк–50·Що–3,5·Ок | |
|
Примечание. исх – соответствует концентрации такого показателя в исходной воде; ос - соответствующий концентрации такого показателя в осветленной воде; Эк – эквивалент коагулянта; Дк – доза коагулянта, мг-экв/л; Ок – окисляемость исходной воды, гО/л | ||||
В рассматриваемом здесь примере при дозе коагулянта Дк=0,07∙Ок=0,07∙8,3=0,6 мг-экв/л показатели качества осветленной воды будут следующими:
- окисляемость – Окосв=0,6∙8,3=4,98 мгО/л;
- щелочность: общая ЩО=0,8 мг-экв/л;
гидратная ЩГ=0,2 мг-экв/л;
карбонатная ЩК=0,6 мг-экв/л;
- жесткость общая Жоосв=Щоосв+ЖНКисх+ДК=0,8+0,74+0,72=2,26 мг-экв/л;
- сульфаты [SO42-]осв=[SO42-]исх + ДК=0,281+0,6=0,881 мг-экв/л;
- взвешенные вещества – 2 мг/л;
- рН - 10 ед.рН;
- натрий - 0,122мг-экв/л;
- хлориды - 0,718 мг-экв/л;
-ЖоОсв = ЩоОсв+ Жнк+ Дк= 0,8+1,0+0,6=2,4 мг-экв/л
- Ж Са2+осв = Жоосв+ Ж Mg2+осв =2,4 – 0,65=1,75 мг-экв/л;
- Ж Mg2+осв =0,5∙Ж Mg2+исх=0,5∙1,3=0,65 мг-экв/л.
Проверка ионного состава примесей по уравнению электронейтральности дает ошибку:

Расчетная (требуемая) величина дозы извести, вводимой в обрабатываемую воду (Дитр,
мг-экв/л), определяется по уравнению
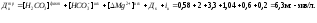
при выражении всех концентраций в мг-экв/л.
При этом избыток извести (iи) можно принять равным гидратной щелочности осветленной
воды (Щг): iи= Щг=0,2 мг-экв/л.
Величину
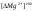 =0,8∙
=0,8∙ мг-экв/л.
мг-экв/л.
Количество образующегося в осветлителе осадка, мг/л
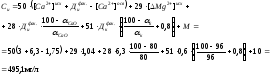
где
СаО
– содержание окиси кальция в технической
извести, % от общей массы; М – содержание
механических примесей, мг/л; к
– содержание коагулянта FeSO4
в техническом продукте, % от общей массы;
[Са2+]исх,
[Са2+]осв
– концентрация катионов кальция в
исходной и в осветленной воде, мг/л;
 – фактическая доза извести, мг-экв/л,
– фактическая доза извести, мг-экв/л,
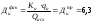 мг-экв/л,
мг-экв/л,
Здесь Ки – концентрация извести в баках-мерниках, г-экв/л;
qи – расход рабочего раствора известкового молока в осветлителе, л/ч; Qисх – расход воды через осветлитель, м3/ч.
Основной характеристикой химического состава шлама, показывающей отношение Mg(OH)2/СаСО3, является м. Оптимальные значения м составляют от 0,050,1 до 0,20,25.
Расчетом параметр м определяется как:
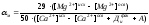 ,
,
где
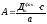 (а
– масса Са(ОН)2
в известковом молоке, мг/л; с – количество
СаСО3
в известковом молоке, мг/л; можно принять
с/а=0,05).
(а
– масса Са(ОН)2
в известковом молоке, мг/л; с – количество
СаСО3
в известковом молоке, мг/л; можно принять
с/а=0,05).
 =0,09952.
=0,09952.
Пропуск осветленной воды через механический фильтр снижает концентрацию взвешенных веществ (шлама) до 1 мг/л и предупреждает случайные забросы шлама из осветлителя. После Na-катионитных фильтров уменьшается общая жесткость воды до величины остаточной жесткости – ЖoNa=0,1 мг-экв/л. При этом в воду поступает эквивалентное удаленному количество Na+, мг-экв, согласно уравнению химической реакции ионного обмена:
2NaR+Ca2+ →;← CaR2+2Na+.
Таким образом для нашего случая в фильтрате Na-катио-нитного фильтра имеем:
Жo=0,1 мг-экв/л; [Na+]=0,122+2,4=2,522 мг-экв/л.
Концентрации других ионных примесей остаются неизменными. Если требуется более глубокое удаление из воды катионов кальция и магния, то применяют 2-ю ступень умягчения воды на Na-катионитных фильтрах, что позволяет снизить общую жесткость воды до 0,01 мг-экв/л. Концентрации примесей в воде при ее осветлении и умягчении приведены в табл. 7.
Таблица 7. Показатели качества воды по стадиям обработки
|
Стадия обработки |
Жо, мг-экв/л |
Концентрация ионов, мг-экв/л |
Що, мг-экв/л |
рН |
Взв. в-ва, мг/л |
Ок, мгО/л | ||
|
Na+ |
SO42- |
Cl- |
| |||||
|
1. Исходная вода 2. Осветленная 3. После МФ 4. Na-катиони- рованная |
4,3 2,4 2,4 0,1 |
0,122 0,122 0,122 2,122 |
0,281 0,881 0,881 0.881 |
0,718 0,718 0,718 0,718 |
3,3 0,8 0,8 0,8 |
7 10 10 10 |
10 2 <1 <1 |
8.3 4,98 4,98 4,98 |

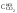
 +Dк
+Dк

 –Dк
–Dк –Dк
–Dк




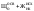 +Dк
+Dк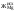
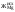
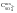
 + Dк
+ Dк + Dк
+ Dк + Dк
+ Dк