
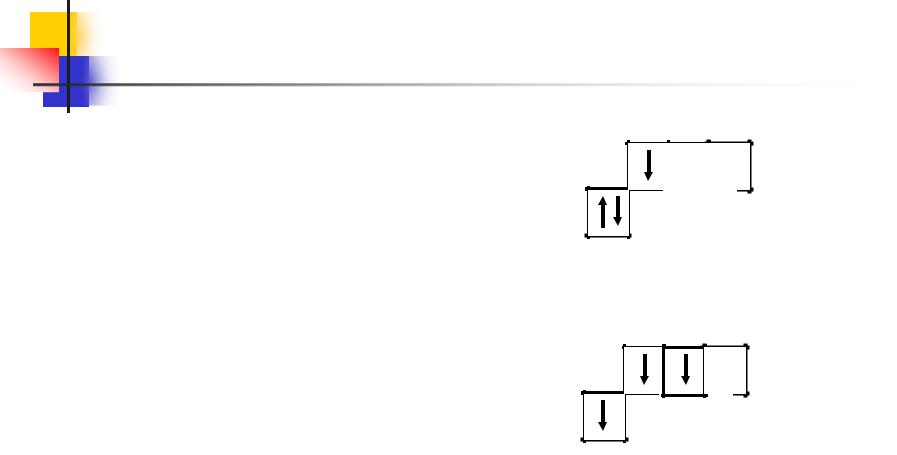
Алюминий
Запишем электронно-графическую формулу атома алюминия в нормальном состоянии:
13Al 1s2 2s2 2 p6 3s2 3 p1
Возбужденное состояние:
13 Al* 1s2 2s2 2 p6 3s1 3 p2
В' =1 |
3р |
3s |
В' =3 |
3р |
3s |
Степень окисления алюминия +3 :

Нахождение в природе
Среди металлов по распространенности в природе алюминию принадлежит первое место.
Содержание алюминия в земной коре составляет 8,8% по массе.
Важнейшие природные соединения алюминия:
алюмосиликаты,
бокситы,
корунд,
криолит.

Нахождение в природе
Алюмосиликаты составляют основную массу земной коры.
Их можно рассматривать как соли, образованные оксидами алюминия, кремния, щелочных и щелочноземельных металлов.
Алюмосиликат состава Nа2О·А12О3·2SiО2 и
К20·А1203·2 Si02 — нефелин.
Нефелин – важнейшая алюминиевая руда.
Крупные залежи нефелина находятся на Кольском полуострове и в Красноярском крае.

Нахождение в природе
При выветривании многих алюмосиликатов образуется глина: А12О3·2SiО2·2Н20.
Бокситы — горная порода, состоящая из гидратированного оксида алюминия и оксидов
железа, которые придают им красный цвет. Содержат от 30 до 60% А1203.
Именно из бокситов получают алюминий.
Месторождения боксита имеются на Урале,
в Ленинградской области, в Башкирии, Казахстане, Сибири и т.д.

Нахождение в природе
Корунд — минерал состава А1203, обладает большой твердостью,
применяется как абразивный материал.
Криолит — минерал состава А1F3·ЗNaF
или Na3AlF6.
Применяется в металлургии алюминия.
В настоящее время приготавливается криолит искусственным путем.

Получение
В промышленности алюминий получают электролизом оксида алюминия.
Чистый А1203, свободный от воды, оксидов железа, и диоксида кремния,
получают из боксита или нефелина и растворяют в расплавленном
криолите Na3AlF6 с добавкой фторида кальция СаF2.

Получение
расплав Al2O3 Al3+ + AlO33−.
Процессы на электродах:
2(−)К : Al3+ +3е = Al, в−ие.
1(+) А: 2 AlО33− −6е = 32 О2 ↑ +Al2О3 , о−ие. 2 Al3+ +2 AlО33− = 2 Al + 32 О2 ↑ +Al2О3.
Катодом являются угольные блоки в основании электролизера.

Получение
Кислород, выделяющийся на угольном аноде, окисляет его до СО и СО2.
С +О2 →СО ↑,
2→СО2 ↑.
Материал анода быстро расходуется и его заменяют.
Условия электролиза: Т≈1000° С,
сила тока 60 000 А, напряжение 4 – 6 В.
Получение алюминия требует большого
расхода электроэнергии.

Физические свойства
Алюминий — серебристо-белый
металл, легкий, но механически прочный.
Поверхность алюминия покрыта оксидной пленкой, предохраняющей металл от дальнейшего окисления.
Пленка прочная, твердая и гибкая, не отстает при растягивании, сжатии,
закручивании и изгибе, придает поверхности матовый вид.

Физические свойства
Алюминий обладает хорошей
электропроводностью и теплопроводностью, но уступает меди.
Легко поддается обработке: прокатывается в фольгу, вытягивается в тонкую проволоку, отливается.
Легко образует сплавы.
При 600°С алюминий становится хрупким и его можно истолочь в зерна или в порошок
(алюминиевая пудра).

Физические свойства
Природный алюминий состоит из одного изотопа 2713 Al.
Для алюминия:
температура плавления –Тпл = 6600 С;
плотность – ρ = 2,7 г/ см3 ;
стандартный электродный
ϕ0Al3+ = −1.66 B.
Al

Химические свойства
1. Отношение к кислороду.
Если очистить оксидную пленку, то алюминий окисляется кислородом воздуха: Al +О2 → Al2O3.
2. Отношение к воде.
Алюминий вытесняет водород из воды:
Al + Н2О t → Al2O3 + H2 ↑.

Химические свойства
3.При нагревании алюминий реагирует с галогенами, а при высокой температуре
– с серой, азотом, углем и образует
хлориды, сульфиды, нитриды и
карбиды:
Al +Cl2 → AlCl3 ,
Al +S t →Al2 S3 ,
Al + N2 → AlN,
Al +С → Al4С3.

Химические свойства
4. Отношение к щелочам.
При сплавлении:
Al + KOH + H2O t →KAlO2 + H2 ↑.
В растворе:
Al + KOH + H2O t →K[ Al(OH )4 ] + H2 ↑. 2 Al −3e +4OH − =[ Al(OH )4 ]−, о−ие,
32H2O +2е = Н2 ↑ +2OH − в−ие.
Валюминиевой посуде или таре нельзя
хранить щелочные растворы.

Химические свойства
5. Отношение к кислотам.
При обыкновенной температуре алюминий практически не
взаимодействует с концентрированной
и сильно разбавленной азотной
кислотой в результате образования защитной оксидной пленки.
Поэтому HNO3 хранят и перевозят в алюминиевой таре.

Химические свойства
Однако он растворяется в соляной и серной кислотах:
Al + HСl → AlCl3 + H2 ↑,
Al + H2 SO4 разб. → Al2 (SO4 )3 + H2 ↑.
Концентрированная серная кислота при
комнатной температуре пассивирует алюминий, но при нагревании:
+6
Аl + H2 SO4 конц. t → S 0 + H2O + Al2 (SO4 )3.
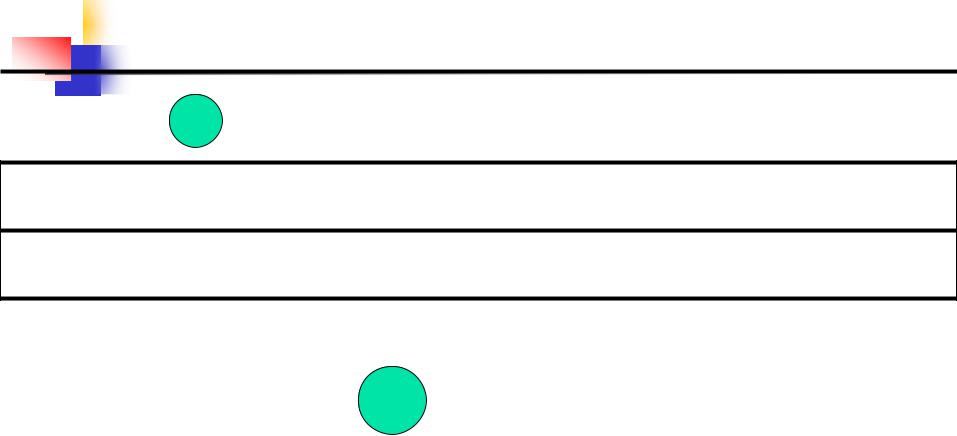
Таблица. Взаимодействие  металлов с кислотами
металлов с кислотами
Ca Na Mg Al Mn Cr Zn Fe Co Ni Sn Pb H Sb Bi Cu Hg Ag Au
НNO3 конц
NO2
Н2SO4 конц
|
Н2S |
S |
SO2 |
НNO3 разб
NH4+ |
N2 |
N O |
NO |
|
|
2 |
|

Применение
1. Алюминий ̶крылатый металл:
самолет на 2/3 состоит из алюминия и
его сплавов, а авиационный мотор ̶
на 1/4 из сплавов алюминия.
2. Алюминий идет на изготовление кабелей и проводов.
3. Из него изготовляют детали аппаратов и тару для азотной кислоты,
корпуса автобусов, троллейбусов и вагонов.

Применение
4. В пищевой промышленности:
делают алюминиевую фольгу;
алюминиевую посуду.
5. Порошок алюминия применяется в качестве серебристой краски.
6. Алюминий применяют в металлургии
–восстановление металлов из их оксидов методом алюминотермии
(Сr, Mn, Ti, Zr, V и др.).

Применение
7. Алюминотермию применяют также для сварки рельсов и деталей стального литья.
Для этого используют термит – смесь эквивалентных количеств порошка алюминия и железной окалины Fe3O4.
Fe O + Al → Al O + Fe, ∆H = −3300 кДж. |
|||||
3 |
4 |
+3 |
2 |
3 |
|
3 |
|
2 Fe+6e = 2Fe0 |
восстановление |
||
|
|||||
|
Fe+2e = Fe0 |
||||
|
|
+2 |
|
|
|
|
|
|
|
+3 |
|
|
|
|
|
|
|
4 |
|
2 Al −6e = |
2 Al, окисление. |
||
|
|||||

Применение
Реакция протекает очень быстро, выделяется большое количество теплоты, а температура смеси достигает 3500°С.
Выделяющейся теплоты достаточно для полного расплавления железа.
8. Алюминием насыщают поверхности стальных или чугунных изделий с целью
защиты изделия от окисления при сильном нагревании.
Этот процесс называют алитированием.

Соединения алюминия
Оксид алюминия.
Cr2O3 (старое название глинозем) – вещество белого цвета, тугоплавкое, обладает высокой
твердостью.
В природе встречается в виде корунда и различных его разновидностей.
Если бесцветные кристаллы корунда окрашены примесями в синий цвет, то они называются
сапфирами, в фиолетовый – аметистами, в красный — рубинами.

Cоединения алюминия
Кристаллы рубина с примесями Cr2O3
используются в квантовых генераторах.
Из рубина делают детали точных приборов
– камни в часах, рубиновые звезды.
Корунд – абразивный материал.
Получение Al2O3: Аl +O2 t →Al2O3.
Al(OН)3 t →Al2O3 + H2O.
Al2O3– амфотерный оксид.
Al2O3 + HCl → AlCl3 + H2O.
Al2O3 + NaOH сплавление→NaAlO2 + H2O. Al2O3 + NaOH в растворе→Na[ Al(OH )4 ].

Cоединения алюминия
Al(OН)3 – белое твердое вещество, нерастворимое в воде.
Al(OН)3 получают:
+ NaOH → Al(OH )3 ↓ +NaCl.
Al(OН)3 – типичный амфотерный гидроксид.
Al(OН)3 + H2 SO4 → Al2 (SO4 )3 + H2O.
Al(OН)3 + NaOH в растворе→Na[ Al(OH )4 ]. Al(OН)3 + NaOH сплавление→NaAlO2 + Н2О.

Cоединения алюминия
Наибольшее применение находят соли
алюминия:
AlСl3 – как катализатор в органическом синтезе;
Al2(SO4)3 ·18 H2O – для очистки воды и в приготовлении некоторых сортов бумаги;
КAl(SO4)2 ·12 H2O – алюмокалиевые квасцы применяют для дубления кож, в красильном
деле для протравливания х/б тканей
(основано на гидролизе соли, см. тему
«Хром»).

|
|
|
|
Водород. |
|
|
|
|
Место в периодической системе |
||
|
|
|
|||
|
|
|
|||
|
|
|
|
Водород занимает первое место в периодической |
|
|
|
|
|||
|
|
||||
|
|
||||
|
|
системе (Z= 1). |
Н 1s1 |
||
|
Он имеет простейшее строение атома: 1 |
||||
|
В одних условиях водород проявляет |
1s |
|||
|
|||||
металлические свойства (отдает электрон).
В других — неметаллические (принимает электрон).
Однако по свойствам он имеет больше сходства с галогенами, чем со щелочными металлами.
Поэтому водород помещают в VII группу
периодической системы элементов Д. И.
Менделеева, а в I группе символ водорода заключают в скобки.

Водород. Нахождение в природе
Водород широко распространен в природе:
содержится в воде,
во всех органических соединениях,
в свободном виде – в некоторых природных газах.
Содержание его в земной коре достигает 0,15% ее массы (с учетом гидросферы 1%).
Водород составляет половину массы Солнца.
В природе водород встречается в виде двух изотопов
–протия (99,98%) и дейтерия (0,02%).
Поэтому в обычной воде содержатся небольшие
количества тяжелой воды.

Водород. Получение
В лабораторных условиях водород получают:
1. взаимодействием металла (цинка) с
растворами соляной или серной кислот (реакция
проводится в аппарате Киппа):
Zn +2H+ = Zn2+ +H2 ↑.
2. Электролизом воды:
|
K(−) : 2H2O +2e = H2 ↑ +2OH −,в−ие |
|
2 |
|||||||||||||||
|
|
|||||||||||||||||
|
A (+) : |
|
− |
|
= |
|
|
↑ + |
|
+ |
|
− |
|
|
|
|
||
|
|
2H2O |
|
4e |
|
|
O2 |
|
4H |
|
,о |
|
ие 1 |
|
||||
4H |
O +2H |
O = 2H |
2 |
↑ +4OH |
− +O ↑ +4 H +. |
|||||||||||||
2 |
2 |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|||
На катоде выделяется 2 объема водорода, на
аноде – 1 объем кислорода.

Водород. Получение
В промышленности водород получают несколькими способами.
1. Электролизом водных растворов КС1 или NаС1 как побочный продукт:
Процессы на электродах:
|
р−рNaCl(Na+,Cl−,Н О). |
|
|
|
|
2 |
|
|
|
K(−): Na+,H2O: 2H2O+2e →H2 |
↑+2OH−,в−ие |
1 |
||
A(+): Cl−,H2O: 2Cl− −2e =Cl20 ↑, о−ие |
|
1 |
||
2H O+2Cl− =H ↑+2OH− +Cl0 ↑. |
|
|
||
2 |
2 |
2 |
|
|
2K2SO4 р−р +6H2O эл−з→4KOH+2H2 ↑+O2 ↑+2H2SO4.

Водород. Получение
2. Конверсионным способом (конверсия превращение).
Сначала получают водяной газ, пропуская пары воды через раскаленный кокс при 1000oС
C +H2O = CO ↑ +H2 ↑.
Затем оксид углерода (II) окисляют в оксид углерода
(IV), пропуская смесь водяного газа с избытком паров
воды над нагретым до 400 – 450° С катализатором
Fе203: CО+(H2 ) +Н2О = CO2 +H2 +(Н2 ).
Образующий оксид углерода (IV) поглощается
водой.
Этим способом получают cвыше 50% промышленного
водорода.

Водород. Получение
3. Конверсией метана с вoдяным паром
CН4 +2H2O = CO2 +4H2.
Реакция протекает при 1300°С в присутствии никелевого катализатора.
Этот метод позволяет использовать природные газы и
получать самый дешевый водород.
4. Нагреванием метана до 350°С в присутствии железного или никелевого катализатора:
5. Глубоким охлаждением (до –196° С) коксового газа.
При таком охлаждении все газообразные вещества, кроме водорода, конденсируются.

Водород. Физические свойства
Водород – газ без цвета, вкуса и запаха, в 14,4 раза легче воздуха – это самый легкий газ.
Мало растворим в воде (в 1 л воды при 20°С
растворяется 18 мл водорода).
При –252,8° С и атмосферном давлении переходит
в жидкое состояние.
Жидкий водород бесцветен.
Кроме водорода с массовым числом 1 существуют изотопы с массовыми числами 2 и 3 – дейтерий D и тритий Т.
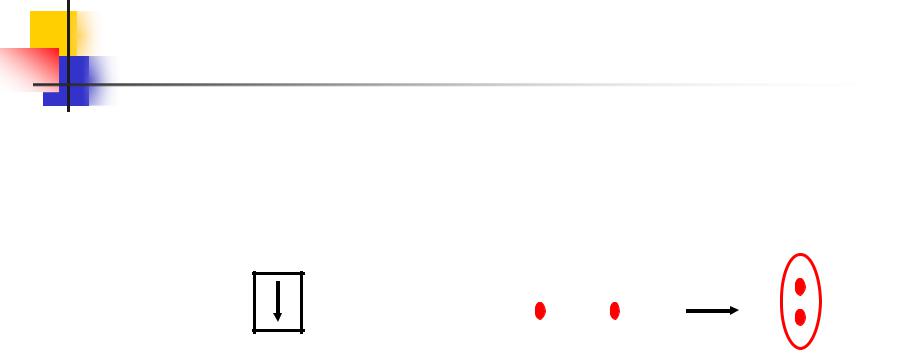
Водород. Химические свойства
В соединениях водород всегда
одновалентен.
Для него характерна степень окисления +1, но в гидридах металлов она равна –1.
Молекула водорода состоит из двух атомов:
1 Н 1s1 |
В’=1 |
Н |
+ |
Н |
НН |
|
1s |
|
|
|
|
Энергия связи составляет 436 кДж/моль, что объясняет сравнительно небольшую активность молекулярного водорода при комнатной температуре.

Водород. Химические свойства
Со многими неметаллами водород образует газообразные соединения типа RН4, RН3, RН2, RН.
Водород горит в кислороде с выделением большого количества теплоты.
Температура водородно-кислородного пламени достигает 3000° С.
Смесь двух объемов водорода и одного объема
кислорода называется гремучим газом.
При поджигании такая смесь дает сильный взрыв.
При горении водорода в кислороде, и при взрыве гремучей смеси образуется вода:
2Н2 +О2 2Н2О.
В этой реакции водород окисляется кислородом:
водород – восстановитель, кислород – окислитель.

Водород. Химические свойства
При работе с водородом необходимо соблюдать большую осторожность: предварительно проверять
герметичность аппаратуры, а также чистоту водорода перед его поджиганием.
Водород при высокой температуре соединяется со щелочными и щелочноземельными металлами, образуя белые кристаллические вещества – гидриды
металлов: (LiH, NаН, КН, СаН2 и др.).
В этих соединениях металл имеет положительную степень окисления, водород – отрицательную.
Если гидрид металла расплавить и подвергнуть электролизу, то водород будет выделяться на аноде, металл на катоде.
Отрицательно заряженный ион водорода имеет завершенный энергетический уровень, как у атома гелия.

Водород. Химические свойства
Гидриды металлов легко разлагаются водой с
образованием соответствующего гидроксида металла и
водорода: CaH2 +2H2O = Ca(OH)2 +2H2 ↑.
Повышенной реакционной способностью обладает
атомарный водород.
Атомарный водород при комнатной температуре восстанавливает оксиды металлов, взаимодействует с кислородом, серой и фосфором.
Горелка, работающая на атомарном водороде, создает температуру выше 4000° С.
Высокая температура обусловлена протеканием
экзотермической реакции:
H +H = 2H2 ↑, ∆r H = −436 кДж.

Водород. Химические свойства
При нагревании водород восстанавливает многие металлы из их оксидов:
CuO+2 +H2 = Cu +H2O.
Сu+2e = Cu, восстановление,
H2 −2е = 2H+, окисление.
В этой реакции водород отдает один электрон (молекула водорода – два электрона), он —
восстановитель.
Однако атом водорода может принимать один электрон (молекула — два электрона):
H +е = H−, восстановление.
Это происходит, например, при образовании гидридов металлов. В этом случае водород – окислитель.

Водород. Применение
Применение водорода основано на его физических и химических свойствах.
Как легкий газ он используется для наполнения аэростатов и дирижаблей (в смеси с гелием).
Применяют водород для получения высоких температур: кислородно-водородным пламенем
режут и сваривают металлы.
Он используется для получения металлов (молибдена,
вольфрама и др.) из их оксидов.
В химической промышленности:
для получения аммиака из азота воздуха;
искусственного жидкого топлива из угля.
В пищевой промышленности – для гидрогенизации
жиров.
Изотопы водорода – дейтерий и тритий –
применяются в атомной энергетике (термоядерное
горючее).

Пероксид водорода
Пероксид (перекись) водорода представляет собой бесцветную сиропообразную жидкость плотностью 1,45 г/см3, затвердевающую при – 0,48°С.
Это очень непрочное вещество, способное разлагаться со взрывом на воду и кислород, причем выделяется большое количество теплоты:
2Н2О2(ж) = 2Н2О(ж) +О2 , ∆r Н =197,5кДж.
Водные растворы пероксида водорода более устойчивы.
В прохладном месте они могут сохраняться довольно долго.
Пергидроль – раствор, который поступает в продажу, и содержит 30% Н2О2.
В нем, а также в высококонцентрированных растворах пероксида водорода содержатся стабилизирующие добавки.

Пероксид водорода
В промышленности пероксид водорода получают в
основном электрохимическими методами, например,
анодным окислением растворов серной кислоты или гидросульфата аммония с последующим гидролизом образующейся при этом пероксодвусерной кислоты
H2S208: |
2H2SO4 |
−2e = H2S2O8 +2H |
+ |
, |
|
|
H2S2O8 +2H2O = 2H2SO4 +H2O.
Пероксид водорода – очень слабая двухосновная
кислота распадается в незначительной степени на
ионы: |
Н2О2 Н+ +НО2−,1 ступень, |
2Н+ +О22−, 2 ступень.
Диссоциация по второй ступени практически не
протекает.

Пероксид водорода
Однако при связывании ионов водорода (например,
при введении в раствор щелочи) диссоциация по
второй ступени происходит.
С некоторыми основаниями пероксид водорода
реагирует непосредственно, образуя соли.
Так, при действии пероксида водорода на водный
раствор гидроксида бария выпадает осадок бариевой соли пероксида водорода:
Н2О2 +Ва(ОН)2 = ВаО2 ↓ +2Н2О.
Соли пероксида водорода называются пероксидами
или перекисями.
Они состоят из положительно заряженных ионов металла и отрицательно заряженных ионов О2–.

Пероксид водорода
Степень окисленности кислорода в пероксиде водорода равна –1, т. е. имеет промежуточное значение между степенью окисленности кислорода в воде –2 и в молекулярном кислороде
(0).
Поэтому пероксид водорода обладает свойствами как окислителя, так и восстановителя, проявляет окислительновосстановительную двойственность.
Все же для него более характерны окислительные свойства, так как стандартный потенциал электрохимической системы
Н2О2 +2Н+ +2е = 2Н2О,
в которой Н202 выступает как окислитель, равен 1,776 В, в то время как стандартный потенциал электрохимической
системы |
Н2 |
О2 |
−2е = О2 |
+2Н+, |
|
в которой пероксид водорода является восстановителем, равен
0,682 В.

Пероксид водорода
Примеры реакций, в которых Н202 окислитель:
KNO2 +H2O2 = KNO3 +H2O, 2KI +H2O2 = I2 +2KOH.
Реакции, в которых Н202 восстановитель:
2KMnO4 +5H2O2 +3H2SO4 = 2MnSO4 +5O2 +K2SO4 +8H2O.
Ag2O +H2O2 = 2Ag +O2 +H2O.

Пероксид водорода. Применение
Применение пероксида водорода связано с его
окислительной способностью и с безвредностью
продукта его восстановления (Н2О). Его используют:
для отбеливания тканей и мехов,
применяют в медицине (3% раствор – дезинфицирующее средство),
в пищевой промышленности (при консервировании пищевых продуктов),
в сельском хозяйстве для протравливания семян,
в производстве ряда органических соединений, полимеров, пористых материалов.

Пероксид водорода. Применение
как сильный окислитель используется в ракетной технике,
для обновления старых картин, написанных
масляными красками и потемневших от времени
вследствие превращения свинцовых белил в
черный сульфид свинца под действием содержащихся в воздухе следов сероводорода.
При промывании таких картин пероксидом
водорода сульфид свинца окисляется в белый сульфат свинца:
PbS +4H2O2 = PbSO4 +4H2O.

Вода
Вода – оксид водорода – одно из наиболее
распространенных и важных веществ.
Поверхность Земли, занятая водой, в 2,5 раза
больше поверхности суши.
Чистая вода в природе отсутствует, она всегда
содержит примеси.
Получают чистую воду методом перегонки.
Перегнанная вода называется дистилированной.
Состав воды (по массе): 11,19% водорода и
88,81 % кислорода.

Вода. Физические свойства
Чистая вода прозрачна, не имеет запаха и вкуса.
Наибольшую плотность она имеет при 4°С (1 г/см3).
Плотность льда меньше плотности жидкой воды,
поэтому лед всплывает на поверхность.
Вода замерзает при 0° С и кипит при 100°С при давлении 101 325 Па.
Она плохо проводит теплоту.
Чистая вода очень плохо проводит электричество.
Вода – хороший растворитель.
Молекула воды имеет угловую форму.
Атомы образуют угол, равный 104,5°.

Вода. Физические свойства
Молекула воды – диполь: та часть ее, где находится водород, заряжена положительно, а часть, где находится кислород, отрицательно.
Благодаря полярности молекул воды электролиты в
ней диссоциируют на ионы.
В жидкой воде наряду с обычными молекулами Н2О содержатся ассоциированные, т. е. соединенные в
более сложные агрегаты – (Н2О)х.
Причина ассоциации – образование водородных связей.

Вода. Физические свойства
Наличием водородных связей между молекулами
воды объясняются аномалии ее физических свойств:
максимальная плотность при 4° С,
высокая температура кипения в ряду
Н2О – Н2S – Н2Sе – Н2Те,
аномально большая теплоемкость (4,18 Дж/(г·К)).
С повышением температуры водородные связи
разрываются, и полный разрыв их наступает при
переходе воды в пар.

Вода. Xимические свойства
Вода – реакционноспособное вещество.
При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со
щелочными и щелочноземельными металлами:
H2O +K2O = 2KOH; |
2H2O +2Rb = 2RbOH +H2 ↑; |
H2O +SO3 = H2SO4 ; |
2H2O +Ca = Ca(OH)2 +H2 ↑. |
Вода образует многочисленные соединения – гидраты (кристаллогидраты):
H2O +Н2SO4 = H2SO Н2О;
H2O + NaOH = NaOH H2O;

Вода. Xимические свойства
10H2O + Na2CO3 = Na2CO3 10Н2О;
5H2O +CuSO4 = CuSO4 5H2O.
Очевидно, соединения, связывающие воду,
могут служить в качестве осушителей.
Из других осушающих веществ следует указать
Р2О5, СаО, ВаО, металлический Nа (они тоже
химически взаимодействуют с водой) , а также силикагель.
К важным химическим свойствам воды относится
ее способность вступать в реакции гидролитического разложения.

Тяжелая вода
Вода, содержащая тяжелый водород, называется тяжелой водой (обозначается формулой D2O).
По физическим свойствам она отличается от
обычной воды.
Все химические реакции с тяжелой водой протекают немного медленнее, чем с обычной водой.
Поэтому она накапливается в электролизере при длительном электролизе обычной воды.
Тяжелая вода применяется в качестве замедлителя нейтронов в ядерных реакторах.

Общая характеристика галогенов
В подгруппу галогенов входят фтор, хлор, бром, иод и астат (астат – радиоактивный элемент, мало изучен).
Атомы галогенов имеют на внешнем энергетическом уровне по 7 электронов в состоянии …s2р5.
Этим объясняется общность их свойств.
Стремясь завершить внешний уровень, они присоединяют по одному электрону, проявляя степень окисления, равную –1. Такую степень окисления галогены имеют в соединениях с водородом и металлами.
Однако атомы галогенов, кроме фтора, могут проявлять и положительную степень окисления: +1, +3, +5, +7.
Такое значение степеней окисления объясняется электронным строением внешних энергетических уровней атомов галогенов.
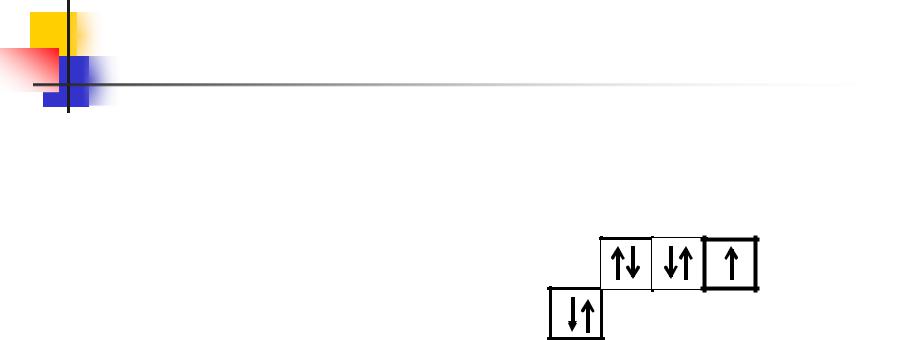
Общая характеристика галогенов
Будучи наиболее электроотрицательным элементом, фтор может только принимать один электрон на 2р-подуровень.
9 F |
1s |
2 |
2s |
2 |
2 p |
5 |
В’=1 |
|
|
|
2p |
||||
|
|
|
|
|
|
|
2s |
У него один неспаренный электрон, поэтому фтор бывает только одновалентным, а его степень окисления всегда –1.
Необходимо учитывать особенности фтора и его соединений.
Общая характеристика галогенов
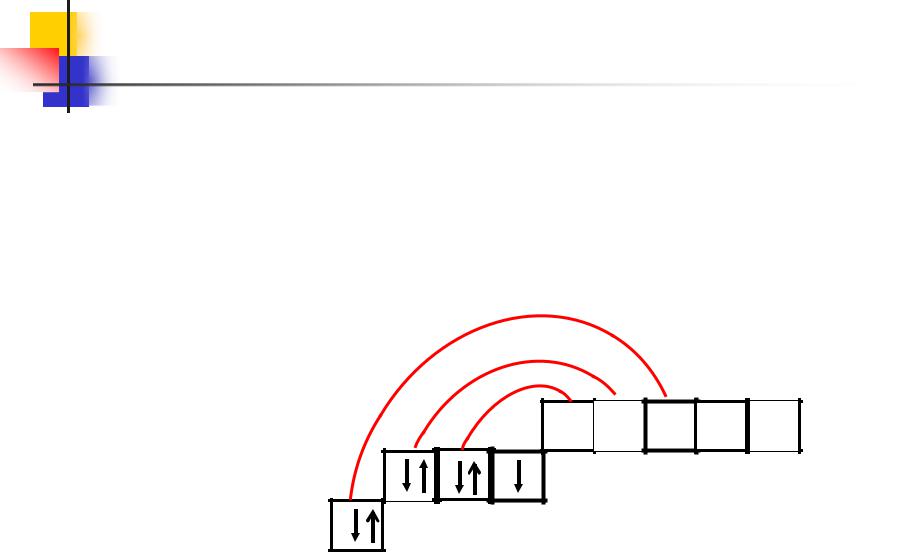
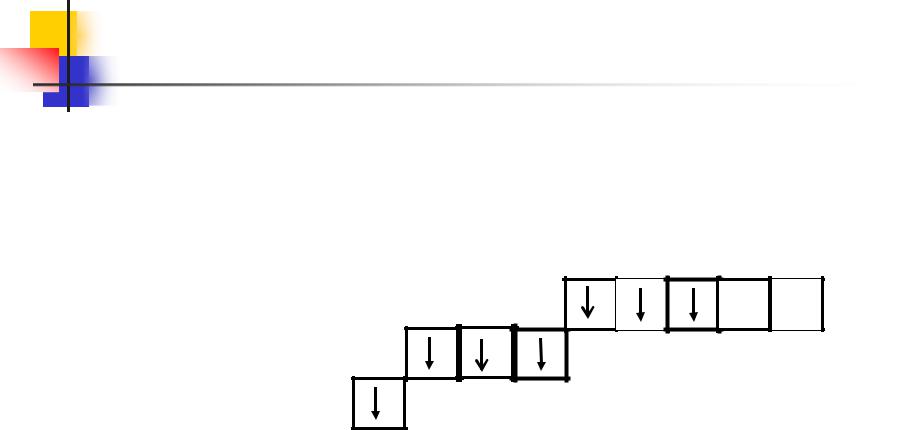
У атома хлора один неспаренный электрон на Зр-подуровне и он в обычном (невозбужденном) состоянии одновалентен.
Но поскольку хлор находится в III периоде, то у него имеется еще пять орбиталей (ячеек) Зd-подуровня:
17 Cl 1s2 2s2 2 p6 3s2 3p5
3p |
3s |
В’=1
3d
Общая характеристика галогенов
У атома хлора в возбужденном состоянии электроны с Зр- и 3s- подуровней переходят на Зd-подуровень (на схеме показано стрелками).
Разъединение электронов, находящихся в одной ячейке, увеличивает валентность на две единицы.
***Cl 1s2 2s2 2 p6 3s13p3 3d 3
17
3p |
3s |
В’=7 |
3d |
Хлор и его аналоги, кроме фтора, могут проявлять лишь
нечетную переменную валентность 1, 3, 5, 7 и
соответствующие положительные степени окисления.

Общая характеристика галогенов
Водные растворы водородных соединений галогенов являются кислотами: НF – фтороводородная (плавиковая), НСl – соляная, НВг – бромоводородная, НI– иодоводородная.
Следует иметь в виду, что галогены помимо общих свойств имеют и различия.
Это особенно характерно для фтора и его соединений.
Так, плавиковая кислота НF – слабая кислота; НСl, НВг, HI –
сильные кислоты.
Причем сила их возрастает с ростом заряда ядра атома.
Растворимость малорастворимых солей уменьшается в ряду
АgСl, АgВг, АgI.
В отличие от них АgF хорошо растворим в воде.
Фтор проявляет степень окисления только –1 (он прочнее всех удерживает электроны).

Общая характеристика галогенов
Фтор иначе взаимодействует с водой, чем хлор.
Он разлагает воду с образованием фтороводорода, фторида кислорода (II), пероксида водорода, кислорода и озона:
F2 +H2O = 2HF +O, |
|
O2 +F2 = OF2 , |
H2O +O = H2O2 , |
2О = О2 , |
3О = О3. |
Уравнение реакции взаимодействия хлора с водой приведено далее.
Реакционная способность галогенов падает в ряду
F2, Сl2, Вг2, I2.
Поэтому предыдущий галоген вытесняет последующий из его
соединений с водородом и металлами. В этом случае активность
F2 > Сl2 > Вг2 > I2.
Закономерно изменяются физические свойства галогенов с ростом порядкового номера:
фтор – трудно сжижающийся газ,
хлор – легко сжижающийся газ,
бром – жидкость,
йод – твердое вещество.

Хлор. Нахождение в природе
В свободном состоянии хлор встречается только в вулканических газах.
В природе широко распространены его соединения. Важнейшие из них:
хлорид натрия NаСl,
хлорид калия КСl,
хлорид магния МgСl2·6Н2O,
сильвинит КСl·NaCl,
карналлит КСl· MgСl2 ·6Н2O,
каинит МgSO4·КС1·ЗН2O и др.
Соединения хлора содержатся в водах океанов, морей и озер.
В небольших количествах они имеются в растительных и животных организмах.
Хлор составляет 0,05% массы земной коры.

Хлор. Получение
В лабораторных условиях хлор получают из соляной кислоты при взаимодействии ее с оксидом марганца (IV).
Реакция протекает при нагревании:
4HCl +MnO2 = Cl2 +MnCl2 +2H2O.
1 MnO2 +2е+4Н+ = Mn2+ +2H2O, восстановление,
12Cl− −2е = Cl2 , окисление.
Это окислительно-восстановительная реакция.
Хлорид-ион – восстановитель, МnO2 – окислитель.
Вместо окислителя МnO2 можно применить перманганат калия
КМnO4.
Тогда реакция протекает при обычной температуре, без нагревания:
16HCl +2КMnO4 = Cl2 +MnCl2 +2КСl +8H2O.
2 |
|
MnO4− +5е+4Н+ = Mn2+ +4H2O, восстановление, |
|
||
5 |
|
2Cl− −2е = Cl2 , окисление. |
|

Хлор. Получение
В промышленности хлор получают электролизом концентрированного раствора хлорида натрия.
р− р NaCl (Na+,Cl−, Н2О).
Процессы на электродах:
K (−) :Na+ , H2O : 2H2O +2e → H2 ↑ +2OH −, в−ие 1 |
|
A(+) :Cl −, H2O : 2Cl− −2e = Cl20 ↑, о−ие |
1 |
2H2O +2Cl− = H2 ↑ +2OH − +Cl20 ↑.

Хлор. Получение
Хлор выделяется на аноде.
На катоде выделяется водород.
В катодном пространстве в растворе остается гидроксид натрия:
К: Na+ +OH− = NaOH.
Молекулярное уравнение электролиза:
2NaClр−р +2H2O эл−з→2NaOH +H2 ↑ +Cl2 ↑.

Хлор. Физические свойства
Хлор – ядовитый газ желто-зеленого цвета с резким запахом.
Тяжелее воздуха в 2,5 раза.
При 20° С в 1 объеме воды растворяется 2,3 объема хлора. Раствор хлора в воде называется хлорной водой.
Хлор хорошо растворяется в органических растворителях.
Вдыхание хлора вызывает раздражение дыхательных путей, а вдыхание больших количеств приводит к смерти.
В природном хлоре содержатся два изотопа:
1735 Cl (75,4%) и 3717 Сl (24,6%).

Хлор. Химические свойства
Для завершения внешнего энергетического уровня
атому хлора недостает одного электрона.
Принимая электрон, он проявляет степень окисления, равную –1.
Кроме того, отдавая электроны, он может проявлять степень окисления +1, +3, +5 и +7.
Молекула хлора состоит из двух атомов.
Характер связи ковалентный неполярный:
 Сl
Сl
 +
+
Сl 

 Сl
Сl Сl
Сl

Хлор. Химические свойства
Сильные окислительные свойства хлор проявляет при взаимодействии с металлами.
При этом атомы металла отдают электроны, а молекулы хлора их принимают: Cu +Cl2 = CuCl2.
Cu +2е = Cu2+,окисление,
Cl2 +2е = 2Cl− восстановление.
Хлор взаимодействует также со многими неметаллами:
2Р+3Cl2 = 2РCl3. 2Р+5Cl2 = 2РCl5.
Своеобразно реагирует хлор с водородом.
В темноте смесь хлора с водородом не взаимодействует.
Однако при сильном освещении реакция протекает со взрывом c образованием хлороводорода:
Н2 +Cl2 = 2НCl.

Хлор. Химические свойства
У органических соединений хлор отнимает водород, а углерод остается в свободном виде.
Поэтому такие вещества, как скипидар, парафин горят в нем с
выделением большого количества копоти и хлороводорода.
Хлор замещает водород в предельных углеводородах и присоединяется к непредельным соединениям:
СН4 +Cl2 = СН3Сl +НCl.
С2Н4 +Cl2 = С2Н4Сl2.
Хлор вытесняет бром и иод из их соединений с водородом и
металлами: |
Cl2 |
+2KBr = Br2 |
+2KCl. |
|
Хлор взаимодействует с водой с образованием двух
кислот – соляной (сильная кислота) и хлорноватистой (слабая кислота).

Хлор. Химические свойства
|
Реакция обратима: |
|
|
|
Cl2 +Н2О HCl +HClO. |
|
или в ионной форме: |
|
Cl2 +Н2О H+ +Сl− +HClO. |
Хлорноватистая кислота – очень сильный окислитель. Отбеливающие свойства хлора в присутствии влаги (воды) объясняются образованием хлорноватистой кислоты.
Сухой хлор не отбеливает.
Важно отметить, что хлор непосредственно не взаимодействует с кислородом, азотом и углеродом (их соединения получаются косвенным путем).
В отсутствие влаги хлор не реагирует с железом.
Это дает возможность хранить его в стальных баллонах и
цистернах.

Хлор. Применение
Хлор применяется:
для обеззараживания питьевой воды
(хлорирование воды),
для отбеливания тканей,
для отбеливания бумажной массы,
для получения соляной кислоты,
получения хлорной извести,
различных химических соединений, содержащих хлор.

Хлороводород и соляная кислота
Хлороводород – одно из важнейших соединений хлора.
Это бесцветный газ с резким запахом.
При вдыхании раздражает дыхательные пути и вызывает удушье.
В 1,3 раза тяжелее воздуха.
Во влажном воздухе «дымит», т. е. с водяными парами воздуха образует мельчайшие капельки тумана.
При 0° С в 1 объеме воды растворяется около 500 объемов хлороводорода.
Водный раствор хлороводорода называется хлороводородной или соляной кислотой.
В лабораторных условиях хлороводород получают при
взаимодействии хлорида натрия с концентрированной серной кислотой.

Хлороводород и соляная кислота
При слабом нагревании образуются хлороводород и кислая соль (гидросульфат натрия):
NaCl +H2SO4 = HCl ↑ +NaHSO4.
При сильном нагревании образуются хлороводород и средняя соль (сульфат натрия):
2NaCl +H2SO4 = 2HCl ↑ +Na2SO4.
Хлороводород можно получить горением водорода в хлоре:
Cl2 +H2 = 2HCl.
Эти реакции лежат в основе способов получения соляной кислоты в промышленности.
Первый способ называется сульфатным (основан на реакции взаимодействия между NaCl и концентрированной Н2SO4), второй
– синтетическим (основан на реакции горения водорода в хлоре).
В обоих случаях получающийся хлороводород поглощается водой в специальных поглотительных башнях.

Соляная кислота
Соляная кислота – бесцветная жидкость.
Концентрированная содержит до 37% хлороводорода и во влажном воздухе «дымит».
Будучи сильной кислотой, она обладает всеми свойствами кислот.
Многие металлы, основные оксиды, основания, некоторые соли и газы взаимодействуют с соляной кислотой:
Zn +2HCl = ZnCl2 +H2 ↑, |
CuO +2HCl = CuCl2 +H2O, |
||||
Al(OH) |
3 |
+3HCl = AlCl +3H |
2 |
O, |
AgNO3 +HCl = AgCl ↓ +HNO3 , |
|
3 |
|
|
||
NН3 +HCl = NH4Cl.
Хранят и перевозят соляную кислоту в гуммированных цистернах и бочках, т. е. в сосудах, внутренняя поверхность которых покрыта кислотостойкой резиной, а также в стеклянных бутылях и полиэтиленовых сосудах.

Соляная кислота. применение
Соляная кислота применяется:
для получения ее солей,
для травления металлов,
в пищевой промышленности,
в медицине.
Как реагент используется во всех химических лабораториях.

Соли соляной кислоты
Важнейшие соли соляной кислоты :
NaCl – хлорид натрия:
является необходимой частью пищи,
служит сырьем для получения гидроксида нария, хлора, соляной кислоты, соды и др.,
используется для консервирования пищевых продуктов.
КСl – хлорид калия – ценное калийное удобрение.
ZnCl2– хлорид цинка – им пропитывают древесину для предохранения от гниения, применяется при паянии для
устранения пленки оксида с поверхности металла.
ВаСl2 – хлорид бария – ядовитое вещество, применя-
ется для борьбы с вредителями сельского хозяйства.

Соли соляной кислоты
СаСl2 – хлорид кальция (безводный) широко применяется для осушки газов (при этом образуется
кристаллогидрат соли СаСl2·6Н2O) и в медицине;
АlСl3 — хлорид алюминия используется как катализатор при органических синтезах;
HgCl2 – хлорид ртути (II), или сулема – сильный яд, очень разбавленныю растворы соли применяются
как сильнодействующие дезинфицирующие средства, используется для протравливания семян,
дубления кожи, в органическом синтезе;
АgСl – хлорид серебра, малорастворимая соль, используется в фотографии.

Качественная реакция на хлорид-ион
Большинство солей соляной кислоты хорошо растворимы в воде.
Практически нерастворимы хлориды серебра АgСl, ртути (I)
Нg2Сl2 и меди (I) СиСl.
Малорастворим хлорид свинца (II) РbСl2, но он хорошо растворим в горячей воде.
Эти свойства хлоридов используют в качественном анализе.
Нитрат серебра АgNО3 является реагентом на соляную кислоту и ее соли, точнее ион серебра – реагент на хлорид-ион.
Это означает, что если к соляной кислоте или раствору соли, содержащему хлорид-ион, добавить раствор соли, содержащий ион серебра, то выпадает белый творожистый осадок хлорида серебра АgСl, нерастворимый в азотной кислоте.
По этому признаку определяют присутствие в растворе
хлорид-ионов.

Кислородные соединения хлора
Хлор с кислородом непосредственно не взаимодействует.
Его соединения с кислородом получают косвенным путем.
Важнейшие из них:
оксид хлора (I) Сl2O — газ буро-желтого цвета, легко распадающийся со взрывом: 2Сl2О = 2C2 +O2.
оксид хлора (VII) Сl2O7 — маслянистая жидкость, легко взрывающаяся при сильном нагревании и при ударе.
Наибольшее значение имеют соли кислородных кислот хлора. Ключом к
пониманию кислородных соединений хлора служит реакция взаимодействия хлора с водой.
Равновесие реакции
Сl2 +Н2O НCl +HClO |
(а) |
легко сместить вправо, добавив щелочь.
В этом случае щелочь будет реагировать с двумя образовавшимися кислотами:
НCl +HClO +2KOH = KCl +KClO +2H2O.

Кислородные соединения хлора
Суммируем обе эти реакции :
Сl2 +Н2O НCl +HClO
НCl +HClO +2KOH = KCl +KClO +2H2O
|
Cl2 +2KOH = KCl +KClO +H2O |
(б) |
|
или в ионной форме: |
− = Cl− +ClO− +H2O. |
|
|
|
Cl2 +2OH |
|
|
Соли хлорноватистой кислоты называют гипохлоритами.
В результате взаимодействия хлора с раствором щелочи при комнатной температуре получается водный раствор, содержащий гипохлорит калия и хлорид калия, называемый жавелевой водой.
Жавелевая вода, как и хлорная вода, употребляется для отбеливания хлопчатобумажных тканей и бумаги.
При этом угольная кислота, образующаяся из воды и оксида углерода (IV) воздуха, вытесняет из гипохлорита калия хлорноватистую кислоту:
КСlO +H2O +CO2 = KHCO3 +HClO.

Кислородные соединения хлора
Гипохлориты — очень сильные окислители.
Механизм окисляющего и дезинфицирующего действия
хлорноватистой кислоты и ее солей объясняют наличием хлора со степенью окисления +1, проявляющим себя в этих процессах
активным окислителем: |
|
+1 |
+1 |
и |
|
Cl+e = Cl |
Сl+2e = Cl−. |
При пропускании хлора через раствор щелочи, нагретый до 100° С, процесс (б) протекает с образованием хлоратов (солей хлорноватой кислоты НСlO3):
3Сl2 +6КОН =3КCl +3КClO +3Н2О
3КClO = 2KCl +KClO3
3Cl2 +6KOH =5KCl +KClO3 +3H2O (в)
Или в ионной форме:
3Cl2 +6OH− =5Cl− +ClO3− +3H2O.

Кислородные соединения хлора
При нагревании до 400° С в отсутствии катализатора из хлоратов образуются перхлораты (соли хлорной кислоты
НСlO4): 4КClO3 = KCl +3KClO4.
|
В присутствии катализатора (МnO2) процесс протекает по |
|
|
уравнению: |
2КClO3 = 2KCl +3O2. |
Таким образом, соли кислородных кислот хлора получают взаимодействием хлора со щелочью.
Известны также соли хлористой кислоты НСlO2.
Сила кислородных кислот хлора возрастает с ростом
степени окисления центрального атома:
HClO4 → HClO3 → HClO2 → HClO.
Cила кислот возрастает с ростом степени окисления хлора
НСlO4 – самая сильная из всех известных кислот.
В той же последовательности прочность связи водорода уменьшается.

Кислородные соединения хлора
Если хлор взаимодействует с гидроксидом кальция Са(ОН)2, который берется в виде порошка – пушонки, то образуется хлорная, или белильная известь – рыхлый белый порошок с запахом хлора.
Она состоит главным образом из гипохлорита кальция Са(СlO)2
ихлорида кальция:
+2Са(ОН)2 = СаCl2 +Са(ClO2 ) +2Н2О.
Хлорная известь — сильный окислитель и применяется:
для отбеливания хлопчатобумажных тканей, бумаги;
хлорирования воды, дезинфекции;
для дегазации местности, зараженной стойкими отравляющими веществами.
Белящие и дезинфицирующие свойства хлорной извести аналогичны свойствам жавелевой и хлорной воды:
угольная кислота вытесняет из гипохлорита кальция хлорноватистую кислоту, которая и производит окисляющее действие.

Фтор
Фтор – ядовитый светло-зеленый газ.
Молекула его двухатомна с неполярной ковалентной связью
(F2).
Получают фтор электролизом его расплавленных соединений.
Это сильнейший окислитель, окисляющий даже некоторые благородные газы:
+Хе = ХеF4.
Непосредственно он не взаимодействует только с гелием, неоном и аргоном.
Фтор широко применяется в синтезе полимерных материалов
– фторопластов, обладающих высокой химической стойкостью, а также в качестве окислителя ракетного топлива.
Фтороводород растворяется в воде, образуя плавиковую кислоту НF.

Фтор и бром
Важная особенность этой кислоты – взаимодействие с
оксидом кремния (IV):
SiO2 +4HF =SiF4 +2H2O.
Поэтому ее хранят, в сосудах из парафина, каучука, полиэтилена или свинца, так как она разъедает стекло.
Плавиковая кислота применяется для удаления песка с металлического литья и травления стекла.
Бром – тяжелая красно-бурая жидкость. Пары брома ядовиты.
При попадании брома на кожу образуются сильные ожоги.

Бром и йод
Иод – черно-фиолетовое твердое вещество.
Молекулы брома и йода двухатомны с неполярной ковалентной связью: Вг2 и I2.
Растворимость их в воде небольшая.
При этом образуются соответственно бромная и йодная вода (аналогия с хлорной водой).
Однако они хорошо растворяются в органических растворителях – спирте, бензоле, бензине, хлороформе.
При нагревании йод образует фиолетовые пары, которые при охлаждении снова превращаются в кристаллы.
Происходит возгонка йода, т. е. испарение твердого вещества и образование кристаллов из паров, минуя жидкое состояние.

Бром и йод
Валентные электроны у брома …5s25p5, у йода …6s26p5.
Отсюда следует, что по химическим свойствам бром и йод аналогичны хлору, только менее реакционноспособны.
Бром и йод – сильные окислители.
Их окислительная способность используется при различных синтезах и анализах веществ.
Большие количества брома и йода идут на приготовление лекарств.

Вопросы и задачи
Как получить хлор, бром и йод в лабораторных условиях? Написать уравнения соответствующих реакций.
Каковы химические свойства фтора, хлора, брома и йода? Где применяются галогены?
Что такое хлорная вода и как ее можно получить?
Почему хлорную воду надо защищать от действия света?
Как получить хлороводород и соляную кислоту?
Написать формулы кислородных кислот хлора и назвать их.
Какой состав имеет хлорная известь? Где ее применяют?
С помощью каких реакций можно различить растворы КСl, КВг, КI?

Вопросы и задачи
Какой объем xлороводорода, взятый при нормальных условиях, необходим для нейтрализации растворов, содержащих 20 г гидроксида калия? (Ответ: 8 л.)
Сколько миллилитров 2 М раствора соляной кислоты окислилось оксидом марганца (IV), если известно, что выделенный при этом хлор может вытеснить из раствора йодида калия 25,4 г йода? (Ответ: 200 мл.)
Для синтеза хлoроводорода были пропущены через раствор йодида калия 100 мл газовой смеси (из хлора и водорода). При этом выделилось 0,508 г йода. Определить состав взятой смеси в объемных долях (%).
(Ответ: 44,8% С12 и 55,2% Н2.)
20. Как провести следующие превращения веществ:
НС1 → Сl2 → NaCl → АgСl →АgI.

Жесткость воды
Растворимые соли кальция и магния обусловливают
жесткость воды.
В природе чистая вода не встречается, она всегда содержит примеси каких-либо веществ.
Взаимодействуя с солями, содержащимися в земной коре, она приобретает определенную жесткость.
Жесткость воды – совокупность свойств, обусловленных содержанием в воде ионов Са2+ и Mg2+.
Если концентрация этих ионов велика, то воду называют
жесткой, если мала – мягкой.
Именно эти ионы придают специфические свойства природным водам.
При стирке белья жесткая вода не только ухудшает качество стираемых тканей, но и приводит к повышенным затратам мыла, которое расходуется на связывание ионов Са2+ и Mg2+:
