
lecture3ax
.pdf
Реакції комплексоутворення в аналітичній хімії
•Реакції між комплексоутворювачем і лігандами проходять у розчині.
•У водному розчині «внутрішня сфера» є самостійною часткою, іони зовнішньої сфери пов’язані з нею дуже слабко, практично не впливаючи на важливі для аналізу характеристики.
іонний |
внутрішня – зовнішня сфера |
|
|
K3[Fe(CN)6] |
3К+ + [Fe(CN)6]4-; |
|
[Co(NH3)5Cl]Cl2 |
[Co(NH3)5Cl]2+ + 2Cl-; |
ковалентнополярний (донорно акцепторний)

Реакції комплексоутворення в аналітичній хімії
Аналітики вважають комплексними сполуками продукти взаємодії центрального атома з лігандами, незалежно від наявності заряду в сполуки, що утворюється, і можливості його препаративного виділення.
комплексом (комплексною часткою) аналітики
називають іон або молекулу, до складу яких входять більш прості частки, здатні до самостійного існування в розчині (або в складі кристала).
Приклади:
Аніонний комплекс Fe(SCN)6 |
3– |
, |
|
|
H2O |
|
|
|
|
|
H2O |
|
|
|
|
H2O |
H2O |
|
H2O |
H2O |
Cl2 . |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
нейтральний комплекс FeСl3 , |
|
|
|
Fe |
|
|
Cl3 ; |
|
|
Fe |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||||
катіонний комплекс Cu(NH |
) |
2+. |
H2O |
H2O H2O |
|
H2O |
H2O Cl |
|
|||||||
3 |
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
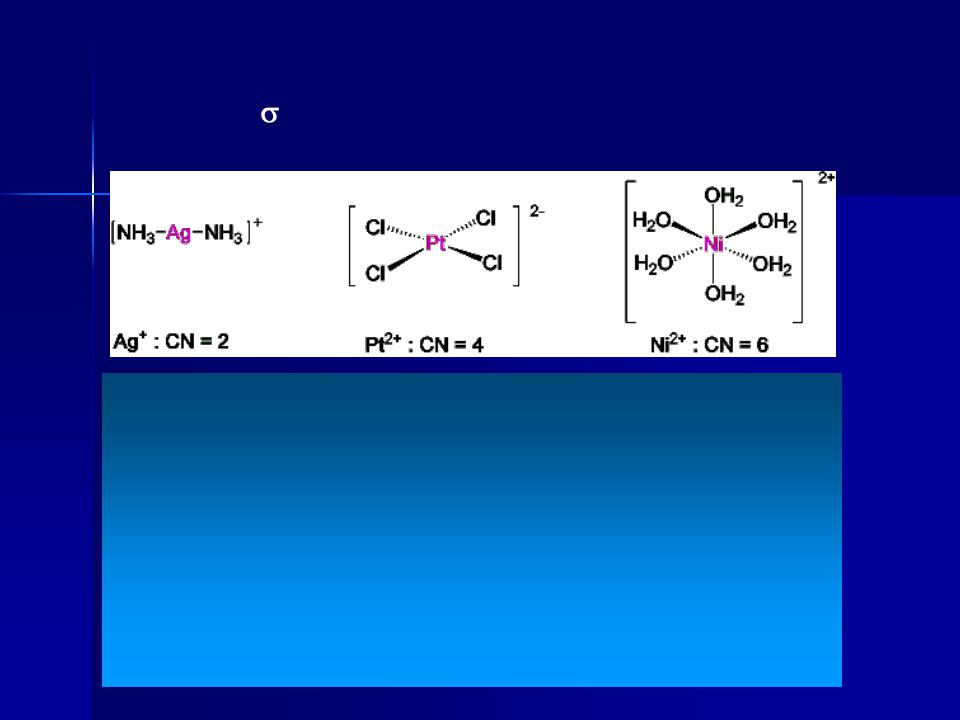
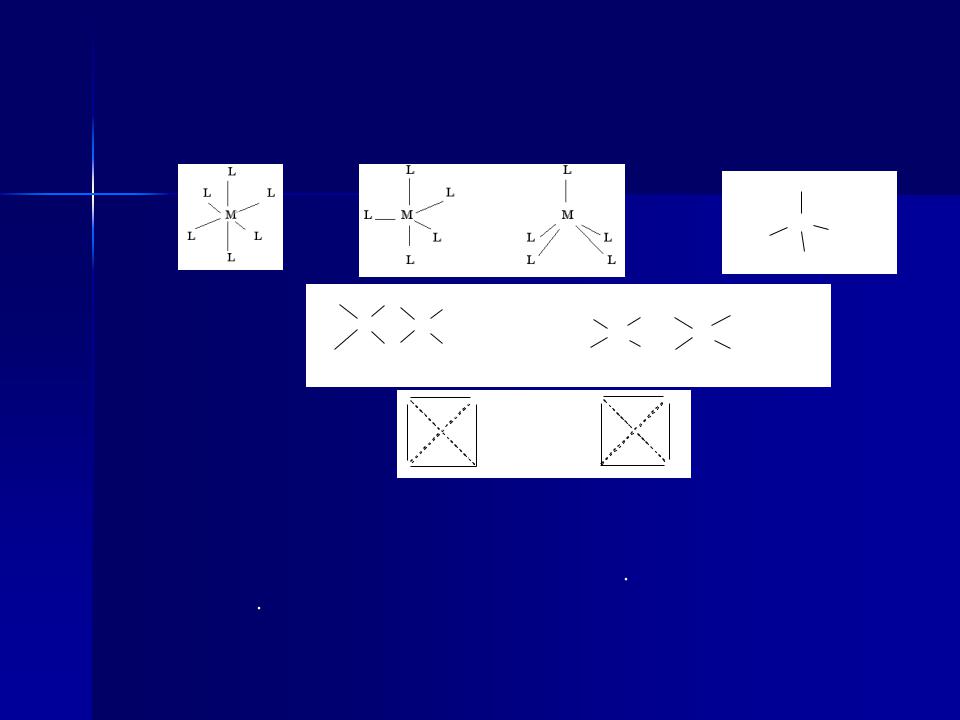
Координаційне число (к.ч.)
кількість - зв’язків центрального атома з лігандами К.ч. = 2-6, інколи 2-12
Координаційне число залежить від:
•електронної конфігурації центрального атома та ліганду
•співвідношення центрального атома та ліганду
•зарядів центрального атома та ліганду
•умов синтезу сполук

Дентaтність ліганду
число -зв’язків ліганду с центральним атомом (моно-, ди-,
 три- і т.д., чи полідентатні)
три- і т.д., чи полідентатні)
Дентaтність залежить від:
•Кількості донорних атомів
•Геометричної будови ліганду
•Природи центрального атома і т.д.
В аналізі застосовують комплекси:
які містять один центральний атом, а вся його координаційна сфера заповнена однаковими лігандами.
|
|
|
|
|
|
|
|
|
|
NH3 |
|
|
2+ |
||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
Zn |
NH3 |
|
||||
|
|
|
|
|
|
|
|
H3N |
|
||||||
поліядерні |
|
|
|
|
|
|
|
|
NH3 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||||
Cl |
|
|
|
|
|
|
|
2- |
|
|
|
||||
Cl |
NH3 |
|
|
H2NC2H4O |
NCS |
|
SCN |
|
|
|
|
||||
|
|
|
|
|
|
|
|
||||||||
|
Pt |
Pt |
; |
|
|
|
|
|
|
||||||
|
|
|
Cu |
Cu |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
||||||
NH3 |
Cl |
Cl |
|
|
NCS |
SCN |
|
OC2H4NH2 |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl |
NH3 |
Cl |
NH3 |
|
Змішанолігандні |
Pt |
|
Pt |
|
Cl |
NH3 |
NH3 |
Cl |
|
|
|
ненасичені (частина місць у координаційній сфері центрального атома зайнята молекулами розчинника)
[Cr(H2O)6]Cl3 – синьо-фіалковий, [CrCl2(H2O)4]Cl2 H2O –синьо-зелений,
[CrCl2(H2O)4]Cl 2H2O – зелений, [CrCl3(H2O)4]3H2O- темно-зелений.

Типи координаційних сполук, які використовуються в аналізі
Монодентатні
Аміакати та |
NH3, RNH2 |
[Co(NH3)6]Cl3 |
|||
амінати |
[Pt(C2H5NH2)4]Cl2 |
||||
|
|
|
|||
Акво- |
H2О |
|
[Cr (H2O)6]Cl3 |
||
комплекси |
|
[Ni(H2O)6]SO4 |
|||
|
|
|
|||
Ацидо- |
- |
- |
- |
K3[Fe(CN)6] |
|
комплекси |
(Cl |
, I , СN ) |
K4[FeF6],K[BiI4] |
||
|
|
|
|||
|
|
|
|
|
|
Гідроксо- |
|
OH- |
|
Na3[Cr(OH)6] |
|
комплекси |
|
|
|
Na3[Al(OH)6] |
|
|
|
Бідентатні |
|
|
|
||||
|
Етилендиамін (en) |
|
|
|
|
[Ni(en) |
]2+ |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
H2N |
NH2 |
|
|
|
|
|
Ацетилацетон (acac) |
H3C |
|
CH3 |
Fe(acac)3 |
|
|||
|
|
|
|
O |
O |
|
|
|
|
|
Полідентатні |
|
|
|
|||||
Циклічні |
|
|
|
|
|
|
|
|
|
чи хелатні |
Диетилентриамін |
|
|
N |
|
[Ni(dien)2]2+ |
|||
|
(dien) |
|
|
|
|
|
|
||
|
H2N |
H |
NH2 |
|
|
|
|||
|
|
|
|
|
|
||||
|
Етилендиамінтетроцтова |
|
|
|
|
|
|||
|
кислота (edta) |
|
|
|
|
|
[Mg(edta)] |
2- |
|
|
|
|
|
|
|
|
|
||
|
HOOC |
N |
|
N |
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
HOOC |
|
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
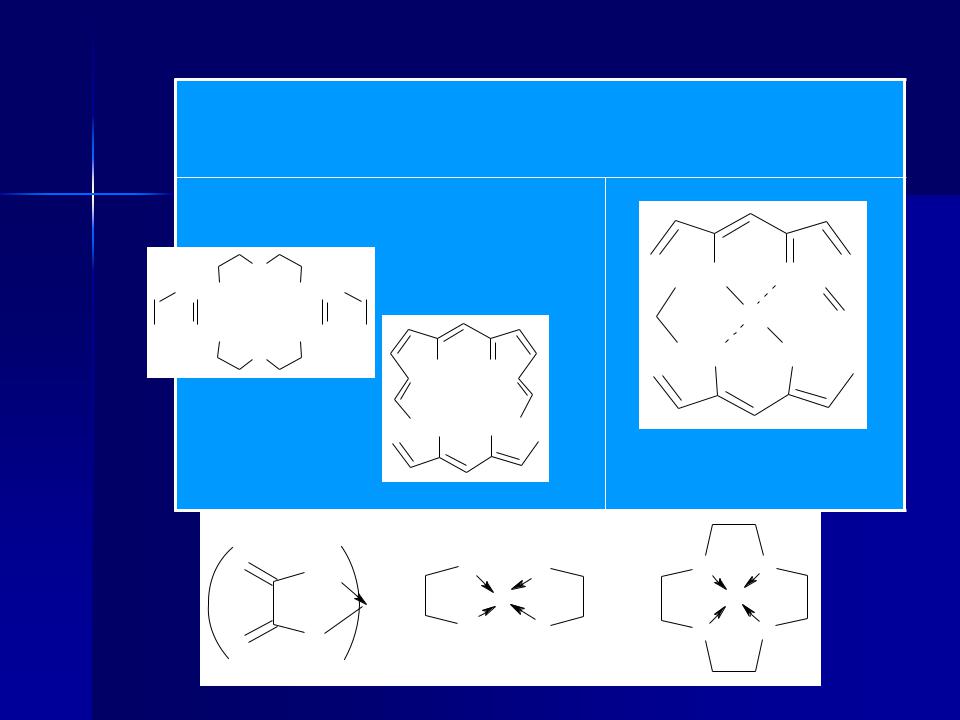
Макроциклічні
Дибензо-18-краун-6
O

 O O
O O 


 O O
O O 

O
 NH N
NH N

 N HN
N HN
 N N
N N
 Fe
Fe 

 N N
N N
O |
NH |
|
|
NH2 |
H2N |
|
O |
O |
|
|
|
|
|||||
|
2 |
|
; |
|
|
|
|
|
|
|
M |
M |
; |
|
M |
||
|
|
|
|
|
|
|
|
|
|
O |
|
|
NH |
H N |
|
O |
O |
O |
|
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Рівноважні і кінетичні характеристики комплексів
За величиною константи рівноваги
стійкі |
нестійкі |
За швидкістю утворення та руйнування
нертні |
лабільні |
0,1 моль/л, < 1хв

Рівноваги в розчинах комплексних сполук
[Cu(NH3)4](OH)2 = [Cu(NH3)4]2+ + 2 OH-
[Ni(NH3)6]2[Fe(CN)6] = 2 [Ni(NH3)6]2+ + [Fe(CN)6]4-
Константа стійкості |
Константа нестійкості |
