
lecture3ax
.pdf
Аналітична хімія
Лекція 3
Реакції утворення та розчинення осадів у хімічному аналізі.
Комплексні сполуки й органічні реагенти в
аналітичній хімії.
Доцент, к.х.н., Г.М. Зайцева
Кафедра медичної та загальної хімії
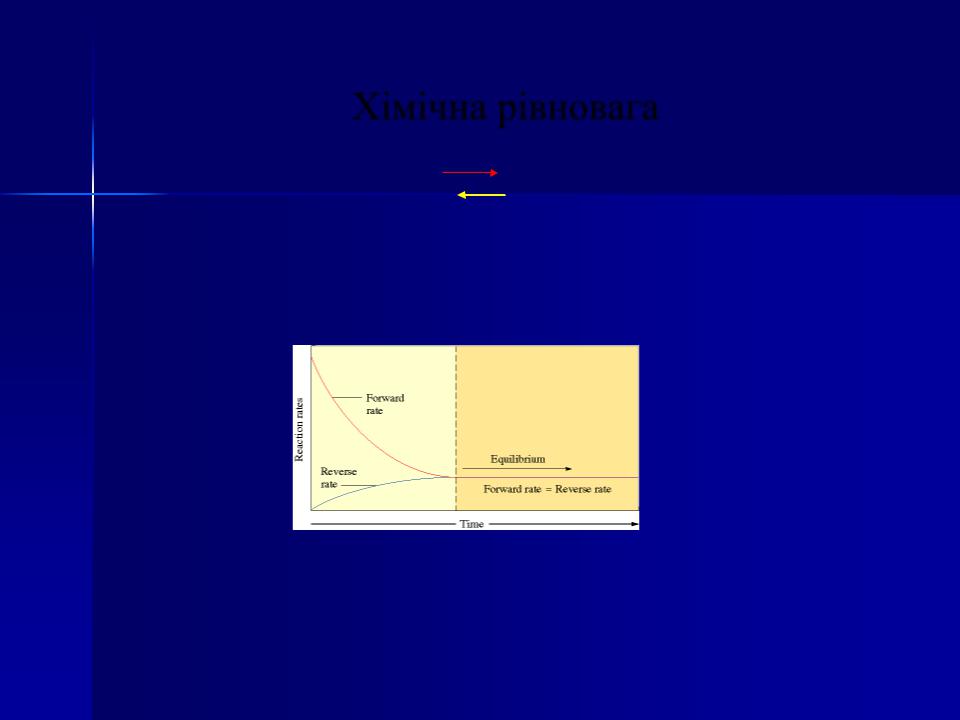
Хімічна рівновага
пряма
aA + bB |
cC+dD |
обернена
У рівновазі:
Швидкість прямої реакції = Швидкість оберненої реакції
T, Р =const
Кількість фаз у системі =const
Концентрація компонентів системи =const
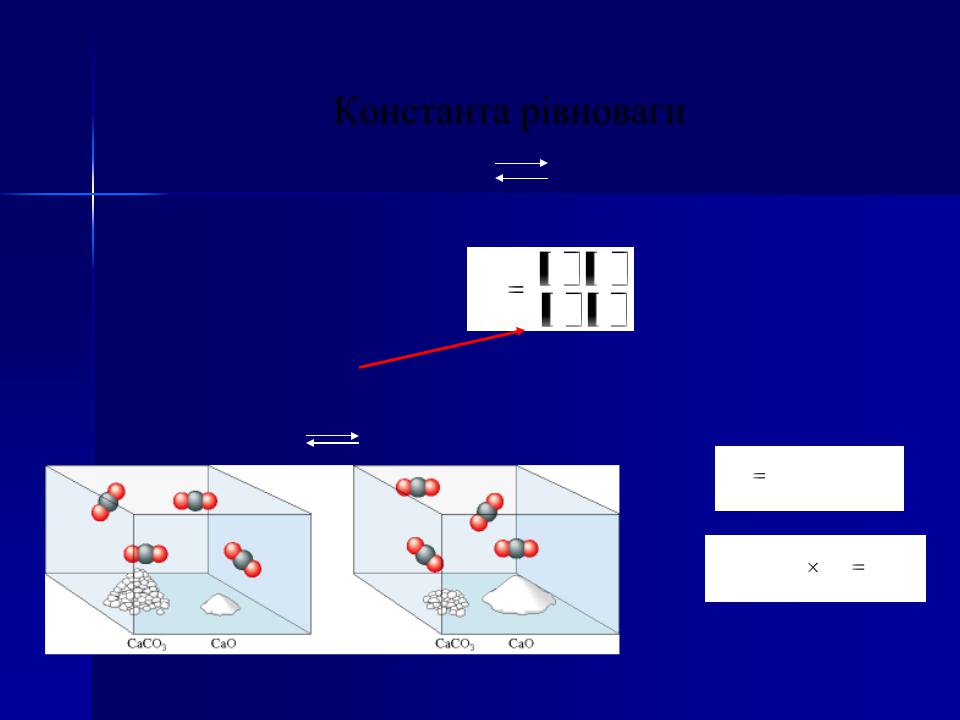
Константа рівноваги
aA + bB |
cC+dD |
|
|
Kc |
C c |
D d |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A |
a |
B |
b |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рівноважна молярна концентрація |
|
|
|
|
|
|
|
|
|
|
|
|
||
CaCO3(тв) |
CaO(тв) + CO2(г) |
|
|
|
|
|
' [CaOтв ][CO2 ] |
|||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
K c |
|
|
|
|
|
|
|
|
|
|
|
|
|
[CaCO3тв ] |
||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
[CaCO3тв ] |
|
K ' |
[CO ] |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
[CaOтв ] |
c |
2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||
Kc=[CO2]

Напрямок реакції
aA + bB  cC+dD
cC+dD
Q |
C o c D |
0 d |
|
A o a B 0 b |
|
||
|
|
||
|
|
|
|
Вихідні концентрації
Q = K система у рівновазі
Q > K
Q < K

Малорозчинні солі

Реакції осадження
Природа іонів С0(іонів)
рН Іонна сила
Т
Посторонні речовини

Добуток розчинності
•розчинність: кількість речовини, яка розчиняється з утворенням
насиченого розчину
•Молярна розчинність: кількість молей речовини, яка розчиняється з
утворенням 1л насиченого розчину
•ДР (МхАу): константа рівноваги у системі – малорозчинної речовини у
твердій фазі та її насиченим розчином
MxAy( тв) |
MxAy (р) |
xMy+ + yAx- |
ДР(MxAy ) = [My+]x∙ [Ax-]y
Рівноважна молярна концентрація Ступінь = числу іонів у формулі
Moль/л насиченого розчину

Добуток розчинності
У ненасиченому розчині |
[М]x[А]y < ДРС. |
У пересиченому розчині |
[М]x[А]y > ДРС. |
[A]поч > ДРС / [M]поч = ДРС / СМ.

Добуток розчинності
Залежить від: |
не залежить від |
Природи реагентів |
концентрації реагентів |
Т |
концентрації електролітів |
|
ДР при 250C є const |
AgCl(тв)Ag+(р)+Cl–(р)
Kрів |
[Ag+ р ][Cl- р ] |
|
|||||
|
[AgClтв ] |
|
|
||||
|
|
|
|
||||
K |
рів |
[AgCl |
тв |
] ДР(AgCl) [Ag+ |
р ][Cl- р ] |
||
|
|
|
|
|
|
||
[Ag+] та [Cl-] - молярна розчинність солі

Добуток розчинності
речовина |
Рівновага у водному розчині |
ДР |
AgCl |
AgCl(s) Ag+(aq)+Cl-(aq) |
ДР(AgCl)=[ Ag+][ Cl-] |
|||
|
|||||
|
|
|
|||
PbI2 |
PbI2(s) Pb2+(aq)+2I-(aq) |
ДР(PbI2)=[ Pb2+][ I-]2 |
|||
|
|
|
|
|
|
Fe(OH)3 |
Fe(OH)3 |
|
Fe3+(aq)+3(OH)-(aq) |
ДР(Fe(OH)3= |
|
|
|
|
|
|
[ Fe3+][ OH -]3 |
Ca3(PO4)2 |
Ca |
(PO ) |
2 |
3Ca2+(aq)+2PO 3 -(aq) |
ДР(Ca3(PO4)2)= |
|
3 |
4 |
4 |
[ Ca2+]3[ PO43-]2 |
|
|
|
|
|
||
