
Раздел 1
Общая эпизоотология
Личная профилактика ветеринарных специалистов при противоэпизоотических мероприятиях и работе с заразным материалом
Цель занятия: пройти первичный инструктаж о мерах личной профилактики при работе с больными животными и заразным материалом, правилах техники безопасности на кафедре эпизоотологии во время занятий; ознакомиться с учебными пособиями по курсу эпизоотологии и дополнительной литературой.
Материалы и оборудование: спецодежда и обувь (халаты, бахилы, нарукавники, костюмы, перчатки), средства индивидуальной защиты (очки, респираторы).
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Наибольшую опасность для животноводства представляют инфекционные болезни, которые в отличие от неинфекционных патологий характеризуются следующими особенностями:
вызываются определенными видами возбудителей;
имеют тенденцию к широкому распространению;
зараженный организм сам становится источником инфекции;
В инфицированном организме происходит иммунная перестройка. Существует целый ряд инфекционных болезней, общих для животных и человека и получивших название зооантропонозов.
Инфекционные болезни протекают циклично, при этом можно выделить несколько стадий, или периодов:
а) инкубационный;
б) продромальный;
в) проявления основных клинических признаков болезни;
г) угасания;
д) восстановления нарушенных функций организма;
Наиболее опасные зооантропонозы
|
Бактериальные
|
Сибирская язва Туберкулез Бруцеллез Лептоспироз Сап Сальмонеллезы Туляремия Ку-лихорадка Рожа (эризипелоид) Ерсиниоз Листериоз Ботулизм |
|
Вирусные |
Бешенство Болезнь Ауески Псевдочума птиц |
|
Грибные
|
Трихофития Микроспория |
|
Паразитарные
|
Трихинеллез Цистицеркоз Эхинококкоз Альвеококкоз Фасциолез |
Человек может заразиться зооантропонозами:
-
при клиническом осмотре животных и оказании им лечебной помощи;
-
во время диагностических исследований и обработок (например, прививок);
-
при вскрытии трупов и взятии патологического материала для лабораторного анализа;
-
работе с патологическим материалом в лабораториях;
-
соприкосновении с необезвреженным сырьем животного происхождения, переработке мясных и молочных продуктов;
-
употреблении в пищу инфицированных продуктов животного происхождения.
Пути заражения могут быть различными: существует конъюнктивальный путь — через слизистые оболочки глаз, алиментарный — через пищеварительный тракт, аэрогенный — через органы дыхания, трансмиссивный, когда инфекцию переносят разнообразные насекомые, например клещи, в организме которых возбудитель может долго сохраняться (сибирская язва, туляремия, клещевой энцефалит и др.), через поврежденную кожу и др.
Правила личной профилактики ветеринарных специалистов. Чтобы избежать заражения инфекционными болезнями, ветеринарные специалисты используют при работе средства личной профилактики: халаты, колпаки, косынки, нарукавники, фартуки, резиновые перчатки, маски, защитные очки, противогазы, резиновые сапоги и др. По окончании работы сотрудники снимают спецодежду и обувь, подвергают их санитарной обработке и хранят в специальных индивидуальных шкафах. Выход из производственного помещения в спецодежде и обуви (на обед или после окончания работы) категорически запрещен.
Зооантропонозами чаще всего заболевают люди, постоянно контактирующие с животными или участвующие в переработке сырья животного происхождения. Ветеринарный специалист заражается, как правило, в тех случаях, когда пренебрегает правилами работы с инфекционно-больными животными или патологическим материалом.
Следует помнить, что ветеринарный врач также несет ответственность за охрану здоровья всех лиц, обслуживающих инфекционно-больных животных.
Обслуживающий персонал может сам служить разносчиком возбудителей инфекций, поэтому при обследовании животных, взятии крови, прививках и др. необходимо использовать только стерильные инструменты, обязательно дезинфицировать руки после процедур с каждым животным и, приступая к обработкам здоровых животных, менять спецодежду и обувь.
Кроме того, при контакте с больными или подозреваемыми в заражении животными категорически воспрещается курить и принимать пищу.
Каждый ветеринарный специалист обязан всегда помнить и строго выполнять правила личной профилактики и требовать того же от всего подчиненного ему персонала.
Правила обращения с инфекционно-больными животными. При обследовании больных или подозрительных по заболеванию животных необходима чрезвычайная осторожность. Прежде чем приступить к подробному исследованию, собирают по возможности полный анамнез, необходимы также предварительное наблюдение и беглый клинический осмотр.
Следует соблюдать осторожность и при оказании лечебной помощи больным животным (например, бруцеллезом можно заразиться при отделении последа или родовспоможениях). Место работы с больными животными обязательно дезинфицируют.
Больных и подозрительных по заболеванию животных надежно изолируют от остального поголовья в специальном здании — изоляторе, который должен находиться на расстоянии не менее 200 м от жилых и животноводческих помещений. Обслуживание больного поголовья поручают персоналу, не соприкасающемуся с другими животными. Выделенных сотрудников обеспечивают спецодеждой и обувью, тщательно инструктируют; их спецодежду периодически обеззараживают и хранят в изоляторе в специальных шкафах.
Уборку навоза, доставку корма, подстилки и воды организуют таким образом, чтобы не допустить распространения инфекционной болезни. Для дезинфекции обуви у дверей изолятора оборудуют дезбарьеры. Больных животных содержат в индивидуальных денниках. При поражении животных одной болезнью допустима групповая изоляция.
Исключительно важно обеззараживать сточные воды и навоз, накапливающиеся в изоляторах. Для обеззараживания сточных вод используют хлорную известь, навоза — средства, предусмотренные соответствующей инструкцией.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Перечислить наиболее опасные зооантропонозы, пути заражения ими человека.
2. Изучить устройство и принцип работы автоклава.
Занятие 2.
Методы диагностики инфекционных болезней животных
Цель занятия: освоить комплексный метод диагностики инфекционных болезней, изучить правила клинического исследования животных с целью выявления больных инфекционными болезнями и ведение клинической документации.
Материалы и оборудование: таблица комплексного метода диагностики инфекционных болезней, 5...10 животных разных видов, инструменты и оборудование для клинического исследования животных, бланки специальных исследований.
Место проведения занятия: клиника ветеринарного учебного заведения или хозяйство, неблагополучное по инфекционным болезням скота.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
При подозрении на инфекционную болезнь в хозяйстве основная задача врача-эпизоотолога — своевременно установить диагноз, используя комплексный метод диагностики.
|
Комплексный метод диагностики инфекционных болезней |
|
Эпизоотологический Клинический Патоморфологический: патологоанатомический гистологический Бактериологический: микроскопия (световая, люминесцентная) выделение возбудителя биопроба Вирусологический: микроскопия (люминесцентная, световая, электронная) выделение вируса биопроба Гематологический Иммунологический: аллергическая проба (внутрикожная, глазная, подкожная) серологический (РА,РГА, РНГА, РТГА, РТНГА, ККРА, ККРНГА, РСК, РДСК, РИФ, РЗГАд, РНГАд, РП,РДП,РН, ' РИД,РБП, РИА, . ИФА, РФ, РИЭОФ,КР с молоком, РБП) |
Примечание. Для каждой болезни существует перечень показателей, по которым диагноз считают установленным.
Благодаря правильному и своевременному диагнозу удается обеспечить эффективность оздоровительных мероприятий, т.е. быстро купировать возникший эпизоотический очаг и предупредить дальнейшее распространение болезни.
Эпизоотологический метод. Представляет собой систему изучения проявлений эпизоотического процесса. Для характеристики последнего необходимо собрать точную информацию о восприимчивых видах, источнике и резервуаре возбудителя болезни, механизме его передачи, воротах инфекции, интенсивности проявления эпизоотического процесса, сезонности, предрасполагающих факторах, заболеваемости, смертности, летальности. Кроме того, особое внимание обращают на факторы, определяющие пути дальнейшего распространения заболевания — выполнение противоэпизоотических мероприятий и условия внешней среды.
Чтобы охарактеризовать эпизоотическое состояние хозяйства, сопоставляют и оценивают обобщенные эпизоотологические показатели, получаемые путем статистической обработки данных первичного учета заболеваний и профилактических мероприятий.
Клинический метод. При клиническом исследовании животных, подозреваемых в заболевании инфекционной болезнью, необходимо всегда строго соблюдать правила работы, предусмотренные соответствующей инструкцией.
Клиническое исследование рекомендуют начинать с измерения температуры тела животного. Далее осматривают животное в нефиксированном состоянии: обращают внимание на положение тела реакцию на различные раздражители, прием корма и воды, характер фекалий, особенности дефекации и мочеиспускания. Затем приступают к исследованию отдельных систем и органов по схеме, общепринятой в клинической диагностике болезней. Клинические признаки инфекционной болезни зависят от многих факторов: вида и локализации возбудителя, течения, формы проявления и стадии болезни, резистентности организма и других причин. Во всех случаях клинические признаки одной и той же инфекционной болезни у животных даже одного вида сильно варьируют.
Патоморфологический метод. Включает в себя патологоанатомический и гистологический методы исследований. Патологоанатомический метод считают важным, но не всегда окончательным методом диагностики. Например, если при вскрытии трупа животного (птицы) отмечают характерные изменения — туберкулы, то сразу же диагностируют туберкулез, при обнаружении в селезенке свиньи краевых геморрагических инфарктов — чуму, кровоизлияний на границе мышечного и железистого желудка у кур — болезнь Ньюкасла и т. д.
Порядок патологоанатомического исследования: оценивают состояние трупа, кожи и слизистых оболочек, затем исследуют лимфатическую систему, серозные покровы, мышцы и суставы, органы дыхания, сердце и кровеносные сосуды, печень, селезенку, почки, глотку, пищевод, желудок, тонкий кишечник, толстый кишечник, мочевой пузырь, органы воспроизводства, головной и спинной мозг.
Однако во многих случаях наряду с патологоанатомическим применяют и метод лабораторных исследований (гистологических, бактериологических и др.). С помощью гистологического метода устанавливают точный диагноз при таких болезнях, как- бешенство (тельца Бабеша—Негри), ринопневмония (внутриядерные включения типа Коудри), оспа (тельца-включения).
Бактериологический метод. Это ценный метод диагностики инфекционных болезней. Для бактериологического исследования от больных или павших животных необходимо правильно взять патологический материал и грамотно оформить сопроводительный документ. Поступивший биоматериал обрабатывают в зависимости от предполагаемой болезни, делают мазки-отпечатки, красят их соответствующими методами, выделяют чистую культуру посевом на питательные (элективные) среды, заражают чувствительных лабораторных животных биоматериалом или выделенной чистой культурой.
Бактериологический метод диагностики некоторых инфекционных болезней
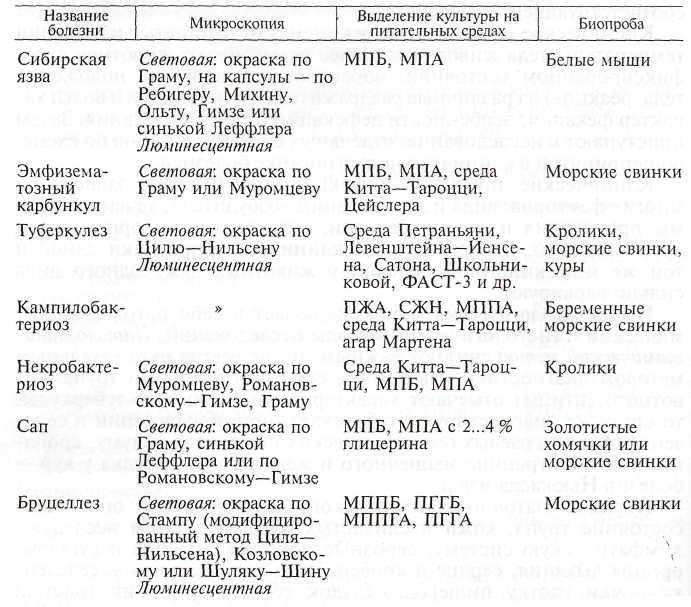
На основании обнаружения патогенных микроорганизмов в поступившем материале устанавливают этиологический диагноз.
Вирусологический метод. Для вирусологического исследования в лабораторию направляют патологический материал от больных животных, взятый в период проявления у них клинических признаков (температурная реакция, угнетение, воспалительные процессы в верхних дыхательных путях, сопровождающиеся серозными или слизистыми истечениями из носовой полости, диарея, образование везикул, афт, иногда аборты), или вынужденно убитых (павших) животных, взятый не позднее чем через 2 ч после их гибели. Вирусологический метод диагностики включает в себя: обнаружение возбудителя в патологическом материале различными методами (электронная, люминесцентная или световая микроскопия, заражение культуры клеток, лабораторных животных и т. д.), выделение и идентификацию вируса в различных серологических реакциях, биопробу.
Гематологический метод. В лабораторию для гематологического исследования отправляют кровь, которую берут с соблюдением правил асептики из яремной вены в пробирки с антикоагулянтом— 10 %-м раствором трилона Б, гепарина, цитрата натрия из расчета 0,02 мл раствора на 1 мл крови.
Гематологический метод используют как вспомогательный, а при некоторых инфекционных болезнях (лейкоз крупного рогатого скота, инфекционная анемия лошадей) — в качестве основного метода диагностики.
Иммунологический метод. Включает в себя серологическую диагностику — в лаборатории исследуют сыворотки крови для обнаружения антител и аллергическую пробу, с помощью которой в хозяйствах выявляют животных, больных туберкулезом, паратуберкулезом, бруцеллезом, сапом, реже — сибирской язвой, листериозом, туляремией.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Составить план сбора эпизоотологического анамнеза на молочно-товарной ферме.
2. Заполнить бланки клинических исследований животных.
Занятие 3. Серологические реакции и организация массовых серологических исследований
Цель занятия: приобрести навыки взятия крови у животных, организации массовых серологических исследований и оформления документации для отправки проб в лабораторию.
Материалы и оборудование: инструменты для взятия крови.
Место проведения занятия: мясокомбинат или хозяйство.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Серологические реакции и их диагностическое значение. Серологические исследования используют для диагностики инфекционных болезней, а также эпизоотологического надзора.
Суть серологической реакции заключается во взаимодействии антигена и антитела в среде электролита, например растворе хлорида натрия. С помощью известного антигена обнаруживают специфические антитела в организме больного животного, а с помощью известной сыворотки — антиген.
Посредством серологических реакций выявляют бактерионосительство, устанавливают бессимптомный инфекционный процесс, определяют родовую, видовую и типовую принадлежность возбудителя, эффективность вакцинации и т.д.
Серологические реакции характеризуются высокой специфичностью и чувствительностью: например, наличие белка в крови можно определить с помощью химических реакций (биуретановой пробы) в разведении 1:1000, тогда как с помощью РП — в разведении 1:100000.
В ветеринарии серологические реакции различных модификаций широко используют при диагностике бруцеллеза, лейкоза, сапа, лептоспироза, паратуберкулеза, микоплазмоза и многих других болезней. В необходимых случаях серологические методы исследования сочетают с аллергическими (сап, бруцеллез и др.).
Чтобы получить более достоверные результаты при вирусных инфекциях, рекомендуют исследовать парные сыворотки крови, что дает представление о росте титра антител (последний может свидетельствовать, например, о переболевании животного).
Серологические реакции, особенно их современные модификации (в частности, микрометодики), снижают трудоемкость диагностических исследований, сокращают расходы дефицитных. препаратов и реагентов, исключают опасность заражения персонала лаборатории возбудителями инфекционных заболеваний.
Техника взятия крови у животных разных видов. Животных фиксируют, подготавливают место прокола: выстригают шерсть (у птиц выщипывают перья, у свиней кончик хвоста обмывают теплой водой с мылом и высушивают чистым полотенцем), дезинфицируют 70%-м этиловым спиртом, спиртовым раствором йода или 3%-м раствором фенола.
Иглы (рис. 1) перед началом работы тщательно чистят мандреном промывают водой из спринцовок и стерилизуют кипячением в течение 30 мин. Для каждого животного используют отдельную стерильную иглу.
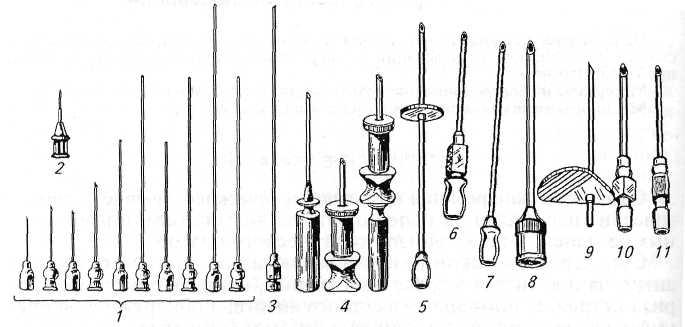
Для серологических исследовании у животных берут 8...10 мл коови у птиц—2...Змл (для исследования на лейкоз—З...4 мл, пои этом заранее вносят в пробирки 16 ЕД гепарина в 0,2 мл физиологического раствора).
Кровь берут из яремной вены, желательно утром до кормления животных. Большим пальцем или с помощью жгута пережимают яремную вену. При хорошем наполнении вены прокалывают иглой кожу и стенку вены под углом 45...50° по направлению к голове. К свободному концу иглы подставляют пробирку или надевают резиновую трубку, конец которой заранее опускают в пробирку. Кровь должна стекать струёй по стенке пробирки. Взятая по каплям и вспененная кровь скорее гемолизируется и часто бывает непригодной для исследования.
Если после прокола кожи кровь не течет, значит, игла еще не попала в вену или прошла вену насквозь. Необходимо уточнить место нахождения конца иглы и спокойно исправить ошибку. Если кровь вытекает каплями, нужно дополнительно сдавить вену пальцем или сильнее затянуть жгут.
Овец прогоняют через раскол, рядом с которым выкапывают траншею глубиной около 1 м. Ветеринарный специалист находится в этой траншее, и к нему по очереди подводят овец. Иногда вместо траншеи делают специальный длинный стол высотой 60...90 см. Овец через раскол и трапы загоняют на стол и фиксируют, ветеринарный врач стоит рядом и берет кровь (яремную вену у овец легко пережать пальцем).
Свиней предварительно фиксируют за верхнюю челюсть с помощью веревочной петли и пробы крови берут из уха или хвоста путем прокола или надреза сосудов. На практике чаще всего отрезают скальпелем кончик хвоста. Применяют и такой способ: у зафиксированного животного хвост поворачивают левой рукой так, чтобы вентральная его поверхность была обращена направо и кверху. На границе средней и нижней трети хвоста строго посередине остроконечным скальпелем прокалывают все мягкие ткани до позвоночника. При этом рассекают кожу, подкожную клетчатку, мышцы и вентральную артерию поперек. После прокола тканей хвосту придают естественное положение и приподнимают нижнюю его треть, для того чтобы операционная рана была открыта. Кровь выделяется равномерной струёй. Взяв нужное количество крови, место прокола смазывают 5%-м спиртовым раствором йода и хвост отпускают. В результате сокращения мышц хвое--та ^просвет прокола закрывается и кровотечение в течение 3...5 мин полностью прекращается.
Каждую пробирку с кровью закрывают пробкой. На этикетке указывают порядковый номер пробы, кличку или индивидуальный номер животного, фамилию владельца. Пробирки ставят в штатив или связывают по 10 шт. и помещают в ящик.
Оформление документов для отправки проб крови в лабораторию. Пробы крови направляют в ветеринарную лабораторию вместе с сопроводительным документом (форма 1) и ведомостью в двух экземплярах (форма 2 ).
Форма 1.
Отметка лаборатории ____________________________________
Дата поступления материала______________________________
Доставлено проб ____________________________________
Забраковано _________________________________________
В_______________ ветеринарную лабораторию ________________
Адрес: _____________________________________________
При этом направляется ______проб крови (сыворотки) от ____________
———————— , принадлежащего_____________________________
(вид животного) (наименование хозяйства,
населенного пункта, района)
дли __________ исследования на _______________________
(вид исследования) (название заболевания)
хозяйство, бригада, отара, гурт, табун _________________________
(благополучное, неблагополучное,
указать вакцину, дату вакцинации)
Исследование первичное, повторное (подчеркнуть)__________________
Дата и результат предыдущего исследования______________________
Дата взятия крови____________________________________
Форма 2

Ветврач (фельдшер),
направляющий пробы
Ветврач, проводивший
исследования
Занятие 4. Аллергические диагностические пробы и организация массовых аллергических исследований
Цель занятия - освоить технику аллергического диагностического исследования животных разных видов, приобрести навыки оценки аллергических реакций и
заполнения документов.
Материалы и оборудование: инструменты для постановки аллергических проб,
набор аллергенов.
Место проведения занятия: хозяйство или виварии вуза.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Техника аллергических диагностических исследований. В ветеринарии аллергический метод диагностики применяют при туберкулезе бруцеллезе, сапе, реже— при сибирской язве, листериозе, туляремии и др. Способы введения аллергена: внутрикожный (основной) по 0,1...0,5 мл, накожный, подкожный, конъюнктивальный. При внутрикожной туберкулинизации аллерген вводят:
крупному рогатому скоту, буйволам, оленям, зебу—в область средней трети шеи; быкам-производителям — в одну из подхвостовых складок;
мелкому рогатому скоту — в подхвостовую складку, веко;
свиньям — в область наружной поверхности уха на расстоянии 2 см от его основания (в одно ухо — ППД для млекопитающих, в другое — ППД для птиц);
козам, овцам, собакам, обезьянам и пушным зверям (кроме норок) — в область внутренней поверхности бедра или локтевой складки, норкам — в верхнее веко (интрапальпебрально);
курам — в бородку; индейкам — в подчелюстную складку;
кошкам наносят на внутреннюю поверхность уха.
Используют тонкие иглы для внутрикожных инъекций (см. рис. 1) и шприцы на 1...2 мл с бегунком или безыгольные инъек-торы (рис. 2).
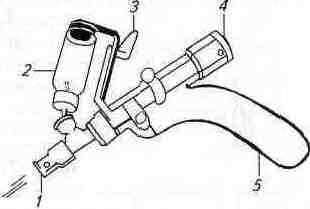
Рис. 2. Безыгольный инъектор:1 —рабочее сопло; 2— флакон с аллергеном; 3—регулировочный винт; 4—спусковой рычаг; 5— рукоятка
Инструментами, предназначенными для туберкулинизации, не разрешается вводить животным другие препараты. Шприцы и иглы до и после использования стерилизуют в течение 10 мин в дистиллированной или кипяченой воде без добавления дезинфицирующих веществ.
Шерсть на месте инъекции предварительно выстригают и выбривают, кожу обрабатывают 70%-м этиловым спиртом. О правильности выполнения пробы судят по образованию бугорка размером с горошину на месте введения препарата. Реакцию учитывают у крупного рогатого скота, буйволов, зебу, верблюдов и оленей через 72 ч; у коз, овец, свиней, собак, обезьян и пушных зверей — через 48 ч; у птиц — через 30...36 ч.
При учете внутрикожной реакции пальпируют место инъекции (при пальпебральном способе сравнивают веки левого и правого глаза). При обнаружении изменений кожи в месте введения аллергена у крупного рогатого скота, буйволов, зебу, верблюдов, оленей определяют размер утолщения с помощью кутиметра (рис. 3).
Рис. 3. Определение с помощью кутиметра размера утолщения кожной складки при положительном результате внутрикожной пробы на туберкулез: вверху — кожная складка до введения туберкулина; внизу-через 72 ч после введения туберкулина
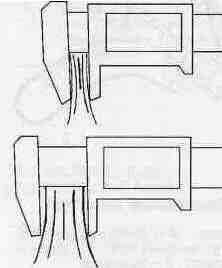
Животных считают положительно реагирующими на туберкулин в следующих случаях: крупный рогатый скот, буйволов, зебу, верблюдов и оленей — при утолщении складки кожи на 3 мм и более (независимо от характера реакции); коз, овец, собак, обезьян, пушных зверей, кур и других птиц — при образовании припухлости в месте введения туберкулина; норок — при опухании века.
Офталъмопробу применяют при исследовании лошадей на туберкулез и can, крупного рогатого скота — на туберкулез и только одновременно с внутрикожной инъекцией аллергена. Методом офтальмопробы животных исследуют двукратно с интервалом 5...6 дней. 3...5 капель аллергена наносят стерильной глазной пипеткой на конъюнктиву слегка оттянутого нижнего века или под третье веко.
Результаты первой офтальмопробы с маллеином учитывают через 3, 6, 9, 12 и 24ч, второй—через 3, 6, 9 и 12ч; первой офтальмопробы с туберкулином у лошадей и крупного рогатого скота — через 3, 6, 9, 12 и 24 ч, второй — через 3, 6, 9 и 12ч. При учете реакции осматривают конъюнктиву, открывая во всех случаях глаз животного.
По степени проявления реакцию на маллеин у лошадей подразделяют на положительную, сомнительную и отрицательную. Положительная реакция характеризуются гиперемией и отеком конъюнктивы, выделением из внутреннего угла глаза слизисто-гнойного или гнойного секрета, накапливающегося в конъюнктивальном мешке, а затем вытекающего в
виде шнура.
Отрицательная реакция характеризуется слабым покраснением
конъюнктивы, незначительным слезотечением или отсутствием каких-либо отклонений от нормы.
В качестве сомнительной реакции трактуют небольшое слезотечение или скопление гноя в углу глаза.
Положительная реакция на туберкулин у крупного рогатого скота и лошадей характеризуется выделением из внутреннего угла глаза слизисто-гнойного секрета, накапливающегося вначале в конъюнктивальном мешке, а затем вытекающего в виде шнура.
Для аллергической диагностики бруцеллеза у свиней применяют бруцеллин ВИЭВ. Аллерген вводят внутрикожно с наружной стороны ушной раковины, ближе к основанию уха, в дозе 0,2 мл. На месте введения препарата образуется бугорок размером с горошину. При инъекции обязательно соблюдают правила асептики. Участок кожи перед уколом протирают ватой, смоченной 70%-м этиловым спиртом или 3%-м раствором борной кислоты. Реакцию на бруцеллин учитывают дважды — через 24 и 48 ч путем осмотра, а при неясно выраженной реакции — пальпацией места инъекции. При обнаружении припухлости на месте введения препарата реакцию оценивают как положительную.
Организация массовых аллергических исследований. Прежде чем приступать к массовым аллергическим исследованиям, необходимо продумать способы фиксации животных, обеспечивающие, с одной стороны, безопасность людей и животных в процессе работы, а с другой — точное соблюдение места инъекции и дозы аллергена, что очень важно для правильного учета аллергических реакций. Для этой цели подготавливают различные приспособления и инструменты, а также приглашают вспомогательный персонал, который предварительно инструктируют.
Чтобы массовое аллергическое исследование не стало фактором распространения болезни, тщательно готовят инструментарий: стерильные шприцы и иглы для туберкулинизации, глазные пипетки в необходимом количестве, дезраствор для обработки поля инъекции и использованных игл, ножницы для выстрига-ния шерсти, кутиметры, безыгольные инъекторы (предварительно проверенные на годность к работе и обработанные дезраствором).
Накануне аллергического исследования осматривают поголовье, обращая внимание на состояние кожи (конъюнктивы): на месте инъекции кожа должна быть без ран, язв, ссадин, узлов, утолщений, отеков и пр. Обязательно оценивают качество аллергического препарата (наличие наставления, этикетки, внешний вид, срок годности).
Очень важно правильно обрабатывать поле (при туберкулинизации используют только спирт-ректификат) и вводить препарат, а также точно соблюдать сроки и методы учета реакций.
После окончания аллергического исследования и учета реакций составляют акт с описью исследованных животных аналогично акту на проведение вакцинации.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Академическую группу делят на подгруппы по 4...5 человек. Каждый студент подгруппы последовательно выполняет функции подсобного рабочего (при фиксации животного), санитара, фельдшера и врача.
1. Отработать аллергическое исследование животных разных
видов:
туберкулинизацию крупного рогатого скота внутрикожным и
глазным методами;
туберкулинизацию свиней внутрикожным методом одновременно двумя туберкулинами;
туберкулинизацию кур, индеек, уток внутрикожным методом;
маллеинизацию лошадей подкожным и глазным методами;
исследование свиней на бруцеллез внутрикожным методом.
2. Составить акт аллергического исследования на туберкулез животных разных видов.
3. Составить акт аллергического исследования свиней на бруцеллез.
Занятие 5. Правила взятия и пересылки патологического материала для лабораторных исследований
Цель занятия: изучить основные правила отбора и пересылки патологического
материала для лабораторного исследования, а также оформление сопроводительных документов.
Материалы и оборудование: секционный набор, спецодежда, металлические шпатели, консерванты [30%-й раствор химически чистого глицерина на стерильном физиологическом растворе: фосфатно-солевой буферный раствор (рН 7,6), 10%-й раствор формалина или 96%-й этиловый спирт], дезинфектанты (3...5%-й раствор карболовой кислоты, хлорная известь или 10%-й раствор гидроксияа натрия), термос со льдом, стерильные пробирки и флаконы с пробками, предметные стекла, спиртовка, стеклограф или водоустойчивый фломастер, пленка, пергаментная бумага, шпагат, пеналы, деревянный ящик, стеклянные банки, сургуч, парафин, пастеровские пипетки.
Место проведения занятия: хозяйство, ветеринарно-санитарный утильзавод (ВСУЗ).
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Отбор материала для прижизненной диагностики. В зависимости от вида инфекции у клинически больных животных берут соответствующий, специфический для данной болезни материал, соблюдая меры личной безопасности.
Секрет молочных желез служит объектом исследования при тех
яболеваниях, при которых возбудитель активно выделяется с молоком (туберкулез, бруцеллез, сальмонеллез, мастит). У коров вымя обмывают теплой водой с мылом, соски обрабатывают 70%-м спиртом Первые струйки молока удаляют, в стерильные сосуды набирают 15...20 мл секрета из первой и последней порций, полученных при выдаивании.
У овец и коз пробы получают путем пункции цистерны вымени Поле операции готовят у основания соска, стерильной иглой, соединенной со шприцем, делают пункцию, набирают в шприц секрет и переносят его в стерильные пробирки с резиновыми
пробками.
Моча чаще всего служит объектом исследования при подозрении на лептоспироз. У коров и свиноматок мочу можно брать непосредственно из мочевого пузыря с помощью катетера или собирать при естественном мочеиспускании в чистые пробирки, банки. Легче всего мочу получать после утреннего подъема животных, а у свиней — в любое время дня после 1 ...2-часового лежания.
Кал берут из прямой кишки в стерильную посуду, которую закрывают плотной крышкой. При обнаружении на стенке прямой кишки слизи, утолщений или других патологических изменений дополнительно делают соскобы; их помещают в отдельную посуду.
Выделения из верхних дыхательных путей и ротовой полости собирают в посуду при естественном истечении или поступают так:
крылья носа и переднюю часть носовых ходов обмывают водой, после чего выделения собирают стерильными тампонами из глубоких частей носа. Тампоны помещают в стерильные пробирки, содержащие по 0,5 мл стерильного физиологического раствора.
Содержимое синовиальных бурс и абсцессов берут следующим об' разом. Шерсть выстригают, кожный покров обрабатывают 70%-м спиртом и смазывают настойкой йода. Затем стерильным шприцем с иглой большого диаметра делают пункцию и переносят пунктат в стерильную пробирку с резиновой пробкой.
Материал из язв и ран получают методом соскоба на границе пораженной и здоровой тканей.
Волосы и участки кожи исследуют при кожных заболеваниях. При этом волосы выщипывают, а соскобы с кожи делают скальпелем на границе пораженной и здоровой тканей.
Кровь для серологических исследований берут в разгар заболевания, а в некоторых случаях повторно через 10...20 дней по 10 мл от двух-трех больных животных в разные пробирки.
Отбор материала для посмертной диагностики. Патологический материал необходимо взять как можно раньше: не позднее 12ч после гибели животного зимой и 6 ч — в теплое время года, законсервировать или отправить в свежем виде. Аутолизированный пат-материал для выделения возбудителя непригоден. Для бактериологического исследования в лабораторию отправляют кусочки кожи, слизистых оболочек, паренхиматозных органов, трубчатую кость, спинной и головной мозг, лимфатические узлы' пробы жидкости из грудной и брюшной полостей, отрезок кишечника, изолированный лигатурами, плод, плодные оболочки и т.д. Пробы из каждого органа помещают в отдельную посуду и маркируют. В каждом случае необходимо брать тот материал, в котором можно обнаружить характерные для данной болезни изменения.
Для вирусологического исследования материалом могут служить:
кровь или ее сыворотка, смывы из носоглотки и другие жидкости организма, стенки и содержимое афт, папулы (узелки), везикулы (серозные пузырьки), пустулы (гнойные пузырьки), кусочки головного мозга, печени, легких, селезенки или кусочки других органов и тканей, в которых вирус предполагаемого заболевания содержится в наибольшем количестве.
Для гистологического исследования патматериал берут только от свежих трупов. В лабораторию отправляют кусочки площадью 3...4 см2, толщиной не более 1 см, при этом следят, чтобы в них вошли пораженные и граничащие с ними неизмененные участки ткани.
Поверхность органа или ткани трупа на участке, из которого предполагают брать пробу, очищают от загрязнений, обеззараживают спиртом, 3%-м раствором фенола или прижигают нагретой металлической пластинкой (шпателем). Материал берут стерильными инструментами и помещают в стерильную посуду (пенициллиновые флаконы, пробирки и другие стеклянные сосуды с резиновыми пробками). Жидкий патматериал (кровь, слизь мочу, желчь и т. д.) можно набирать в одноразовые шприцы или пастеровские пипетки, которые затем с обоих концов запаивают. Кроме того, различные выделения можно посылать в виде мазков или мазков-отпечатков, которые фиксируют на воздухе, заворачивают каждый в отдельности в пергаментную бумагу и маркируют.
Трупы мелких животных, части трупов крупных животных и отдельные органы в свежем виде направляют для исследования в лабораторию только нарочным. Посылаемый материал тщательно упаковывают в плотный деревянный или металлический ящик, чтобы предупредить рассеивание возбудителя по пути следования.
Консервирование патологического материала. Полученные пробы отправляют в лабораторию в свежем виде; если невозможно отправить в течение ближайших 24...30 ч, то их фиксируют в консерванте.
Патматериал для гистологического исследования консервируют 10%-м водным раствором формалина или 96%-м этиловым спиртом. Объем консерванта должен в 10 раз превышать объем взятого материала.
Материал, предназначенный для бактериологического исследования фиксируют 30%-м химически чистым глицерином (лучше физиологическом растворе) или вазелиновым маслом. Соотношение патматериала и консерванта 1:4 или 1:5. Трубчатую кость и кишечник обычно консервируют поваренной солью.
Для вирусологического исследования материал консервируют 50% -м глицерином на стерильном физиологическом растворе Наилучший и простой метод сохранения биологических свойств вирусов в патматериале — охлаждение. Надежно закрытые (флаконы заворачивают в вату или упаковочную бумагу и плотно укладывают в термос, заполненный на 1/3 снегом или льдом. При этом в термосе в течение 12...24 ч удерживается температура 2 6 "С, при которой вирусы сохраняются практически без изменений.
Оформление документов на отправляемый материал. На взятый патологический материал ветеринарный врач составляет сопроводительный документ (форма 3). В документе необходимо указать также эпизоотическую ситуацию хозяйства, лечили животное или нет' если лечили, то какими препаратами, как законсервирован материал; число отправленных упаковок с пробами.
Форма 3
В ______________________________ ветеринарную лабораторию
Адрес_____________________.________________________
При этом направляется для ______________________________
патологический материал (перечислить какой) _____________________
'т____________ , принадлежащего____________________
(вид и возраст животного) (название хозяйства, фермы)
Дата заболевания животного _______________________________
Дата падежа ________'_________________________________
Клиническая картина ____________________________________
Данные патологоанатомического вскрытия _______________________
Предположительный диагноз _______________________________
Дата отправления материала ______________________________
Должность ____________________ Подпись ______________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Указать порядок взятия материала для различных исследований от больных животных и трупов.
2. Оформить сопроводительный документ к патологическому материалу.Занятие 6. Эпизоотологическое обследование хозяйства
Цель занятия: научиться проводить Эпизоотологическое обследование, составлять на него акт.
Материалы и оборудование: макеты хозяйств или компьютерные программы с типовыми данными по хозяйствам.
Место проведения занятия: аудитория кафедры эпизоотологии или хозяйство.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Эпизоотологическое обследование — один из приемов эпизоотологического метода диагностики, представляет собой комплекс мероприятий, цель которых:
всесторонне изучить причины возникновения эпизоотических очагов;
выяснить условия, благоприятствующие или препятствующие распространению определенных инфекционных болезней в конкретном хозяйстве;
уточнить диагноз;
выявить источники и пути заноса возбудителя инфекции, механизм его передачи;
определить границы эпизоотического очага, неблагополучного пункта, угрожаемой зоны;
организовать мероприятия для быстрейшей локализации и ликвидации возникшего заболевания;
устранить недостатки в системе противоэпизоотических мероприятий.
Эпизоотическое обследование проводят систематически, в установленные сроки, а при подозрении на болезнь — немедленно.
План эпизоотического обследования включает в себя: изучение ветеринарно-санитарного состояния хозяйства, определение его эпизоотической ситуации в прошлом и настоящем, анализ причин заболеваемости и гибели животных, системы противоэпизоотических мероприятий.
Ветеринарно-санитарное обследование начинают с общей характеристики хозяйства (пункта): специализация хозяйства и экономические показатели, наличие животных на день обследования по видам и возрастным группам, условия комплектования хозяйства животными, динамика поголовья за последний год, численность обслуживающего персонала и зооветеринарных специалистов, прочность кормовой базы (обеспеченность кормами, их вид, качество, источник поступления), рацион и режим кормления, наличие и состояние пастбищ, водопоев, летних лагерей, наличие животных по видам в частном секторе, связи данного пункта с другими хозяйствами.
Характеризуя ветеринарно-санитарное состояние пункта, обращая
внимание на зоогигиенические условия содержания животных:
обеспеченность помещениями, санитарное состояние последних, а также территории фермы (в том числе ее отгороженность и озелененность), наличие санпропускников, бытовых комнат, ветеринарных объектов, изоляторов, карантинных помещений и профилакториев, убойных площадок, обеспеченность работников спецодеждой и обувью, дезинфицирующими средствами.
Чтобы определить эпизоотическую ситуацию пункта, изучают план противоэпизоотических мероприятий, систему и порядок ветеринарных осмотров и обработок животных, начиная с рождения и до отправки на убой, общую и специфическую профилактику, схемы дезинфекции, дератизации, дезинсекции, причины, обусловливающие выбор прививок, состояние диагностической работы (практическое применение эпизоотологического, клинического патологоанатомического и лабораторного методов диагностики), достоверность диагноза (уточняют, кто и каким методом устанавливал диагноз). Анализируют информацию о выбывших животных с указанием их численности и причин, по которым животные выбыли. Знакомятся с лабораторными экспертизами, актами обработок, ветеринарными журналами, отражающими всю профилактическую деятельность. Обращают внимание на болезни с неустановленным диагнозом, зарегистрированные в хозяйстве.
Эпизоотический очаг — любой объект, где обнаружены источники возбудителя конкретной инфекционной болезни.
Неблагополучный пункт — населенный пункт, на территории которого выявлен эпизоотический очаг.
Угрожаемая зона — населенные пункты, расположенные вокруг эпизоотического очага, в пределах которых возможно распространение болезни. Угрожаемую зону определяют местные ветеринарные органы с учетом хозяйственных связей, географических, климатических и природных условий при некоторых особо опасных инфекционных болезнях животных (ящур, классическая и африканская чума свиней, болезнь Ньюкасла и др.).
Поскольку элементарной ячейкой проявления эпизоотического процесса является эпизоотический очаг, то обследовать необходимо именно его. Так как эпизоотический очаг в большинстве случаев находится в населенном пункте или на приписанных к нему сельскохозяйственных угодьях, то Эпизоотологическое обследование целесообразно проводить в целом по неблагополучному пункту. При таком подходе можно максимально учесть влияние хозяйственной и транспортной деятельности на распространение инфекционных болезней. Результаты эпизоотологического обследования как эпизоотического очага, так и неблагополучного пункта оформляют в виде соответствующего акта по следующей схеме.
1. Дата составления акта; название хозяйства и его адрес; кто, в какой период и с какой целью обследовал хозяйство; географическое положение и топографические особенности хозяйства, его общая характеристика.
2. Мероприятия, направленные на повышение общей резистентности организма.
3. Технология выращивания и эксплуатации животных; наличие в хозяйстве изоляторов, карантинных помещений; порядок утилизации трупов.
4. Система профилактических мероприятий (соблюдение правил профилактического карантина вновь поступающих в хозяйство животных, дата и вид профилактических прививок, схема иммунизации и применяемые вакцины, акты, подтверждающие проведение прививок, дезинфекционные, дератизационные и дезинсекционные мероприятия).
5. Благополучие по инфекционным болезням окружающих хозяйств, наличие экономических и хозяйственных связей с ними.
6. Подробная эпизоотологическая, клиническая, патологоанатомическая характеристика появившейся болезни, ее дифференциальная диагностика. Динамика заболеваемости; кто и каким методом установил диагноз; зарегистрированы ли ранее случаи того же заболевания в этой местности; нет ли данных, указывающих на периодичность эпизоотии; противоэпизоотические мероприятия, назначенные с момента появления заболевания.
7. Предполагаемый источник возбудителя инфекции (дать свое заключение о причинах вспышки, путях заноса и распространения инфекции, условиях, благоприятствующих ее распространению).
8. Тяжесть течения эпизоотии: заболеваемость, смертность и летальность.
9. Динамика эпизоотии (приложить план хозяйства с указанием движения эпизоотии по отдельным помещениям, фермам и т.д.); эффективность противоэпизоотических мероприятий.
Заключение должно содержать окончательный диагноз с указанием источника возбудителя инфекции и путей его распространения; оценку эффективности назначенных оздоровительных и профилактических мероприятий.
Предложения вносят в дополнение к уже назначенным мероприятиям или составляют новый план оздоровительных мероприятий применительно к данной эпизоотии.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Подготовить акт эпизоотологического обследования хозяйства.
Занятие 7. Биологические препараты, их классификация, правила транспортировки, хранения и оценка пригодности для использования.
Цель занятия: изучить биологические препараты, применяемые для профилактики диагностики и лечения инфекционных болезней сельскохозяйственных животных.
Материалы и оборудование: таблица классификации вакцин, вакцины, сыворотки аллергены, антигены, бактериофаги.
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Биологические препараты — средства биологического происхождения, применяемые в профилактических, диагностических и лечебных целях. Промышленность выпускает также и стимулирующие биопрепараты: иммуностимуляторы, кормовые антибиотики, гормоны, витамины.
Средства иммунопрофилактики. К ним относят вакцины, глобулины сыворотки. Основные показатели хорошего качества всех профилактических препаратов — стерильность или чистота (отсутствие контаминантов), безвредность, допустимая степень реактогенности, антигенная активность и иммуногенность, эпизоотическая эффективность.
Штаммы микроорганизмов, применяемые для изготовления вакцин, должны быть классифицированы, клонированы и представлять собой однородную популяцию микроорганизмов с характерными морфологическими, биохимическими и антигенными признаками.
Живые вакцины содержат культуру микроорганизмов аттенуированного штамма, сохранивших высокую иммуногенность с генетически закрепленной пониженной вирулентностью. Получают методом направленного изменения свойств возбудителя под воздействием внешней среды (вакцины против сибирской язвы, туберкулеза, бруцеллеза) или путем пассажей через организм невосприимчивых животных (вакцины против бешенства, рожи свиней). Живые вакцины наиболее перспективны для ветеринарной практики, так как иммунитет после их применения образуется, как правило, раньше и характеризуется большей напряженностью и длительностью.
Инактивированные вакцины содержат культуру микроорганизмов определенного вида, обезвреженных действием физико-химических факторов (высокая температура, ультрафиолет, фенол, формалин) и утративших способность к репродуцированию (без убого разрушения клетки микроорганизма, с сохранением иммуногенных свойств возбудителя). Инактивированные вакцины по иммуногенности уступают живым, поэтому их вводят в больших дозах и многократно. Чтобы повысить иммунологическую эффективность инактивированных вакцин, используют депонирующие вещества (адъюванты), которые по механизму действия на антиген делят на сорбирующие и эмульгирующие.
Анатоксины— вид вакцин, применяемых для активной профилактики токсикоинфекций животных. Получают методом обезвреживания бактерийных экзотоксинов 0,3...0,4%-м формалином с выдерживанием при 38...40 "С в течение трех-четырех недель. Анатоксины стимулируют синтез антитоксинов, которые, нейтрализуя экзотоксины возбудителя, не оказывают губительного действия на него самого. Широко используют поливалентный анатоксин против клостридиозов овец — инфекционной энтеротоксемии, брадзота, некротического гепатита, злокачественного отека овец и дизентерии ягнят.
Вакцины нового поколения — субъединичные, генно-инженерные — созданы с помощью методов биотехнологии.
По технологии изготовления вирусные вакцины делят на тканевые культуральные (лапинизированные) и эмбриональные — изготовленные из различных тканей животных, организм которых был использован в качестве среды размножения возбудителя.
В зависимости от примененного инактиватора все вакцины подразделяют на феноловые, формоловые, спиртовые, гретые; от добавленного адъюванта — на квасцовые (адсорбированные на алюмокалиевых квасцах), гидроокисьалюминиевые и масляные.
В зависимости от количества антигенов вакцины подразделяют на моновалентные — содержащие один антиген одного штамма (серотипа, биотипа) возбудителя данной болезни; поливалентные — содержащие антигены различных серотипов (биотипов, штаммов) возбудителя данной болезни; ассоциированные — содержащие антигены возбудителей нескольких заболеваний;
аутогенные — приготовленные из штамма микроорганизма, выделенного от больного животного, и для него же предназначенные.
Кроме того, выпускают вакцины жидкие и сухие — изготовленные в основном из живых слабоустойчивых штаммов, высушенные в условиях глубокого вакуума после предварительного замораживания (лиофилизация) или другим методом.
Прививки бывают профилактические (плановые) и вынужденные (при угрозе заноса возбудителя инфекции в хозяйство или появлении в хозяйстве инфекционной болезни).
Противопоказаниями против прививок служат: наличие в хозяйстве остроинфекционных болезней, а также переболевших животных (реконвалесцентов), истощенных или животных с повышенной температурой тела; неблагоприятные погодные условия;
стресс-факторы; последняя стадия беременности, первые 2 нед после родов; прививки другой вакциной.
Неспецифический нормальный глобулин содержит комплекс у- и Р-глобулинов. Стимулирующе действует на организм животных, повышая его общую устойчивость к неблагоприятным факторам
внешней среды.
Лечебные и диагностические препараты. К средствам специфической терапии относят гипериммунные сыворотки (по механизм действия делят на антитоксические, антибактериальные и противовирусные), сыворотки реконвалесцентов, иммуноглобулины, бактериофаги, антибиотики, пробиотики. Для диагностических целей в ветеринарии используют сыворотки, иммуноглобулины, аллергены, бактериофаги, антигены, моноклональные антитела.
Антибактериальные сыворотки воздействуют непосредственно на возбудителя заболевания, подавляя его жизнедеятельность. Биопромышленность нашей страны выпускает сыворотки против сибирской язвы, рожи свиней, пастереллеза и др.
Антитоксические сыворотки содержат антитела (иммуноглобулины), способные специфически связывать и нейтрализовывать токсины бактериального, растительного и животного происхождения. В ветеринарии применяют антитоксические сыворотки против анаэробной дизентерии и инфекционной энтеротоксемии овец, столбняка, ботулизма, злокачественного отека и др.
Противовирусные сыворотки высокоэффективны, особенно в начале заболевания. Биопромышленность выпускает сыворотки против болезней крупного рогатого скота (ринотрахеит, вирусная диарея и др.), собак (чума, гепатит, энтерит).
Лечебные, профилактические и диагностические гипериммунные сыворотки обычно получают от лошадей, иногда — от волов, свиней. После окончания гипериммунизации, когда в сыворотке крови животного установлено максимальное содержание специфических антител, у животного берут кровь (чаще на 7...10-й день после последнего введения антигена). Кровь сепарируют, чтобы получить нативную плазму (сыворотку), которую отстаивают и стабилизируют (консервируют), затем концентрируют, стандартизируют, стерилизуют фильтрацией и при необходимости прогревают.
После производственного контроля каждую серию сыворотки проверяют на стерильность, безвредность, специфическую активность.
На бактериальную стерильность контролируют высевами из препарата на специальные питательные среды (МПА, МПБ с глюкозой, МППБ под маслом и агар Сабуро или среду Чапека, чтобы исключить контаминацию грибковой микрофлорой).
Безвредность проверяют на лабораторных животных в соответствии с нормативной документацией по изготовлению сыворотки. Животные должны оставаться здоровыми, без заметной местной и общей реакции в течение 10 дней.
Специфическую активность определяют в реакциях биологической и серологической нейтрализации. Реакцию биологической нейтрализации ставят на восприимчивых лабораторных животных, эмбрионах птиц или культурах клеток. Для серологического тестирования применяют РН, РДП в агаровом геле, РТГА, РСК, РНГА и др. с использованием в качестве контроля заведомо известных позитивных и негативных сывороток (референс-препаратов).
Кроме того, проверяют превентивные свойства лечебных и профилактических сывороток на восприимчивых животных. Чтобы определить активность сыворотки, ее вводят животным внутрибрюшинно, подкожно или внутримышечно. Затем через 20...24 ч инъецируют подтитрованную дозу вирулентного контрольного штамма соответствующего микроорганизма. Подопытные животные должны оставаться здоровыми не менее 14 дней, контрольные— погибнуть или заболеть.
Сыворотки реконвалесцентов (противовирусные и антибактериальные) получают от животных, переболевших инфекционной болезнью без осложнений. Сыворотку рекомендуют получать и использовать в условиях одного хозяйства. Кровь от животных-доноров можно брать непосредственно в хозяйстве или на мясокомбинате во время их убоя. Сыворотки реконвалесцентов применяют при парагриппе, вирусной диарее крупного рогатого скота, сальмонеллезе, пастереллезе и т.д.
Лечебные глобулины (против болезни Ауески сельскохозяйственных животных и пушных зверей, сибирской язвы) представляют собой водный раствор у- и р-глобулинов сыворотки крови животных. Иммуноглобулины получают различными методами (риваноловым, спиртовым и путем осаждения сульфатом аммония) из гипериммунных сывороток.
Бактериофаги—вирусы, которые проникают в бактериальную клетку, размножаются в ней и лизируют ее с выходом фаговых частиц в окружающую среду. Бактериофаги способны лизировать только определенные микроорганизмы. Введенный в организм бактериофаг сохраняется в нем 5...7 дней (прием бактериофага не может заменить вакцинацию). В нашей стране выпускают бактериофаги против сальмонеллеза или колибактериоза телят, пуллороза — тифа птиц.
Для идентификации возбудителей болезней в бактериальных культурах и свежем патологическом материале биопромышленность выпускает: сибиреязвенный бактериофаг К—ВИЭВ. «Гамма—МВА», ВНИИВВиМ, лиофилизированные бактериофаги для идентификации возбудителей листериоза, стафилококковые — для типирования штаммов; бруцеллезный бактериофаг.
Диагностические сыворотки используют не только для идентификации возбудителя инфекции, но и для определения его типа и варианта. Производство диагностических сывороток строго регламентировано, что обусловливает их высокое качество и стандартность. В большинстве случаев продуцентами названных сывороток служат лабораторные животные (кролики, морские свинки), петухи и редко—лошади.
Глобулин диагностический (для диагностики бешенства в пряпом методе иммунолюминесцентной микроскопии) —это чистая у-глобулина, выделенного из высокоактивной моноспецифической антирабической сыворотки лошадей и химически вязанного с изотиоцианатом флуоресцина. А/глергены представляют собой фильтрат убитых бактериальных
леток или извлеченных из них активных фракций: туберкулин "ой очищенный (ППД) для млекопитающих, ППД для птиц, комплексный аллерген из атипичных микобактерий (КАМ); бруцетин ВИЭВ; маллеин.
Аллергическая диагностика основана на повышенной специфической чувствительности зараженного организма к определенным аллергенам — веществам бактериального происхождения, введение которых одним из методов (внутрикожно, подкожно или на слизистую оболочку глаза) больному животному, особенно в латентный период, вызывает местную реакцию.
Антигены— это вещества, способные при введении в организм вызывать в нем иммунологические реакции: синтез антител, формирование клеточной гиперчувствительности и др. Антиген реагирует с образовавшимися антителами как в живом организме, так и в пробирке.
Для серологических реакций выпускают: единый бруцеллезный антиген для РА, РСК и РДСК; бруцеллезный Розбенгал антиген; паратуберкулезный, листериозный, сапной, кампилобакте-риозный, лептоспирозный антигены и т. д.
Правила транспортировки биопрепаратов. Поскольку качество биопрепаратов снижается и даже полностью теряется при промерзании, под воздействием высокой температуры, повышенной влажности, прямого солнечного света, биопрепараты нужно как транспортировать, так и хранить в соответствующих условиях (очень важно это соблюдать по отношению к живым, особенно жидким, вакцинам).
Ветеринарные биопрепараты хранят в сухом темном помещении при температуре 2...10 °С; перевозят всеми видами транспорта в соответствии с правилами перевозки скоропортящихся грузов и багажа. При длительной транспортировке используют закрытые рефрижераторные вагоны (кузова, контейнеры), оснащенные холодильными установками или холодильными камерами при температуре от 2...5 до 8...10 °С. Для каждого препарата оборудуют отдельное место. При этом нарушение целостности упаковки и попадание влаги, а также даже однократное замораживание жидких биопрепаратов недопустимы.
Требования, предъявляемые к биологическим препаратам. Биопрепараты выпускают в ампулах и флаконах различного объема. На каждой ампуле или флаконе должны быть наклеены этикетки, содержащие следующую информацию:
наименование и местонахождение предприятия-изготовителя;
название препарата;
количество препарата с указанием активности в единицах;
состав препарата, если он поливалентный;
номер серии;
номер государственного контроля;
срок годности препарата и дата его изготовления.
В каждую упаковку вкладывают наставление по применению препарата, утвержденное Департаментом ветеринарии МСХ РФ. Все биопрепараты должны быть изготовлены в соответствии с определенными ГОСТом, ТУ и пройти обязательный государственный контроль.
Во время транспортировки и хранения препарат может испортиться, поэтому перед применением его обязательно тщательно осматривают.
Препарат непригоден для использования в следующих случаях:
отсутствует этикетка (надпись на флаконе) или не указан номер серии и (или) контроля;
отсутствует наставление по применению;
нарушена укупорка флакона, целостность флакона (ампулы, пробирки и пр.);
промерзла жидкость во флаконе (для жидких препаратов);
изменен обычный внешний вид (цвет, консистенция, запах и т.д.);
в содержимом флакона присутствуют пленки, хлопья, плесень, комочки, сгустки или осадок, не разбивающийся при встряхивании;
истек срок годности препарата.
Правила использования биопрепаратов. Перед использованием упаковки проверяют этикетку и обращают внимание на номера серии и контроля, а также внешний вид препарата. Уточняют правила его использования (по наставлению) и дозировку.
Жидкие препараты, содержащие депонирующие вещества (квасцы, ГОА, масляный адъювант и т. п.), тщательно встряхивают до получения равномерной взвеси.
При растворении сухих препаратов применяют только указанный в наставлении растворитель (разбавитель). Чаще всего это стерильная дистиллированная вода.
Живые вакцины не содержат консервантов, поэтому при их' вскрытии необходимо соблюдать правила антисептики и избегать попадания в препарат дезинфицирующих средств.
Вскрытые флаконы должны быть использованы в этот же день. Неиспользованные препараты утилизируют кипячением.
По истечении срока годности препараты бракуют или отправляют (если осталось много) на повторный контроль во ВГНИИКСС (в этом случае срок годности может быть продлен).
Биопрепараты выбраковывают комиссионно, составляют акт. Выбракованные препараты утилизируют автоклавированием или кипячением.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1 Охарактеризовать вакцины, аллергены; указать цель и способ их применения.
2. Определить пригодность биопрепаратов для использования.
Занятие 8. Общие и специальные профилактические мероприятия в хозяйствах, благополучных по инфекционным болезням животных. Индивидуальные и групповые способы иммунизации животных
Цель занятия: изучить основные принципы организации общих и специальных профилактических мероприятий.
Материалы и оборудование: эпизоотологический макет, таблицы, набор диагностикумов, вакцин и сывороток.
Место проведения занятия: аудитория кафедры эпизоотологии или хозяйство.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Профилактика представляет собой совокупность организационно-хозяйственных и специальных мероприятий, направленных на предупреждение возникновения и распространения инфекционных болезней. Профилактические мероприятия, составляющие основу противоэпизоотической системы, подразделяют на общие и специальные.
Общая профилактика. Это комплекс организационно-хозяйственных и ветеринарно-санитарных мероприятий, которые носят постоянный характер. В нее входят:
правильная общая ветеринарно-санитарная и зоогигиеническая организация животноводческих хозяйств (уход, кормление, эксплуатация животных, выращивание молодняка и т. п.);
профилактический карантин всех вновь поступающих в хозяйство животных. Карантинное помещение предварительно очищают механическим способом и дезинфицируют с обязательной лабораторной проверкой эффективности дезинфекции. В период профилактического карантина животных обрабатывают по определенной схеме.
Рекомендуемая схема обработки крупного рогатого скота в период профилактического карантина
14 День Вид обработки
1-й Прием, регистрация животных в журнале, клинический осмотр и
термометрия
2...3-й Санитарная обработка: туалет кожного покрова, расчистка копыт, обрезка рогов
5-й Взятие проб кала для гельминтологического исследования 15-й Туберкулинизация
18-й Учет и оценка результатов туберкулинизации. Взятие крови для серологического (на бруцеллез, лейкоз, лептоспироз и другие болезни) и биохимического исследований
19-й Дегельминтизация (в случае необходимости) 24-й Вакцинация против сибирской язвы 29...30-й Клинический осмотр и термометрия, санитарная обработка. Перевод животных в общее стадо
В период карантина перегруппировки животных запрещены;
диспансеризация животных — система плановых диагностических, лечебно-профилактических и хозяйственно-организационных мероприятий, направленных на выявление субклинических форм заболеваний, их профилактику и лечение.
Диспансеризацию проводят 2 раза в год: осенью — при переводе животных на стойловое содержание и весной — в конце стойлового периода.
Диспансеризация включает в себя: клиническое обследование животных, лабораторный анализ крови, молока, мочи, кормов, оценку условий кормления и содержания. Полученные при диспансеризации данные сравнивают с нормальными показателями, чтобы определить состояние здоровья поголовья. По окончании диспансеризации оформляют акт.
Специальная профилактика. Наряду с общепрофилактическими мероприятиями большое значение имеют специальные, которые направлены на предупреждение появления определенной инфекционной болезни путем создания специфического иммунитета к ней. Характер специальных профилактических мероприятий обусловлен особенностями инфекционной болезни, эпизоотической обстановкой хозяйства и окружающей территории. К специальным мероприятиям относят:
специальные диагностические исследования (например, аллергическую пробу на туберкулез, серологическую диагностику бруцеллеза, лейкоза и т. д.);
иммунопрофилактику—сознание иммунитета с помощью биологических препаратов (вакцин, сывороток, глобулинов). Самый распространенный вид специфической профилактики — активная иммунизация, которая достигается путем введения животным вакцин и анатоксинов. Поголовье иммунизируют в благополучных хозяйствах согласно плану противоэпизоотических мероприятий, чтобы защитить от конкретной инфекционной болезни, а также вынужденно в неблагополучных хозяйствах.
С профилактической целью животных прививают ранней весной до выгона на пастбище или поздней осенью; вынужденно — в любое время года.
Подготовка плановой вакцинации начинается с клинического осмотра всего поголовья (осматривают за 1 сут до обработки). Животных истощенных, находящихся в последнем периоде беременности, а также с признаками других болезней метят, в списке указывают причины, по которым они не допущены к вакцинации, и определяют характер их дальнейшей эксплуатации.
Готовят инструменты, необходимые для вакцинации, спецодежду (резиновые сапоги, халаты, фартуки, нарукавники), мыло, полотенце и т. п. Перед началом работы все инструменты стерилизуют кипячением в течение 20 мин с момента закипания воды, а после работы — 30 мин. Иглы после работы промывают, стерилизуют и высушивают.
Место и способ введения вакцины выбирают в соответствии с наставлением по ее применению. Поле инъекции обязательно депилируют и дезинфицируют.
Очень важно позаботиться о рабочем месте: создать условия для фиксации животных (станок, раскол, загон) и правильно подготовить препараты и инструменты.
Метод групповой вакцинации включает в себя энтеральную иммунизацию и аэрозольную. Последнюю особенно широко применяют на птицефабриках, а также в отдельных случаях в свиноводческих и звероводческих хозяйствах.
Энтеральная, или пероральная, иммунизация—введение вакцин с кормом или питьевой водой — существенно сокращает затраты труда. При этом методе входными воротами служат полость рта, пищевод, тонкий и толстый отделы кишечника: антиген проникает через слизистую оболочку этих участков пищеварительного тракта в иммунокомпетентные клетки организма.
В производственных условиях пероральную вакцинацию применяют против болезни Ньюкасла кур, трансмиссивного гастроэнтерита свиней и при иммунизации лисиц против бешенства.
Аэрозольная, или респираторная, иммунизация — введение вакцины в дыхательные пути в форме аэрозоля. Достоинства этого метода: удается быстро создать более напряженный, чем при других видах вакцинации, иммунитет; формируется не только общая, но и местная невосприимчивость организма к инфекции.
Аэрозольные камеры должны быть герметичными, с тем чтобы в них могла установиться нужная температура (12...15 °С) и влажность (50...90 %).
Для иммунизации живыми вакцинами используют специальные распылители —ДАГ, САГ, ТАН, ПАГ и др.
Всеми работами, связанными с аэрозольной вакцинацией, руководит ветеринарный врач. Лица, участвующие в аэрозольных обработках, надевают хлопчатобумажные комбинезоны, резиновые сапоги, колпаки; имеют при себе защитные очки, респираторы или ватно-марлевые повязки. После начала распыления вакцины и до окончания проветривания помещения входить разрешается только на короткое время, чтобы проверить правильность работы распылителя. При этом обязательно следует надевать защитные очки и респираторы.
Оформление документов на вакцинацию и наблюдение за привитыми животными. Закончив вакцинацию, оформляют документы:
акт о вакцинации (форма 4) и ведомость. Акт подписывают ветеринарные специалисты, участвующие в вакцинации, и работники фермы —зоотехник, заведующий. Акт является юридическим документом. К нему прилагают опись невакцинированных животных с указанием причины отмены иммунизации.
За привитыми животными наблюдает ветеринарный специалист и отмечает все реакции организма (местные и общие). Если после вакцинации у животных возникли осложнения, например сильная местная реакция — отек, болезненность, повышенная температура или появились случаи падежа, прежде всего принимают меры против развития осложнений, а затем о факте сообщают на предприятие-изготовитель и во Всероссийский научно-исследовательский институт контроля, стандартизации, сертификации ветеринарных препаратов (ВГНИИКСС).
Форма 4
Акт
Хозяйство _____________
_______________ района
__________ области, края
«__» __________ 200_ г.
Составлен главным ветеринарным врачом _____________________
(наименование хозяйства)
при участии ______________________________________
в том, что на ферме, отделении _____________ с «___» ________
(название, №)
по «__» _________ 200__ г. нами проведена вакцинация ________
против _____________ в количестве _______ (голов животных)
Использована вакцина __________________________________
производства _________________ биофабрики, серии__________
изготовленная «___» __________ 200__ г., № госконтроля ______,
срок годности __________ 200 __ г.
Вакцину вводили ___________ в дозе __________. Место инъекции
обрабатывали __________________.
Всего израсходовано вакцины ______ л, спирта _____ л, ваты ____ г.
Главный ветврач хозяйства ________________
Ветврач отделения (фермы) ________________
Ветфельдшер _______________
Зоотехник _____________
Зав. фермой ______________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1 Оформить акт о вакцинации.
2. Рассчитать количество вакцины, необходимое для иммунизации поголовья.
Занятие 9. Карантинные и ограничительные мероприятия в хозяйствах, неблагополучных по инфекционным болезням животных
Цель занятия: научиться правильно оценивать эпизоотическую ситуацию и в соответствии с этим определять стратегию и тактику противоэпизоотических мероприятий.
Материалы и оборудование: эпизоотологический макет, таблицы и ветеринарные документы.
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Ликвидировать инфекционную болезнь удается с помощью комплекса противоэпизоотических мероприятий, основанных на достоверном диагнозе и всестороннем эпизоотологическом обследовании. По результатам последнего составляют план ликвидации возникшей эпизоотии, включающий в себя следующие основные разделы: карантинные или ограничительные мероприятия, обеззараживание источника возбудителя инфекции, повышение общей и специфической устойчивости животных, находящихся под угрозой заражения.
Конкретный перечень оздоровительных мероприятий, назначаемых в неблагополучном хозяйстве, определен правилами (инструкциями), разработанными для каждой инфекционной болезни, и сложившейся эпизоотической обстановкой.
Мероприятия в неблагополучном пункте. Хозяйство (ферму, населенный пункт), где отмечены вспышки инфекционной болезни, объявляют неблагополучным и принимают меры по ликвидации эпизоотического очага.
При любой инфекционной болезни и развитии эпизоотического процесса необходимо изолировать источник возбудителя инфекции. С этой целью накладывают карантин или ограничения.
Карантин — это система временных мероприятий, состоящих в строгой изоляции эпизоотического очага и неблагополучного пункта. Цель карантина — предупредить распространение инфекционной болезни за пределы первичного очага.
В хозяйствах, где введен карантин, запрещено перегруппировывать животных без согласования с ветеринарными специалистами; ввозить и вывозить животных, восприимчивых к данной болезни; заготовлять и вывозить продукты и сырье животного происхождения, концентрированные и грубые корма; проезжать через эпизоотический очаг (неблагополучный пункт), устраивать ярмарки, базары.
Чтобы установить границы карантинной территории, учитывают характер возбудителя, способы его выделения из организма и механизмы передачи, восприимчивость животных, природные условия. В первую очередь необходимо правильно определить границы эпизоотического очага. Чем больше территория очага, численность сконцентрированных на ней животных и других объектов, тем сложнее выполнить весь комплекс необходимых мероприятий. Определяя границы карантинной территории, следует стремиться к их сужению. Однако если в границы эпизоотического очага не будут включены объекты, где находится источник возбудителя инфекции и действуют механизмы его передачи, то сохранится угроза дальнейшего развития эпизоотии и ветеринарно-санитарные мероприятия окажутся неэффективными.
Перечень болезней, при которых накладывают карантин, определен ветеринарным законодательством. При некоторых особо опасных инфекциях вокруг объекта карантина устанавливают угрожаемую зону, которая определяется территориальной близостью к эпизоотическому очагу и наличием с ним хозяйственно-экономических связей, с учетом степени и широты распространения болезни.
Глава администрации района по представлению соответствующих документов главным ветеринарным врачом района принимает решение об установлении и снятии карантина специальным постановлением (с последующим уведомлением вышестоящих ветеринарных органов) (формы 5, 6).
Одновременно ветеринарная служба разрабатывает, а руководство предприятий утверждает план оздоровительных мероприятий (формы 7, 8), основанных на положениях инструкции с учетом эпизоотической ситуации хозяйства. В графе «Ответственный» указывают только административно-ответственных лиц — руководителя и главных специалистов хозяйства. Назначение исполнителей и лиц, ответственных за исполнение, обеспечивает эффективность всей работы.
Постановление главы администрации и утвержденный план мероприятий по ликвидации возникшей инфекционной болезни высылают в адрес руководителя хозяйства, начальника управления сельского хозяйства и главного ветеринарного врача района.
Ответственность за соблюдение карантинных правил несут руководители хозяйств и органы местной власти, ответственность за своевременное выполнение специальных мероприятий — ветеринарные специалисты, обслуживающие хозяйства, и главные ветеринарные врачи районов.
Карантин снимают после полной ликвидации инфекционной болезни с учетом длительности инкубационного периода заболевания, после заключительных ветеринарно-санитарных мероприятий.
При некоторых особо опасных инфекционных болезнях (ящур, африканская чума свиней и др.) после снятия карантина в хозяйстве на определенный срок вводят ограничения, в частности, в отношении использования продуктов животноводства, помещений, навоза, пастбищ и т.д.
Ограничения накладывают в эпизоотическом очаге и неблагополучном пункте при инфекционных болезнях, не имеющих тенденции к широкому распространению. Порядок введения и снятия ограничений такой же, как и при карантине, оздоровительные мероприятия назначают согласно действующим инструкциям.
Чтобы установить характер течения болезни, предупредить ее дальнейшее развитие и выявить скрыто больных животных, в эпизоотическом очаге и неблагополучном пункте прибегают к тщательному клиническому обследованию всех животных, восприимчивых к данной болезни. Одновременно при необходимости определенное число животных исследуют и другими методами (например, серологическим). По результатам исследований животных разделяют на три группы:
явно больные;
подозрительные по заболеванию с неясными симптомами болезни или повышенной температурой тела;
подозреваемые в заражении, клинически здоровые, но восприимчивые к данной инфекции и содержавшиеся вместе с больными животными.
Группу явно больных животных немедленно изолируют от общего стада, лечат или отправляют на вынужденный убой (уничтожают).
Животных, подозрительных по заболеванию, так же как и явно больных, немедленно изолируют, ежедневно исследуют клинически, уточняют диагноз и лечат, если лечение эффективно или не запрещено.
Чтобы предупредить распространение болезни, животных, подозреваемых в заражении инфекцией, против которой разработана специфическая профилактика, иммунизируют вначале пассивно, а впоследствии активно. В случае заболеваний, против которых средства иммунизации не разработаны, за животными устанавливают постоянное ветеринарное наблюдение с диагностическими исследованиями.
Мероприятия в угрожаемой зоне. Местные органы власти, руководители хозяйств, ветеринарные специалисты принимают меры против возникновения заболевания среди животных. Эти меры включают в себя: охрану хозяйств от заноса возбудителя болезни, прекращение хозяйственных связей с неблагополучным пунктом, учет и иммунизацию всех животных, восприимчивых к данной болезни, ветеринарно-санитарный надзор за вывозом животных, продуктов и сырья животного происхождения, более строгое выполнение общих профилактических и санитарных мероприятий.
Форма 5
Проект решения об установлении карантина (ограничений)
Администрация района____________________
Решение № _____________________ 200_ г.
Об установлении карантина (ограничений) и cf мерах по ликвидации ——————
(название болезни) Заслушав информацию главного ветеринарного врача района———————————
и рассмотрев материалы о появлении « ——» ———————— 200—г.
.______________________ на (в)————————————————————
(название болезни)
администрация в соответствии с Законом РФ «О ветеринарии» и инструкцией «О
мерах профилактики и ликвидации ——————————————————————————
(название болезни)
_________________________ от ____ № ____ постановила:
1.
2.
3.
4.
И т. д.
Глава администрации района _________________
Секретарь ___________________________——
Форма 6
Проект решения о снятии карантина (ограничений)
с населенного пункта ______________________
Администрация района ____________________
Решение № ______________________ 200__ г.
Заслушав информацию главного ветеринарного врача района ___________
и рассмотрев материалы проведенных противоэпизоотических мероприятий по
ликвидации ______________________________——————————
——————————————————————————————————————————————————~~———————————————————-—— э
в соответствии с действующей инструкцией постановил:
1.
2.
3.
Глава администрации района _________________
Секретарь ____________________________
Форма 7
Согласован Утвержден
Главный врач Санэпиднадзора Руководитель предприятия
Подпись_______Дата_______ Подпись________Дата________
Календарный план
мероприятий по ликвидации
Подписи членов комиссии:
Форма 8
Согласован с гл. ветврачом района Утвержден администрацией района
План ветеринарно-профилактических и противоэпизоотических мероприятий по ____________________ на 200 _г.
________________(наименование хозяйства)_________________
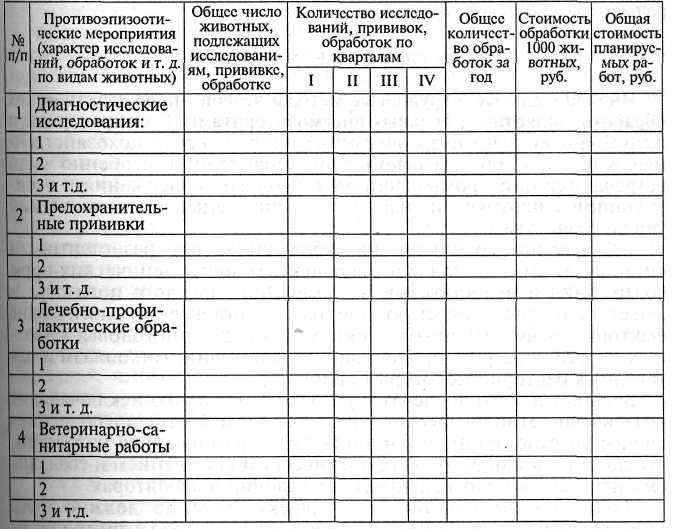
План обсужден и утвержден на совете (правлении, дирекции и т. д.) хозяйства Дата.__________________ Подписи_____________
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. На эпизоотологическом макете определить место нахождения эпизоотического очага, неблагополучного пункта, угрожаемой зоны.
2. Составить план оздоровительных и профилактических мероприятий.
3. Написать проект постановления о наложении карантина при возникновении ящура.
Занятие 10. Комплексный метод лечения инфекционно-больных животных с использованием специфических биопрепаратов
Цель занятия: изучить различные схемы лечения животных при массовых алиментарных и респираторных инфекционных болезнях.
Материалы и оборудование: аппараты для получения аэрозолей лекарственных средств (САГ, ДАГ), антибиотики, специфические сыворотки, шприцы, стерилизаторы.
Место проведения занятия: хозяйство, неблагополучное по алиментарным и респираторным болезням молодняка.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Индивидуальные и групповые методы лечебно-профилактических обработок животных, больных пневмоэнтеритами. Респираторные и желудочно-кишечные заболевания молодняка сельскохозяйственных животных, так называемые пневмоэнтериты, особенно часто встречаются при промышленной технологии содержания и эксплуатации животных и наносят значительный экономический ущерб хозяйствам.
Заболевание возникает на фоне снижения резистентности организма, что обусловлено нарушением зоогигиенических норм содержания и недостатками в кормлении взрослого поголовья и имеет полиэтиологическую природу. Основные этиологические факторы пневмоэнтеритов—циркуляция среди поголовья животных вируса парагриппа, аденовируса, хламидий, микоплазм и патогенных бактерий некоторых видов.
Больных животных лечат в условиях, не только исключающих воздействие этиологического фактора, но и обеспечивающих активное участие организма в ликвидации развившейся патологии, что достигается прежде всего диетическим кормлением и созданием оптимальных зоогигиенических условий в изоляторах.
Чтобы обеспечить нужный эффект, лечение должно быть комплексным и системным, т. е. включать в себя этиотропную, патогенетическую, симптоматическую терапию: применяют антибактериальные средства, а также препараты, повышающие иммунобиологическую резистентность организма, регулирующие нервную трофику, устраняющие кислородную недостаточность, сни-маюшиб интоксикацию, корректирующие расстройства кислотно-щелочного и водно-солевого обмена, улучшающие деятельность сердечно-сосудистой системы и желудочно-кишечного тракта.
Чтобы нормализовать функцию пищеварения, назначают водно-голодную диету: из рациона при первых признаках заболевания исключают молозиво, заменяя его водно-солевыми растворами чаем, настоями лечебных трав (зверобоя, березовых листьев, тысячелистника).
Чтобы подавить жизнедеятельность возбудителя болезни, новорожденным телятам в качестве этиотропных средств прописывают антибактериальные препараты широкого спектра действия. Применение иммуномодуляторов (нуклеинат натрия, метилурацил, пентоксил и др.) значительно повышает эффективность комплексной терапии. При индивидуальном лечении больных с желудочно-кишечными инфекциями эффективны также бактериофаги.
Большое значение, особенно при респираторных болезнях, имеют также групповые методы лечения и профилактики, прежде всего аэрозольные обработки.
Животных обрабатывают аэрозолями в камерах, специально оборудованных боксах, помещениях или непосредственно на фермах. Необходимые требования ко всем помещениям, предназначенным для аэрозольных обработок, — герметичность и наличие приточно-вытяжной вентиляции. Объем воздуха для телят должен составлять l...l,5 м3, овец и свиней — 0,3...0,8 м3 на голову. В производственных помещениях лучше распылять растворы препаратов с помощью струйного аэрозольного генератора (САГ). Генераторы подвешивают на высоте 1,2...1,3 м от пола, на расстоянии 10 м друг от друга. Число генераторов для конкретного помещения определяют из ориентировочного расчета: один САГ на-120м2 площади пола.
Метод групповой аэрозольной химиотерапии применяют после установления диагноза.
В животноводческих комплексах, неблагополучных по пневмо-энтеритам, при лечении большого количества больного молодняка (телят, ягнят, поросят) хорошие результаты дает применение аэрозолей специфических средств (гипериммунных сывороток и сывороток реконвалесцентов) совместно с антибиотиками и антисептиками широкого спектра действия. Далее приведены некоторые схемы лечения респираторных болезней телят. -
Схема 1. Бициллин-3 внутримышечно по 20 тыс. ЕД/кг массы тела трехкратно с интервалом 3 дня.
Ингаляция аэрозолей сыворотки крови реконвалесцентов (2 мл/м3) в сочетании с норсульфазолом натрия (0,3 г/м3) трехкратно с интервалом 24 ч (утром).
Ингаляция аэрозолей йодида алюминия 1 раз в сутки в течение 5 дней (вечером).
Схема 2. Бициллин-3 внутримышечно по 20 тыс. ЕД/кг массы трехкратно с интервалом 3 дня.
Ингаляция аэрозолей норсульфазола натрия (0,2 г/м3) и окситет-рациклина (500 тыс. ЕД/м3) 1 раз в сутки в течение 4 дней (утром).
Ингаляция аэрозолей хлорида йода (0,5 мл/м3) 1 раз в сутки в течение 6 дней (вечером).
Схема 3. Ингаляция аэрозолей сыворотки реконвалесцентов (2 мл/м3) в сочетании с норсульфазолом натрия (0,3 г/м3) трехкратно с интервалом 48 ч (утром).
Ингаляция аэрозолей молочной кислоты 1 раз в сутки (0,5 мл/м3) в течение 6 дней (вечером).
Обеспечение безопасности сотрудников и охрана окружающей среды при групповых обработках животных. Чтобы предотвратить нежелательное влияние ингаляционных аэрозолей на организм людей и окружающую среду, соблюдают следующие меры предосторожности:
к работе по аэрозольной обработке животных допускают только лиц, снабженных спецодеждой и прошедших специальный инструктаж;
ветеринарные специалисты строго контролируют все работы по подготовке и проведению аэрозольных обработок животных;
во время распыления антибактериальных препаратов строго запрещено присутствие в помещении обслуживающего персонала;
в конце работы помещение обрабатывают 4%-м раствором пер-манганата калия аэрозольным методом (30...50 мл/м3, экспозиция 10...15 мин), затем тщательно очищают и дезинфицируют.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Решить эпизоотологическую задачу.
На ферме 450 коров, родильное отделение, профилакторий с изолированными секциями. В одной из секций у телят возник ко-либактериоз. Диагноз подтвержден бактериологическими исследованиями. Разработать мероприятия по лечению телят и ликвидации заболевания на ферме.
Занятие 11. Устройство и функционирование ветеринарно-санитарных объектов в животноводческих хозяйствах
Цель занятия: изучить устройство и работу ветеринарно-санитарных пропускников, дезбарьеров в животноводческих хозяйствах.
Материалы и оборудование: санпропускник, дезбарьеры въездной и входной, изолятор, карантинные помещения.
Место проведения занятия: хозяйство.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Ветеринарно-санитарный пропускник—это группа сблокированных помещений, в которую входят:
санитарный блок с общей проходной, гардеробом для верхней одежды, туалетом, раздельными помещениями для женщин и мужчин (в которых предусмотрены шкафчики для личной одежды), душевой (из расчета 1 кабина на 5 человек). При входе в санитарный блок со стороны «чистой» и «грязной» зон оборудованы санитарные кюветы с ковриками, обильно заправленными дезинфицирующим раствором;
блок для обработки белья, оборудованный огневыми паровоздушными пароформалиновыми камерами (ОППК), ваннами с дезраствором для замачивания спецодежды или стационарными пароформалиновыми камерами;
блок служебных помещений, который состоит из комнат для заведующего комплексом, бригадиров ферм, ветеринарного персонала, столовой и комнаты отдыха;
дезинфекционный блок для обработки транспорта, размещенный в отапливаемом помещении, соединенном с санблоком. В дезблоке оборудуют углубленную ванну, которую заполняют дезраствором. Длина ванны «по зеркалу» не менее 9 м, ширина З...4м в зависимости от габаритных размеров автомашин, используемых в данном хозяйстве. Глубина слоя дезраствора не менее 25 см. По днищу ванны продольно уложены трубы отопления, чтобы поддерживать в холодное время года температуру дезраствора в необходимых пределах. Для дезобработки кузовов автомашин (в необходимых случаях) в дезблоке предусмотрены специальная емкость с рабочим раствором дезсредства и гидропульты.
На фермах с внешним грузооборотом менее 20т/сут вместо дезблока для обработки транспорта можно оборудовать въездной дезбарьер (под навесом с воротами) с подогревом.
Санпропускник, либо сблокированный с производственным зданием, либо построенный отдельно, может выполнять функцию социально-гигиенического объекта.
По обе стороны каждого животноводческого помещения устанавливают дезванны длиной 1,5 м, шириной, на 20 см превышающей ширину двери, глубиной не менее 20 см (для дезинфекции и обмывания обуви).
Дезбарьеры (рис. 4), ванны, дезковрики заправляют растворами и периодически дезинфицируют дороги с помощью автодезуста-новок.
Рис. 4. Схемы
дезбарьеров:
А — входного; Б—
въездного
 сновные
животноводческие объекты ветеринарного
и ветеринарно-санитарного назначения
представлены в таблице 2.
сновные
животноводческие объекты ветеринарного
и ветеринарно-санитарного назначения
представлены в таблице 2.
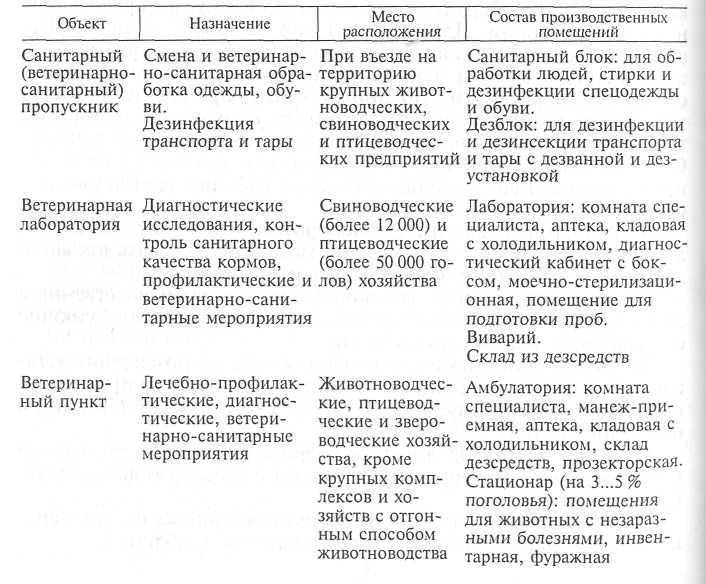
Продолжение

Продолжение

ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Разработать проект ветеринарно-санитарного пропускника для молочного комплекса на 800 дойных коров.
Занятие12. Ветеринарно-санитарная обработка транспортных средств
Цель занятия: изучить технологию обеззараживания железнодорожных вагонов и других транспортных средств после перевозки в них животных и сырья животного происхождения.
Материалы и оборудование: установка ЛСД, ДУК, ручные опрыскиватели, средства личной профилактики.
Место проведения занятия: промывочные пункты (ПП), дезопромывочные пункты (ДПП) или дезопромывочные станции (ДПС).
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Обеззараживание железнодорожных вагонов. Вагоны после перевозки в них животных, продуктов и сырья животного происхождения подлежат обязательной санитарной обработке: их очищают, промывают горячей водой и в некоторых случаях дезинфицируют.
Для санитарной обработки вагонов на сети железных дорог МПС организованы промывочные пункты, дезинфекционно-про-мывочные пункты и дезинфекционно-промывочные станции (рис. 5), на которых оборудованы ветеринарно-санитарные пропускники, помещение для приготовления рабочих растворов, площадки для обработки вагонов, биотермического обеззараживания или печи для сжигания навоза, дезкамеры для обеззараживания спецодежды, соответствующая сеть канализации и сооружения для очистки и обеззараживания сточных вод.
Рис. 5. Примерный план-схема дезопромывочной станции (ДПС):
7—административное здание; 2—депо; 3— контрольный резервуар; 4— биофильтр; 5— приемный резервуар; 6— отстойник; 7—дезинфекторская; 8— ограждения; 5 — платформа второй категории; 10— железнодорожные пути; 11—котельная; 12— автомобильные дороги; 13—площадка первой категории; 14— платформа первой категории; 15— площадка второй категории
По первой категории обрабатывают вагоны после перевозки клинически здоровых животных, в том числе птиц, из благополучных пунктов; мяса, сырья боенского происхождения или сырья небоенского происхождения, но исследованного на сибирскую язву.
Вагоны тщательно очищают от навоза, мусора, остатков груза и промывают горячей водой (70...80 °С) под давлением 0,б.-.1,0 МПа до тех пор, пока стекающая жидкость не станет прозрачной.
По второй категории обрабатывают вагоны после перевозки в них животных, среди которых в пути следования или при выгрузке были обнаружены инфекционно-больные или трупы (за исключением случаев, указанных для вагонов третьей категории), а также сырья животного происхождения, загрязненного возбудителями инфекционных болезней, кроме спорообразующих микроорганизмов.
Вагоны очищают, промывают и тщательно дезинфицируют таким образом, чтобы каждая точка поверхности орошалась дезраствором не менее 4...5 раз.
По третьей категории обрабатывают вагоны после перевозки животных, среди которых в пути следования обнаружены больные сибирской язвой, эмкаром, сапом, столбняком, эпизоотическим лимфангитом, брадзотом, орнитозом птиц, подозреваемые в перечисленных заболеваниях или павшие от этих болезней, сырья небоенского происхождения и др.
В этом случае вагоны обрабатывают только на ДПС, оборудованных специальной системой очистных сооружений с термическим обеззараживанием сточных вод и печью для сжигания навоза и мусора.
В дезинфекционной практике все большее признание получает аэрозольный метод обработки.
Подготовка вагонов к дезинфекции аэрозолями такая же, как и при дезинфекции растворами. Дезинфицирующим раствором обрабатывают вагон однократно в дозе не более 100 мл на 1 м3 вагона с помощью генератора ТАН.
Обеззараживание вагонов-рефрижераторов. При обработке по первой категории из рефрижераторов удаляют остатки льда, соли, опилок и мусора, промывают вагоны горячей водой под давлением и затем дезинфицируют, так как обработка горячей водой, температура которой у стены вагона снижается до 40...50 °С, не очищает поверхности от плесневых грибов.
При обработке по второй категории рефрижераторы дезинфицируют однократно одним из следующих дезсредств:
гипохлором или раствором гипохлорита кальция, содержащими 3 % активного хлора;
2%-м раствором формальдегида при расходе не менее 0,5 л/м2 и экспозиции 1 ч;
5%-м (по ДВ) раствором глутарового альдегида при расходе О 75 л/м2 и экспозиции 1 ч;
препаратом Глак в 0,2%-й концентрации при расходе 0,5 л/м2 и экспозиции 3 ч.
По окончании обеззараживания рефрижераторы промывают горячей водой и просушивают.
Изотермические вагоны, в которых обнаружили мясо или другие грузы, пораженные плесенью, а также испорченные остатки мясных продуктов, после очистки и промывки дезинфицируют гипохлором или раствором гипохлорита кальция, содержащими 5 % активного хлора, или 4%-м глутаровым альдегидом из расчета 1л/м2. Через 1 ч после дезинфекции вагоны вторично промывают горячей водой и просушивают.
Рефрижераторы, в которых после обработки остался рыбный или другой посторонний запах, дезодорируют, промывая горячей водой с кальцинированной содой или другими моющими средствами, и орошают гипохлором или раствором гипохлорита кальция, содержащими 5 % активного хлора, из расчета 1 л/м2 площади. Раствор наносят двукратно с интервалом 30 мин. После второго нанесения двери плотно закрывают на 1 ч, затем все "обработанные поверхности промывают горячей водой и вагон просушивают.
Обеззараживание автомобильного транспорта. Автомашины после выгрузки животных, а также шкур, костей и другого сырья, перевозимого без упаковки, очищают и дезинфицируют 2%-м раствором формальдегида, 2%-м горячим раствором гидроксида натрия, гипохлором, растворами хлорной извести, гипохлорита натрия, содержащими 2 % активного хлора. В случае перевозки объектов, инфицированных высококонтагиозными, особенно вирусными, возбудителями, автомобили дезинфицируют в помещениях: сарае, пустом складе, гараже или под полиэтиленовой пленкой. Используют генераторы ДАГ, САГ или насадки ПВАН, ТАН. Во время дезинфекции двери машины должны быть открытыми, температура воздуха не ниже 10 °С, относительная влажность 60...80 %. Лучше всего применять формалин из расчета 20 мл/м3 воздуха.
Обеззараживание самолетов. Самолеты дезинфицируют после перевозки в них инфекционно-больных животных или сырья животного происхождения, доставленного из мест, неблагополучных по инфекционным болезням, а также после перевозки животных, зараженных паразитами, или инвазированного сырья животного происхождения. В обоих случаях наиболее пригодны растворы метилбромида (бромметана) и формальдегида в аэрозольном состоянии.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Описать дезинфекцию железнодорожных вагонов по первой, второй и третьей категориям; дезинфекцию автомобильного транспорта.
Занятие 13. Дезинфекция животноводческих объектов
Цель занятия: ознакомиться с требованиями, предъявляемыми к дезинфицирующим средствам, изучить устройство аэрозольных генераторов и машин, применяемых для дезинфекции.
Материалы и оборудование: стенд с химическими дезинфектантами; САГ-1, ДАГ-2, ПАГ, ЦАГ.
Место проведения занятия: аудитория кафедры эпизоотологии (первая часть занятия — по изучению дезсредств); городская ветеринарно-санитарная станция или дезопромывочный пункт (вторая часть занятия—по изучению дезинфекционной техники).
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Химические дезинфицирующие средства (фенолсодержащие препараты и альдегиды). Выбор средств и метода обеззараживания (влажный или аэрозольный) зависит как от вида предстоящей дезинфекции (профилактическая, текущая, заключительная), так и от материалов, из которых построено помещение. Некоторые материалы сами вступают в химическое взаимодействие с дезинфицирующими средствами, уменьшая тем самым обеззараживающую способность последних, поэтому норма расходования дезинфицирующих средств колеблется: например, для полного орошения бревенчатых, дощатых, бутовых или кирпичных поверхностей расход дезинфектанта составит 1 л/м2; приспособленных, саманных, земляных, глинобитных—2 л/м2, а поверхностей, покрытых масляными красками, — только 0,5 л/м2.
Химическое дезинфицирующее средство должно удовлетворять следующим требованиям:
обладать достаточной бактерицидностью — надежно обеззараживать разнообразные объекты без их порчи;
не иметь стойкого неприятного запаха;
хорошо растворяться в воде или давать с ней стойкие эмульсии;
проявлять дезинфицирующее действие в любой среде;
быть дешевым и транспортабельным.
Из группы фенолов для дезинфекции применяют серно-карболовую смесь, креолин, нафтализол, ксилонафт-5, феносмолин, фенолят натрия, оксидифенолят натрия.
Серно-карболовую смесь готовят из неочищенной карболовой и серной кислот. Используют 3...10%-е водные растворы.
Креолин — маслянистая жидкость темно-коричневого цвета;
применяют в виде горячей (60...70°С) 5%-й водной эмульсии при
неспоровых инфекциях для обеззараживания скотных дворов, птичников и предметов ухода за животными.
Нафтализол — раствор трикреозола в нафтеновом мыле. Для дезинфекции применяют 3...10%-е горячие водные растворы, для дезинсекции — 5...10%-е.
Ксилонафт-5 представляет собой маслообразную жидкость темно-коричневого цвета. Для профилактической дезинфекции используют горячую 2...3%-ю эмульсию ксилонафта, для текущей и заключительной — 5%-ю.
феносмолин — смесь фенольной смолы и 20%-го водного раствора гидроксида натрия в соотношении 1:1. При смешивании получают пастообразную массу, которая с водой дает светло-коричневую стойкую эмульсию, содержащую до 60 % ДВ. Применяемая для дезинфекции 8%-я эмульсия не пачкает животноводческих конструкций и не вызывает коррозии металла, за исключением алюминия.
фенолят натрия — один из отходов фенольного производства, представляет собой жидкость темно-коричневого цвета, дающую с водой стойкую эмульсию молочного цвета. В состав входит фенолят натрия — не менее 46 %, свободная щелочь — до 20 %. Применяют для профилактической, текущей и заключительной дезинфекции животноводческих объектов в виде 4...5%-й водной эмульсии при экспозиции 3 ч.
Оксидифенолят натрия (препарат Ф-5) — белый порошок, хорошо растворимый в воде. Раствор Ф-5 не придает специфического запаха мясопродуктам и может быть использован при высоких и низких температурах окружающего воздуха. Применяют при побелке загрязненных плесенью холодильников, сушилок и складов, предназначенных для хранения мясопродуктов. Для приготовления побелочной смеси к 2...3 %-му раствору оксидифенолята натрия добавляют мел или известь до получения массы без комков.
Формальдегид — бесцветный газ с резким запахом, сильно раздражающим слизистые оболочки глаз и дыхательных путей, хорошо растворим в воде. 40%-й водный раствор формальдегида называется формалином. Формальдегид для дезинфекции применяют в водных растворах и в газообразном состоянии. Для орошения животноводческих помещений используют следующие растворы:
при вирусном заражении 1...2%-й, вегетативных формах бактерий 2...3%-й, споровых формах 5%-й (во всех случаях экспозиция 3 ч). Газообразный формальдегид чаще используют для обеззараживания спецодежды и обуви в параформалиновых камерах и на птицефабриках для дезинфекции инкубационных яиц, возвратной тары.
Смеси формальдегида применяют, когда раствор одного формальдегида не действует губительно на микроорганизмы, например, находящиеся под слоем навоза. Установлено, что раствор, содержащий 2 % формальдегида и 1 % гидроксида натрия, оказывает бактерицидное действие на возбудителя трихофитии; раствор, содержащий 3 % формальдегида и 3 % гидроксида натрия, — на возбудителя туберкулеза.
Глутаровый альдегид (группа диальдегидов) — жидкость коричневого цвета со слабым запахом, содержит около 20 % ДВ. Для дезинфекции применяют: при вегетативных формах бактерий и туберкулезе 1%-й раствор, для уничтожения споровых форм 2%-й.
Окись этилена (ОЭ), или этиленоксид, — бесцветная летучая жидкость с резким запахом. Газ ОЭ в смеси с воздухом легко воспламеняется, характеризуется хорошей бактерицидной и инсекти-цидной активностью. В связи с высокой огне- и взрывоопасностью ОЭ применяют в смеси с бромметаном.
Бромметан (БМ) — бесцветная жидкость со слабым эфирным запахом. БМ стабилен при хранении (выпускают в стальных баллонах), не изменяется под воздействием света, влаги и тепла. БМ — один из основных инсектицидов, используемых для фумигации грузов на карантинных пунктах и уничтожения вредителей продовольственных товаров.
Смесь ОКЭБМ представляет собой стойкую однородную жидкость. Газ ОКЭБМ при смешивании с воздухом в любых соотношениях неогнеопасен, не портит кожаные и меховые изделия, ткани, сырье растительного и животного происхождения, полированные и окрашенные поверхности; характеризуется высокой проникающей способностью. Ввиду большого удельного веса ОКЭБМ рекомендуют для обеззараживания глубоких слоев почвы сибиреязвенных скотомогильников: газ нагнетают под пленку покрытой почвы. ОКЭБМ—сильнодействующий яд, поэтому при работе с ним необходимо надевать противогазы.
Озон, получаемый на озонотронах различных систем, широко применяют для дезинфекции инкубационных яиц. Лучшие результаты дает влажная дезинфекция: инкубационные яйца орошают в потоке жидкости, подогретой до 40...45 °С, насыщенной озоном до концентрации З...5мг/л. Озон служит также хорошим средством обеззараживания сточных вод животноводческих помещений.
В ветеринарии большое внимание уделяют применению различных химических и биологических препаратов в состоянии аэрозолей. Условия успешной аэрозольной дезинфекции: герметичность помещений, температура среды не ниже 10°С, относительная влажность в пределах 60...80 %.
Аэрозоли сильнодействующих ядовитых препаратов можно применять для одновременной дезинфекции воздуха и поверхностей в помещениях; аэрозоли слабоядовитых препаратов, но с хорошей бактерицидной активностью — для дезинфекции воздуха помещений в присутствии животных.
Механизмы и аппараты, применяемые для дезинфекции. Ветеринарно-санитарную технику по характеру выполняемых работ делят на 4 группы: специализированные дезинфекционные машины; аппараты для орошения кожного покрова животных; генераторы и комплекты аэрозольные; дезинфекционные камеры.
Специализированные дезинфекционные машины — это ветеринарно-дезинфекционная машина ВДМ-2, автомобильно-дезинфекционный агрегат АД-Ф-20-1, автомобильно-дезинфекционная установка АДУ, автодезустановка ДУК, дезинфекционная установка ЛСД, установка дезинфекционная передвижная УДП-М, установка дезинфекционная самоходная ДУС, дезинфекционная передвижная очистительно-моющая машина ОМ-22614 и ОМ-22613.
Аппараты для обработки кожного покрова животных включают в себя: штангу разборную распылительную ШРР, опрыскиватель сборный автоматический ОСА-2, устройство для опрыскивания животных УОЖ-2, станок для обработки хряков и свиноматок СОХ-Ф-1.
В ветеринарной практике используют такие аэрозольные генераторы, как струйный аэрозольный генератор (САГ), дисковый аэрозольный генератор (ДАГ), пневматический аэрозольный генератор (ПАГ), АГ-УД-2, а также специальные форсунки с распылителями трех типов и аэрозольные комплекты ПАК-1 и ПАК-2.
Дезинфекционные камеры применяют для обеззараживания сырья животного происхождения (шерсти, щетины, мехового сырья), спецодежды, обуви, постельных принадлежностей, различных шерстяных, суконных, ватных, кожаных изделий, мягкого инвентаря и в некоторых других случаях.
Для камерной дезинфекции используют: огневые паровоздушные пароформалиновые камеры—стационарную ОППК-1 и передвижную ОП ПК-2, смонтированную на автоприцепе ГАЗ-704, камеру дезинфекционную КС-3, камеру дезинфекционную паро-формалиновую ВФС-2/1,3, камеру дезинфекционную ВФС-3/1,8., электрокамеру дезинфекционную ВФЭ-2/0,9 и автопередвижные камеры автономного действия ДА-2 и ДА-3 с собственным котлом-парообразователем.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Приготовить серно-карболовую смесь, побелочную смесь с оксидифенолятом натрия.
Занятие 14. Щелочи и кислоты, используемые для дезинфекции
Цель занятия: изучить физико-химические и бактерицидные свойства щелочей и кислот, освоить приготовление дезинфицирующих растворов, научиться определять процентное содержание гидроксида натрия в дезрастворе.
Материалы и оборудование: градуированные пипетки на 10 мл, химические стаканы, колбы на 250...500 мл, цилиндры на 500...1000 мл, бюретки со стеклянным краником, глазные пипетки; реактивы: исследуемый раствор гидроксида натрия; 0,5 н. раствор соляной кислоты; 0,1%-й раствор метилоранжа, фенолфталеин, исследуемый пикель, 0,1 н. раствор гидроксида натрия, формалин. Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Щелочи. Это группа хорошо растворимых в воде оснований, создающих в водном растворе большую концентрацию гидроксильных ионов. К дезинфицирующим веществам из щелочей относят гидроксид натрия, гидроксид калия, негашеную известь, соду, поташ, золу, мыло.
Щелочи омыляют жиры, денатурируют белки до образования альбуминатов, разрушают углеводы, тем самым нарушая нормальную жизнедеятельность живой клетки и приводя к ее гибели.
Гидроксид натрия — бесцветное, очень гигроскопичное кристаллическое вещество, хорошо растворимое в воде. В продажу гидроксид натрия поступает в виде натрового щелока, который содержит не менее 42 % NaOH, или в твердом виде с содержанием 92...95 % NaOH. Растворы готовят непосредственно перед применением, используют для дезинфекции подогретыми до 70...80°С:
2...3%-е—при вирусных инфекциях, 4...6%-е—при бактериальных инфекциях, 1%-й—для обеззараживания кожного покрова животных, больных (переболевших) ящуром или другими вирусными заболеваниями.
Гидроксид калия представляет собой бесцветное твердое непрозрачное кристаллическое вещество. Для дезинфекции препарат используют в тех же концентрациях, что и гидроксид натрия.
Гидроксид кальция, или гашеная известь, — рыхлый белый порошок, плохо растворимый в воде. Первоначально получаемая негашеная известь приобретает бактерицидность только после гашения водой. Если для гашения расходуют 70...100% воды к массе извести, то получают гашеную известь в виде белого рыхлого порошка. При увеличении количества воды получают известковую взвесь. Взвеси гашеной извести применяют для побелки различных объектов.
Каспос, или каустифицированная содопоташная смесь, — жидкость желтоватого цвета без запаха, содержащая 40...42 % гидроксида натрия или калия. Для дезинфекции помещений применяют растворы, концентрация которых в 1,5 раза превышает концентрацию растворов гидроксида натрия.
Ниртан — порошок желтоватого цвета со слабым специфическим запахом. Препарат не корродирует металлы, малотоксичен, что позволяет применять его на комплексах в присутствии животных. Ниртан с успехом используют для дезинфекции транспортных средств, спецодежды, а также обработки кожного покрова животных и сосков коров после доения.
Кальцинированная сода — мелкий кристаллический порошок белого цвета, хорошо растворимый в воде. Этот дешевый препарат с успехом используют для отмывания жирных поверхностей на мясокомбинатах, молочных, кожевенно-сырьевых заводах и шерстеперерабатывающих фабриках. В растворах кальцинированной соды можно кипятить в течение 1,5...2 ч белье, халаты, металлические и другие предметы, обсемененные споровыми возбудителями.
Кислоты. Для дезинфекции применяют серную, соляную, щавелевую, молочную, уксусную кислоты.
Серную кислоту используют для приготовления серно-карболовой смеси (1 : 3). Техническую серную кислоту добавляют к раствору хлорной извести до 5 %, чтобы усилить бактерицидное действие на споровые формы возбудителей. 5%-ми растворами серной кислоты обеззараживают полы в помещениях для животных, кормушки, навоз.
Соляная кислота — водный раствор хлористого водорода; техническая соляная кислота — прозрачная жидкость желтоватого цвета, которую смешивают с водой в любых соотношениях. Применяют для дезинфекции сибиреязвенного кожсырья методом пикелевания (на 100л воды добавляют 2,5кг соляной кислоты и 10 кг поваренной соли).
Щавелевую кислоту — бесцветное кристаллическое вещество — применяют в виде аэрозолей и водных растворов, которые наносят на поверхность дезинфицируемых объектов (помещений, кишечного сырья) при ящуре и других вирусных болезнях.
Молочная кислота — сиропообразная жидкость коричневого цвета, состоящая из 75 % молочной кислоты и 15 % ангидрида этой же кислоты. Применяют для дезинфекции животноводческих помещений, зараженных вегетативными формами микроорганизмов. Помещения можно дезинфицировать аэрозольным методом в присутствии животных, особенно при респираторных болезнях: 5 мг молочной кислоты и 10 мг глицерина на 1 м3 каждые З...4ч.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Определить процентное содержание гидроксида натрия в дезинфицирующем растворе.
Градуированной пипеткой вносят в стаканчик 10мл исследуемого раствора гидроксида натрия, затем добавляют 2...3 капли 0,1%-го водного раствора метилоранжа и из бюретки титруют 0,5 н. раствором соляной кислоты. Первоначальное желтое окрашивание раствора должно перейти в розовое.
Расчет. Процентное содержание щелочи рассчитывают следующим образом:
а-0,02- 100/10,
где а—количество миллилитров соляной кислоты, пошедшее на титрование;
0,02 — поправка; 100 — пересчет в проценты; 10 — количество исследуемого раствора щелочи, мл.
2. Приготовить 3%-й щелочной раствор формальдегида.
В 60л воды растворяют 3 кг гидроксида натрия.
Количество формальдегида в формалине определяют заранее или берут пара-форм, содержащий не менее 95 % формальдегида. Если в формалине содержится 40 % формальдегида, то для приготовления раствора, содержащего 3 % формальдегида. необходимо
100-3/40 =7,6 л.
Доливают воду до 100л.
3. Определить процентное содержание соляной кислоты в пикеле.
В химический стакан наливают 10мл пикеля, добавляют 1...2 капли 1%-го раствора фенолфталеина. Содержимое стакана титруют 0,1 н. раствором гидроксида натрия до появления розового окрашивания, не исчезающего в течение 30с.
Расчет. Допустим, что для нейтрализации взятых 10 мл пикеля израсходовано 69мл 0,1 н. раствора щелочи. Содержание щелочи в каждом миллилитре 0,1 н. раствора эквивалентно 0,00365 г соляной кислоты. Значит, в 10 мл пикеля содержится 0,00365 • 69 = 0,25185 г соляной кислоты, а в 1 мл — в 10 раз меньше: 0,25185/10 = 0,025185 г. Умножая подсчитанное количество соляной кислоты в 1 мл на 100, получаем процентное содержание соляной кислоты в исследуемом пикеле (0,025185 : 100 = 2,5 %).
Занятие 15. Хлорсодержащие препараты и окислители, используемые для дезинфекции
Цель занятия: изучить химические и физические свойства хлорсодержащих препаратов и окислителей; научиться определять процентное содержание активного хлора в хлорной извести.
Материалы и оборудование: хлорная известь, весы с разновесами, колбы, бюретки, лабораторные пробирки, ступки с пестиками, мерный цилиндр на 0,5...! л, банка с притертой пробкой, пипетки на 5 и 10мл, колбы плоскодонные на 250мл (с бусинами и без), глазные пипетки, реактивы: 5%-й раствор йодида калия, химически чистая соляная кислота и разведенная в соотношении 1 :5; 0,01 и 0,1 н. растворы тиосульфата натрия, 1%-й раствор крахмала; кристаллический йодид калия; кристаллический тиосульфат натрия.
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Хлорная известь — белый порошок с резким запахом хлора, плохо растворимый в воде. Хлорную известь часто используют для дезинфекции животноводческих помещений, их оборудования, прилегающих территорий, а также обеззараживания сточных и питьевых вод. Применяют в трех видах: сухом, в виде хлорно-известковой взвеси и осветленных растворов. Дезинфицирующая способность хлорной извести зависит от процентного содержания активного хлора. В технической хлорной извести активный хлор обычно составляет 30...38 %. Техническая известь на открытом воздухе разлагается, вступая во взаимодействие с влагой и углекислым газом. Стандартная хлорная известь должна содержать не менее 25 % активного хлора. Хлорная известь, в которой меньше 15 % активного хлора, для дезинфекции непригодна, ее используют для побелки животноводческих помещений. Объекты, зараженные вегетативными формами бактерий, дезинфицируют растворами, содержащими 2 % активного хлора, с экспозицией 30...60 мин. При заражении споровой микрофлорой наилучшее дезинфицирующее действие оказывают смеси: в раствор, содержащий 5 % активного хлора, добавляют 2,5 или 5 % серной кислоты. В этих смесях споры сибирской язвы погибают в течение 5...10 мин. Добавление сульфата, нитрата или хлорида аммония в О 5 %-й концентрации по отношению к содержанию активного хлора значительно повышает спороцидность растворов хлорной извести.
Так как хлорная известь обесцвечивает ткани, вызывает коррозию металлов, раздражает дыхательные пути, глаза, кожу, поверхность зубов, при работе с ней необходимо соблюдать меры предосторожности. Сотрудников обязательно обеспечивают резиновыми сапогами, перчатками и противогазами.
Гипохлорит кальция — кристаллический порошок желтоватого цвета, содержащий до 90 % активного хлора, хорошо растворимый в воде; характеризуется сильными окисляющими свойствами. Для дезинфекции помещений при споровой микрофлоре используют растворы, содержащие 8 % активного хлора и активатор — сульфат аммония, а при неспорообразующих микроорганизмах—растворы, содержащие 3...4 % активного хлора.
Хлорамин Б, широко применяемый в практике дезинфекции, представляет собой желтоватый мелкокристаллический порошок со слабым запахом хлора, содержит 25.-.29 % активного хлора, что обусловливает его высокую бактерицидность. При правильном хранении потери активного хлора не превышают 0,1 % в год. Водные растворы хлорамина устойчивее аналогичных растворов хлорной извести.
Раствор хлорамина не обесцвечивает ткани и не портит предметы, при однократной обработке не вызывает коррозию металлических предметов. Для уничтожения вегетативных форм бактерий в помещениях используют 0.5...1 %-е растворы, споровых форм—5...10%-е.
Гчпохлор представляет собой бесцветную или слегка зеленоватую жидкость со слабым запахом хлора, смешивающуюся с водой в любых соотношениях. Раствор не содержит осадка, по коррозивным свойствам в 10...15 раз слабее раствора хлорной извести. Для его приготовления через 7%-й раствор гидроксида натрия или калия пропускают газообразный хлор.
Чтобы уничтожить спорообразующие бактерии, применяют раствор, содержащий 5 % активного хлора, для инактивации вегетативных форм — содержащий 2...2,5 % активного хлора.
Двутретиосновная соль гипохлорита кальция (ДТОСГК) — белый сухой кристаллический порошок. ДТОСГК первого сорта содержит 57 % активного хлора, второго сорта —52 %. Для инактивации вегетативных форм бактерий применяют осветленные растворы с содержанием 2...2,5% активного хлора, споровых форм—с 5% активного хлора.
Дихлоризоцианурат натрия и трихлоризоциануровая кислота представляют собой порошки желтоватого цвета, которые содержат соответственно около 70 и 90 % активного хлора. Эти препараты в основном применяют на мясомолочных предприятиях для повседневной профилактической дезинфекции в виде растворов с содержанием 0,5...! % активного хлора.
Хлорид йода—жидкость оранжево-желтого цвета со специфическим резким запахом, растворяется в воде в любых соотношениях. Характеризуется сильно выраженными окислительными свойствами. Препарат пригоден для уничтожения плесени в холодильниках, на мясокомбинатах, а также лечения больных трихофитией, микроспорией.
Перманганат калия оказывает дезодорирующее и обеззараживающее действие, сильный окислитель. 0,1...0,5%-е растворы применяют для дезинфекции рук, 2...4 %-е — столов, мясных прилавков на рынках и мясоконтрольных станциях, тары из-под кишечного сырья.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
