
- •Вопрос 1. Термодинамические параметры. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •Вопрос 2. Закон Гесса – основной закон термохимии. Следствия из закона Гесса.
- •1 Следствие.
- •Вопрос 4. Энергия Гиббса. Уравнение Гельмгольца-Гиббса: энтальпийный и энтропийный факторы. Критерии самопроизвольного протекания химического процесса.
- •Вопрос 5. Скорость химической реакции. Кинетическое уравнение. Факторы, определяющие скорость химической реакции
- •4) Природа реагентов
- •5) Площадь соприкосновения твердого вещества Вопрос 6. Химическое равновесие. Константа равновесия. Принцип Ле Шателье, примеры.
- •Вопрос 7. Растворы: разбавленные, концентрированные, насыщенные, ненасыщенные, перенасыщенные. Способы выражения концентрации растворов. Эквивалент. Закон эквивалентов.
- •Вопрос 8. Свойства растворов неэлектролитов. Давление пара над растворами. Закон Рауля. Температуры кипения и замерзания растворов. Осмотическое давление
- •Вопрос 10. Растворы слабых электролитов. Константа диссоциации. Ступенчатый характер электролитической диссоциации. Смещение ионных равновесий в растворах слабых кислот и оснований.
- •Вопрос 11. Ионное произведение воды. Водородный и гидроксильный показатели. Буферные растворы: их состав, расчет ph
- •Вопрос 12. Электролитическая диссоциация комплексных соединений в растворах. Константы образования и нестойкости. Разрушение комплексных соединений
- •Вопрос 13. Гидролиз солей. Основные типы гидролиза. Обратимый гидролиз. Необратимый гидролиз
- •Вопрос 14. Количественные характеристики гидролиза солей (степень гидролиза, константа гидролиза). Вывод формул констант гидролиза, примеры. Влияние различных факторов на степень гидролиза солей.
- •Вопрос 15. Равновесие между раствором и осадком малорастворимого электролита. Константа растворимости Ksp. Условия растворения и образования осадков
- •Вопрос 16. Основные положения квантовой механики: корпускулярно-волновой дуализм, уравнение Шредингера, принцип неопределенности Гейзенберга.
- •Вопрос 22. Природа связи в комплексных соединениях по методу вс. Геометрия комплексных ионов. Магнитные свойства.
- •Вопрос 23. Химическая связь в комплексных соединениях. Понятие о теории кристаллического поля. Параметр расщепления. Спектрохимический ряд лигандов
- •Вопрос 24. Основные типы геометрических форм молекул. Использование теории гибридизации для прогнозирования геометрической формы молекулы.
- •28 Вопрос. Межмолекулярные взаимодействия: ориентационное, индукционное, дисперсионное и их природа. Энергия межмолекулярного взаимодействия
- •29 Вопрос. Окислители и восстановители, часто применяемые в химической практике. Влияние pH, температуры, концентрации реагентов и их природы на протекание овр.
- •Вопрос 30. Электродные потенциалы металлов. Факторы, определяющие положение металла в активности металлов. Уравнение Нернста.
- •31 Вопрос. Общая характеристика p-элементов VII группы. Получение галогенов, их свойства. Соединения галогенов с водородом. Вопрос 32. Галогены. Методы получения, химические свойства простых веществ.
- •Вопрос 36. Кислород. Методы получения, физические свойства. Химические свойства кислорода. Соединения (оксиды, пероксиды, надпероксиды). Получение, свойства.
- •Вопрос 37. Пероксид водорода. Получение и химические свойства. Пероксикислоты и их соли (строение, получение, свойства).
- •Вопрос 38. Соединения серы с водородом и кислородом (получение и свойства). Тиосульфат натрия (строение, получение, свойства).
- •I. Сульфид водорода (сероводород) h2s и сульфиды
- •Вопрос 40. Серная кислота. Методы получения. Химические свойства
- •Вопрос 43. Общая характеристика элементов V группы. Строение атомов. Степени окисления. Отношение простых веществ к кислотам.
- •Вопрос 45. Соединения азота с водородом: аммиак, гидразин, гидроксиламин, азотоводородная кислота. Кислотно-основные и окислительно-восстановительные свойства.
- •1. Аммиак
- •2 . Гидразин
- •3. Гидроксиламин
- •Вопрос 48. Соединения фосфора с металлами, водородом, кислородом, галогенами (получение и химические свойства)
- •1. Соединения фосфора с металлами
- •2. Соединения фосфора с водородом
- •3. Галогениды фосфора
- •Вопрос 49. Соединения мышьяка, сурьмы, висмута (оксиды, гидроксиды, галогениды, сульфиды). Получение и свойства этих соединений
- •Вопрос 50. Галогениды азота, фосфора, мышьяка, сурьмы, висмута. Получение. Характер связи элемент-галоген. Гидролиз галогенидов. Галогениды азота
- •Вопрос 51. Оксиды p-элементов группы IV. Изменения кислотно-основных и окислительно-восстановительных свойств в зависимости от природы элемента.
- •Вопрос 52. Углерод. Аллотропия, типы гибридизации. Оксиды углерода. Угольная кислота и ее соли.
- •Вопрос 53. Кремний. Степени окисления. Свойства кремния. Диоксид кремния. Кремниевые кислоты и их соли
- •Вопрос 54. Олово и свинец. Их химическая активность. Гидроксиды, галогениды, сульфиды этих элементов. Свинцовый сурик
- •Вопрос 55. Хром. Строение атома, степени окисления. Оксиды, гидроксиды, соли, комплексные соединения.
- •Вопрос 56. Марганец. Строение атома, степени окисления. Оксиды, гидроксиды, соли. Перманганат калия
- •Вопрос 57. Железо, кобальт, никель. Строение атомов, степени окисления. Их отношение к кислотам. Оксиды, гидроксиды, соли, комплексные соединения этих элементов
- •Вопрос 58. Общая характеристика d-элементов группы I (медь, серебро, золото). Их степени окисления. Химические свойства металлов. Оксиды, гидроксиды, соли этих металлов
- •Вопрос 59. Общая характеристика d-элементов II группы. Их оксиды, гидроксиды, соли, комплексные соединения. Химические свойства этих соединений
Вопрос 8. Свойства растворов неэлектролитов. Давление пара над растворами. Закон Рауля. Температуры кипения и замерзания растворов. Осмотическое давление
Для описания системы очень важна ее модель. Основная модель для описания свойств растворов – идеальный раствор.
Идеальным
называют раствор, при образовании
которого отсутствуют тепловые и
объемные эффекты
|
В дальнейшем необходимо иметь в виду, что ВСЕ законы, описывающие свойства растворов, относятся к разбавленным растворам.
Давление пара растворов. Закон Рауля.
Если в замкнутую систему влить раствор, то с течением времени в ней устанавливается равновесие между числом молекул растворителя, образующих пар, и числом молекул, возвращающихся в раствор. Экспериментальные данные показывают, что давление насыщенного пара над растворителем po (то есть над чистым раствором) выше давления насыщенного пара растворителя в растворе p, то есть po > p.
Связь между этими величинами устанавливается первым законом Рауля
Первый
закон Рауля.
Давление насыщенного пара над раствором
равно произведению давления насыщенного
пара над растворителем и мольной доли
растворителя
|
Мольная
доля растворителя в двухкомпонентном
растворе будет равна
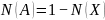 Исходя
из этого соотношения можно преобразовать
уравнение
Исходя
из этого соотношения можно преобразовать
уравнение
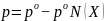 .
Откуда
.
Откуда
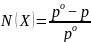 .
Отсюда вытекает вторая формулировка
закона
.
Отсюда вытекает вторая формулировка
закона
Вторая формулировка закона Рауля. Относительное понижение давления пара над раствором равно мольной доле растворенного вещества (для двухкомпонентного раствора) |
Температура кипения и замерзания растворов
Растворы кипят при более высоких температурах по сравнению с растворителем. Это следует из рассмотренного выше закона Рауля (и формулки любимой nRT=pV). Ведь жидкость закипает тогда, когда давление ее насыщенного пара становится равным внешнему давлению.
Величина повышения температуры кипения растворов определяется эбулиоскопическим законом.
Эбулиоскопический
закон.
Повышение температуры кипения раствора
пропорционально моляльной концентрации
растворенного вещества
|
Замерзают растворы при более низких температурах, чем растворители. Условие кристаллизации – давление насыщенного пара над раствором должно быть равно давлению пара над твердым растворителем. Явление понижения температуры замерзания растворов описывается криоскопическим законом
Криоскопический
закон.
Понижение температуры замерзания
вещества пропорционально мольной
доле растворенного вещества
|
Второй закон Рауля. Повышение температуры кипения и понижение температуры замерзания растворов пропорциональны числу растворенных частиц и не зависят от природы растворенного вещества |
Осмотическое
давление
Минимальное
давление, достаточное для прекращения
осмоса, называется осмотическим. Оно
не зависит от природы растворенного
вещества и пропорционально молярной
концентрации вещества и температуре
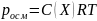 Заметим,
что это уравнение совпадает с уравнением
состояния идеального газа, ведь
Заметим,
что это уравнение совпадает с уравнением
состояния идеального газа, ведь
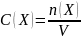
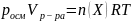 Отсюда
вытекает закон Вант-Гоффа:
Отсюда
вытекает закон Вант-Гоффа:
Закон Вант-Гоффа. Осмотическое давление равно давлению, которое оказывало бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора |
Вопрос 9. Растворы сильных электролитов. Понятие об активности ионов, коэффициенте активности, ионной силе раствора. Электролиты – это вещества, образующие в растворах и расплавах ионы. К электролитам относятся соли, кислоты и основания.
Механизм образования ионов в растворах кислот, оснований и солей различен. Молекулы кислот и оснований не содержат ионов, их строение молекулярно. Их образованиe – ионизация – происходит при растворении в результате взаимодействия с молекулами воды. Соли – ионные соединения. В растворе они диссоциируют на ионы
Сильные электролиты в растворе полностью ионизированы HCl = H+ + Cl- К сильным электролитам относятся практически все соли, известно очень малое количество солей, являющихся слабыми электролитами: HgCl2, Fe(SCN)3 и некоторые другие. В отличие от солей, среди кислот и оснований могут быть как слабые, так и сильные электролиты. Большинство кислот и оснований – слабые электролиты.
Метод расчета концентраций ионов в растворах определяется природой электролита (сильный он или слабый). Для выражения концентрации в растворах используют аналитическую концентрацию ионов либо активность ионов. Аналитическая концентрация ионов, C(иона) – расчетная величина, показывает количество иона в 1л раствора (моль/л) Активность (эффективная концентрация) ионов, a(иона) – (моль/л). При расчетах аналитических концентраций ионов не учитывается взаимодействие ионов в растворе. Однако в реальных условиях наблюдается взаимодействие ионов между собой. В результате взаимодействий образуются новые ионные пары, ионные ассоциаты, а реальная концентрация ионов в растворе уменьшается по сравнению с их аналитической концентрацией. Эту реальную концентрацию и называют активностью ионов или эффективной концентрацией
Расчеты активности ионов
При расчетах ВАЖНО ПОМНИТЬ, что в разбавленных растворах a(ионов) ≈ с(ионов ), поэтому при работе с разбавленными растворами эффективную концентрацию ионов не рассчитываем! Однако с увеличением концентрации ионов в растворе различие между аналитической и эффективной концентрациями возрастает, поэтому, если есть намек на активность (например, дан коэффициент , о котором мы поговорим далее – используем активность ионов) |
Соотношение
между активностью и аналитической
концентрацией ионов определяется
выражением
 где
где
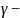 коэффициент активности данного иона
коэффициент активности данного иона
Коэффициент активности учитывает межионное взаимодействие в растворе. Его значения не превышают 1: ≤ 1 В сильно разбавленных растворах близок к 1 и, следовательно, a(ионов) ≈ с(ионов )
Для
его вычисления используют другую
величину – ионную
силу раствора
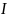 .
Ионная сила учитывает концентрацию
ионов и их заряд и рассчитывается по
формуле
.
Ионная сила учитывает концентрацию
ионов и их заряд и рассчитывается по
формуле
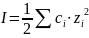 где
где
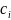 – аналитическая молярная концентрация
i-ного
иона, моль/л
z
– формальный заряд i-ого
иона
Расчет ионной силы производится
с учетом всех ионов, находящихся в
растворе.
– аналитическая молярная концентрация
i-ного
иона, моль/л
z
– формальный заряд i-ого
иона
Расчет ионной силы производится
с учетом всех ионов, находящихся в
растворе.
Для
расчета коэффициента активности в
достаточно разбавленных растворах (
< 0,05 моль/л) используется предельный
закон Дебая-Хюккеля
в вот такой форме:
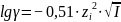 .
Для
более концентрированных растворов (
≥
0,05 моль/л) в формуле появляется знаменатель:
.
Для
более концентрированных растворов (
≥
0,05 моль/л) в формуле появляется знаменатель:

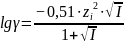

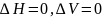 Легко
заметить, что в идеальном растворе
частицы не взаимодействуют между
собой. В реальных же растворах это
условие не соблюдается. Чтобы приблизить
свойства реальных растворов к идеальным,
исследуют разбавленные растворы.
Наиболее
близки к идеальным растворам очень
разбавленные растворы неэлектролитов,
например, раствор бензола в n-гексане
Легко
заметить, что в идеальном растворе
частицы не взаимодействуют между
собой. В реальных же растворах это
условие не соблюдается. Чтобы приблизить
свойства реальных растворов к идеальным,
исследуют разбавленные растворы.
Наиболее
близки к идеальным растворам очень
разбавленные растворы неэлектролитов,
например, раствор бензола в n-гексане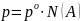 *мольная
доля растворителя обозначается не
как мольная доля вещества
*мольная
доля растворителя обозначается не
как мольная доля вещества
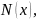 а как
а как
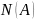
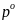 – давление насыщенного пара над
растворителем [А]
– давление насыщенного пара над
растворителем [А]
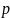 – давление насыщенного пара над
раствором [А]
– мольная доля растворителя
– давление насыщенного пара над
раствором [А]
– мольная доля растворителя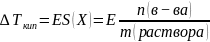 где:
где:
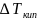 -
повышение температуры кипения раствора
по сравнению с растворителем, K
S(X)
– моляльная концентрация растворенного
вещества, моль/кг
E
– эбулиоскопическая постоянная
растворителя
-
повышение температуры кипения раствора
по сравнению с растворителем, K
S(X)
– моляльная концентрация растворенного
вещества, моль/кг
E
– эбулиоскопическая постоянная
растворителя

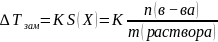 Величина
K,
как и эбулиоскопическая постоянная
определяется исключительно природой
растворителя
Величина
K,
как и эбулиоскопическая постоянная
определяется исключительно природой
растворителя