
- •Вопрос 1. Термодинамические параметры. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •Вопрос 2. Закон Гесса – основной закон термохимии. Следствия из закона Гесса.
- •1 Следствие.
- •Вопрос 4. Энергия Гиббса. Уравнение Гельмгольца-Гиббса: энтальпийный и энтропийный факторы. Критерии самопроизвольного протекания химического процесса.
- •Вопрос 5. Скорость химической реакции. Кинетическое уравнение. Факторы, определяющие скорость химической реакции
- •4) Природа реагентов
- •5) Площадь соприкосновения твердого вещества Вопрос 6. Химическое равновесие. Константа равновесия. Принцип Ле Шателье, примеры.
- •Вопрос 7. Растворы: разбавленные, концентрированные, насыщенные, ненасыщенные, перенасыщенные. Способы выражения концентрации растворов. Эквивалент. Закон эквивалентов.
- •Вопрос 8. Свойства растворов неэлектролитов. Давление пара над растворами. Закон Рауля. Температуры кипения и замерзания растворов. Осмотическое давление
- •Вопрос 10. Растворы слабых электролитов. Константа диссоциации. Ступенчатый характер электролитической диссоциации. Смещение ионных равновесий в растворах слабых кислот и оснований.
- •Вопрос 11. Ионное произведение воды. Водородный и гидроксильный показатели. Буферные растворы: их состав, расчет ph
- •Вопрос 12. Электролитическая диссоциация комплексных соединений в растворах. Константы образования и нестойкости. Разрушение комплексных соединений
- •Вопрос 13. Гидролиз солей. Основные типы гидролиза. Обратимый гидролиз. Необратимый гидролиз
- •Вопрос 14. Количественные характеристики гидролиза солей (степень гидролиза, константа гидролиза). Вывод формул констант гидролиза, примеры. Влияние различных факторов на степень гидролиза солей.
- •Вопрос 15. Равновесие между раствором и осадком малорастворимого электролита. Константа растворимости Ksp. Условия растворения и образования осадков
- •Вопрос 16. Основные положения квантовой механики: корпускулярно-волновой дуализм, уравнение Шредингера, принцип неопределенности Гейзенберга.
- •Вопрос 22. Природа связи в комплексных соединениях по методу вс. Геометрия комплексных ионов. Магнитные свойства.
- •Вопрос 23. Химическая связь в комплексных соединениях. Понятие о теории кристаллического поля. Параметр расщепления. Спектрохимический ряд лигандов
- •Вопрос 24. Основные типы геометрических форм молекул. Использование теории гибридизации для прогнозирования геометрической формы молекулы.
- •28 Вопрос. Межмолекулярные взаимодействия: ориентационное, индукционное, дисперсионное и их природа. Энергия межмолекулярного взаимодействия
- •29 Вопрос. Окислители и восстановители, часто применяемые в химической практике. Влияние pH, температуры, концентрации реагентов и их природы на протекание овр.
- •Вопрос 30. Электродные потенциалы металлов. Факторы, определяющие положение металла в активности металлов. Уравнение Нернста.
- •31 Вопрос. Общая характеристика p-элементов VII группы. Получение галогенов, их свойства. Соединения галогенов с водородом. Вопрос 32. Галогены. Методы получения, химические свойства простых веществ.
- •Вопрос 36. Кислород. Методы получения, физические свойства. Химические свойства кислорода. Соединения (оксиды, пероксиды, надпероксиды). Получение, свойства.
- •Вопрос 37. Пероксид водорода. Получение и химические свойства. Пероксикислоты и их соли (строение, получение, свойства).
- •Вопрос 38. Соединения серы с водородом и кислородом (получение и свойства). Тиосульфат натрия (строение, получение, свойства).
- •I. Сульфид водорода (сероводород) h2s и сульфиды
- •Вопрос 40. Серная кислота. Методы получения. Химические свойства
- •Вопрос 43. Общая характеристика элементов V группы. Строение атомов. Степени окисления. Отношение простых веществ к кислотам.
- •Вопрос 45. Соединения азота с водородом: аммиак, гидразин, гидроксиламин, азотоводородная кислота. Кислотно-основные и окислительно-восстановительные свойства.
- •1. Аммиак
- •2 . Гидразин
- •3. Гидроксиламин
- •Вопрос 48. Соединения фосфора с металлами, водородом, кислородом, галогенами (получение и химические свойства)
- •1. Соединения фосфора с металлами
- •2. Соединения фосфора с водородом
- •3. Галогениды фосфора
- •Вопрос 49. Соединения мышьяка, сурьмы, висмута (оксиды, гидроксиды, галогениды, сульфиды). Получение и свойства этих соединений
- •Вопрос 50. Галогениды азота, фосфора, мышьяка, сурьмы, висмута. Получение. Характер связи элемент-галоген. Гидролиз галогенидов. Галогениды азота
- •Вопрос 51. Оксиды p-элементов группы IV. Изменения кислотно-основных и окислительно-восстановительных свойств в зависимости от природы элемента.
- •Вопрос 52. Углерод. Аллотропия, типы гибридизации. Оксиды углерода. Угольная кислота и ее соли.
- •Вопрос 53. Кремний. Степени окисления. Свойства кремния. Диоксид кремния. Кремниевые кислоты и их соли
- •Вопрос 54. Олово и свинец. Их химическая активность. Гидроксиды, галогениды, сульфиды этих элементов. Свинцовый сурик
- •Вопрос 55. Хром. Строение атома, степени окисления. Оксиды, гидроксиды, соли, комплексные соединения.
- •Вопрос 56. Марганец. Строение атома, степени окисления. Оксиды, гидроксиды, соли. Перманганат калия
- •Вопрос 57. Железо, кобальт, никель. Строение атомов, степени окисления. Их отношение к кислотам. Оксиды, гидроксиды, соли, комплексные соединения этих элементов
- •Вопрос 58. Общая характеристика d-элементов группы I (медь, серебро, золото). Их степени окисления. Химические свойства металлов. Оксиды, гидроксиды, соли этих металлов
- •Вопрос 59. Общая характеристика d-элементов II группы. Их оксиды, гидроксиды, соли, комплексные соединения. Химические свойства этих соединений
Вопрос 37. Пероксид водорода. Получение и химические свойства. Пероксикислоты и их соли (строение, получение, свойства).
Получение пероксида водорода
Пероксид водорода H2O2 в промышленности получают электролизом серной кислоты и последующим гидролизом образовавшейся пероксисерной кислоты 2H2SO4 =электролиз H2S2O8 + H2 H2S2O8 + 2H2O = 2H2SO4 + H2O2
В лаборатории пероксид водорода можно получить гидролизом пероксида натрия Na2O2 + H2O ↔ 2NaOH + H2O2
Химические свойства пероксида водорода
Пероксид водорода реагирует с основаниями с образованием пероксидов 2LiOH + H2O2 ↔ Li2O2 + 2H2O
Пероксид водорода проявляется окислительно-восстановительную двойственность, вследствие малой прочности связи О-О для него более характерны окислительные свойства, однако с сильными окислителями он проявляется и свойства восстановителя
Свойства восстановителя (только с сильными окислителями KMnO4, Сl2, HClOn, Ag2O и тд) |
O2 + 2H+ в нейтральной и кислой среде |
O2 + 2H2O в щелочной среде |
|
Свойства окислителя (преимущественно) |
2OH- в щелочной и нейтральной среде |
2H2O в кислой среде |
При хранении пероксид водорода постепенно разлагается 2H2O2 =медленно 2H2O + O2 Процесс идет быстро при добавлении катализатора (Pt, MnO2, NaOH)
Пероксикислоты и их соли
Строение
Пероксикислоты – это кислоты, содержащие в своем составе группу –O-O-H. Разберем их на примере пероксикислот серы: H2SO5 – пероксимоносерная кислота и H2S2O8 – пероксидисерная кислота
Получение
В промышленности пероксидисерную кислоту получают электролизом серной концентрированной кислоты. На аноде протекает реакция 2HSO4- - 2e- = H2S2O8
Соли пероксидисульфаты получают электролизом концентрированных растворов гидросульфатов калия и аммония.
Пероксимоносерную кислоту можно получить при обработке пероксидисерной кислоты пероксидом водорода H2S2O8 + H2O2 = 2H2SO5
Химические свойства
Гидролизуются с образованием H2O2 H2S2O8 + 2H2O = 2H2SO4 + H2O2
Пероксисерные
кислоты и пероксидисульфаты – сильные
окислители за счет легко разрываемой
пероксогруппы O-O.
При ее разрыве образуется обычный
сульфат-анион
S2O8
+2e-
= 2SO42-
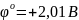
В отличие от пероксида водорода восстановительные свойства для пероксикислот и их солей не характерны
Вопрос 38. Соединения серы с водородом и кислородом (получение и свойства). Тиосульфат натрия (строение, получение, свойства).
I. Сульфид водорода (сероводород) h2s и сульфиды
Физические свойства сероводорода
• В обычных условиях газ с неприятным резким запахом «тухлых яиц» • Ядовит • Без цвета • Имеет угловое строение • Водный раствор сероводорода – двухосновная сероводородная кислота, слабый электролит Ka,1 = 1,1*10-7, Ka,2 = 1*10-14
Сила кислот возрастает в ряду H2S (pKa = 6,89) H2Se (pKa = 3,89) H2Te (pKa = 2,6). При этом все кислоты остаются слабыми! Восстановительные свойства увеличиваются в ряду H2S – H2Se – H2Te Стабильность соединений уменьшается |
Получение сероводорода и сульфидов
Сероводород можно получить прямым взаимодействием серы с водородом при нагревании H2 + S =t H2S
Или в лаборатории в аппарате Киппа FeS + 2HCl = H2S + FeCl2
Сульфиды можно получить непосредственно реакцией простых вещества C + 2S =t CS2 2Al + 3S =t Al2S3
Пропуская сероводород через концентрированные растворы щелочей H2S + 2KOH = K2S + 2H2O или через концентрированные растворы таких солей как например соли Cu2+, Cd2+ (а еще и школьного курса Pb2+, Hg2+, Sn2+, Ag+). Через растворы других солей нельзя, так как H2S – слабая кислота, более сильную кислоту не вытеснит. Эти сульфиды – исключение, так как они очень малорастворимы.
Химические свойства сероводорода
H2S – сильный восстановитель
Сгорает с образованием серы при недостатке кислорода 2H2S + O2(нед) = 2H2O + 2S или с образованием сернистого газа при избытке кислорода 2H2S + 3O2(изб) = 2H2O + 2SO2
В растворах в зависимости от силы окислителя окисляется до свободной серы или сульфат-иона 5H2S + 2KMnO4 + 3H2SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl Селеноводород и теллуроводород – до ст.ок. +4 при сильном окислителе и до свободных веществ при слабом
Сероводород проявляет все свойства, характерные для слабых кислот. При избытке сероводородной кислоты образуются, как правило, кислые соли
Подобно оксидам, сульфиды можно разделить на основные (ионные), амфортерные и кислотные (ковалентные).
В сульфидах щелочных, щелочноземельных металлов и аммония связь преимущественно ионная, такие сульфиды имеют основный характер. В водных растворах они сильно гидролизованы Na2S + H2O ↔ NaHS + NaOH Ряд сульфидов (Al2S3, Cr2S3) не существует в водном растворе. Такие сульфиды гидролизуются необратимо Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
Ковалентные сульфиды, образованные неметаллами, и сульфиды, образованные некоторыми амфотерными металлами проявляют кислотные свойства и относятся к тиоангидридами. При взаимодействии с основными сульфидами они образуют тиосоли CS2 + Na2S = Na2CS3 Sb2S5 + 3K2S = 2K3SbS4 При подкислении тиосолей свободные тиокислоты не выделяются, так как разлагаются уже в момент получения (кроме тритиокарбонатов, с ними выделяется слабая тиоугольная кислота H2CS3, медленно разлагающаяся при стоянии) 4K3SbS4 + 12HCl = 6H2S + 12KCl + 2Sb2S5 2K3AsS3 + 6HCl = As2S3 + 3H2S + 6KCl K2CS3 + 2HCl = H2CS3 + 2KCl
Растворимые сульфиды щелочных металлов сильные восстановители. Окисляются до свободной серы либо сульфата S2- S0 или SO42- При взаимодействии с концентрированной серной или азотной кислотами все сульфиды растворяются вследствие ОВР ЭS + 8HNO3 = ЭSO4 + 8NO2
Сульфиды металлов проявляют свойства солей в зависимости от их растворимости
Отношение сульфидов к соляной кислоте также зависит от растворимости. Так, например, почти нерастворимый CuS вообще не взаимодействует с HCl, CdS взаимодействует только с концентрированной HCl, а MgS и MnS растворяются даже в разбавленной. |
Тиосульфат натрия
Строение тиосульфата

Получение тиосульфата
Тиосульфат получают окислением дисульфидов щелочных металлов кислородом воздуха 2Na2S2 + 3O2 = 2Na2S2O3 или окисление сульфита серой при кипячении Na2SO3 + S = Na2S2O3
Химические свойства
При подкислении раствора тиосульфата натрия выделяется неустойчивая тиосерная кислота, которая легко разлагается Na2S2O3 + 2HCl = 2NaCl + H2O + S + SO2
S2O32- SO42- + S Тиосульфат натрия – сильный восстановитель. Как правило, в реакциях с ним образуется сера или сульфат-ионы Na2S2O3 + Br2 (нед) + H2O = S + 2NaBr + H2SO4 (тут просто рвется связь S=S) Na2S2O3 + 4Br2 (изб) + 5H2O = 2H2SO4 + 2NaBr + 6HBr (тут вдобавок окисляется S)
Иначе протекает реакция со слабыми окислителями (I2, NO2-, SCl2 и др) 2Na2S2O3 + I2 = 2NaI + Na2S4O6 дитиосульфат натрия Грубо говоря, тиосульфат димеризуется
Тиосульфат образует устойчивые растворимые комплексные соединения серебра AgBr + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaBr
Вопрос 39. Соединения серы, селена, теллура со степенью окисления +4 (оксиды, гидроксиды, соли). Получение, кислотно-основные, окислительно-восстановительные свойства соединений.
Физические свойства
Диоксид серы SO2 – бесцветный газ с резким запахом, хорошо растворяется в воде Диоксиды теллура TeO2 и селена SeO2 – кристаллические вещества В ряду SO2, SeO2, TeO2 кислотные свойства уменьшаются
Сила кислот уменьшается в ряду H2SO3 (Ka = 2*10-2) H2SeO3 (Ka = 2*10-3) H2TeO3 (Ka = 3*10-4) (Теллуристая кислота амфотерна) Окислительные свойства увеличиваются в ряду SO2 SeO2 TeO2. Теллур в +6 перевести ОЧЕНЬ сложно (царская водочка в помощь) |
Получение
Диоксид серы можно получить сжиганием серы S + O2 =t SO2 при обжиге сульфидов 2ZnS + 3O2 = 2ZnO + 2SO2 В лаборатории SO2 можно получить при действии на сульфиты кислотами Na2SO3 + H2SO4 = Na2SO4 + H2O + SO2 или сжиганием сероводорода в избытке кислорода 2H2S + 3O2 = 2SO2 + 2H2O
В отличие от диоксида серы, диоксиды селена и теллура можно получить не только сжиганием на воздухе простых веществ, но и окислением их азотной кислотой, так как образующиеся H2SeO3 и H2TeO3 сами сильные окислители и не обладают такой сильной восстановительной активностью, как H2SO3 в степень +6 селен и теллур не уходят 3Э + 4HNO3 = 3ЭO2 + 4NO + 2H2O |
Химические свойства
При каталитическом окислении SO2 образуется триоксид серы 2SO2 + O2 ↔V2O5 или Pt 2SO3
В водном растворе диоксида серы устанавливается равновесие SO2 + H2O ↔ H2SO3 ↔ H+ + HSO3-
Диоксид серы, сернистая кислота и ее соли (гидросульфиты и сульфиты) проявляют преимущественно свойства восстановителей SO2 + Cl2 = SO2Cl2 хлористый сульфурил, хлорангидрид серной кислоты 2Na2SO3 + O2 = 2Na2SO4 но также могут проявлять свойства окислителей SO2 + 2H2S = 3S + 2H2O
При нагревании сульфиты могут разлагаться по двум направлениям 4Na2SO3 =t Na2S + 3Na2SO4 ZnSO3 =t ZnO + SO2 2Ag2SO3 =t 4Ag + 2SO2 + O2 (здесь разложился еще и образующийся Ag2O)
Гидросульфиты существуют только в растворах. При кристаллизации происходит отщепление воды от молекулы 2NaHSO3 = H2O + Na2S2O5
При восстановлении гидросульфитов можно получить дитиониты 2NaHSO3 + Zn + H2SO3 = Na2S2O4 + ZnSO3 + 2H2O Дитионит устойчив только в сухом виде, в присутствии воды тут же окисляется обратно в гидросульфит 2Na2S2O4 + 2H2O + O2 = 4NaHSO3
Кстати, в щелочной среде дитионит натрия – один из самых сильных восстановителей S2O42- + 2e- + 4OH- = 2H2O + 2SO32- ϕo = -1,12B |
Если SO2 и SeO2 хорошо растворимы как в щелочах, так и в воде, то TeO2 практически не растворим в воде, но в щелочах растворяется все так же хорошо. TeO2 + 2NaOH = Na2TeO3 + H2O К тому же, диоксид теллура проявляется амфотерные свойства и, в отличие от SO2 и SeO2, может растворяться в сильных кислотах. Он типа амфотерный, но более в сторону кислых штучек склоняется TeO2 + 4HCl = TeCl4 + 2H2O
!!!!!!!!!!!!!! В отличие от соединений S(IV), производные Se(IV) и Te(IV) проявляются в большей степени окислительные свойства, чем восстановительные
H2ЭO3 + 2H2SO3 = 2H2SO4 + Э + H2O H2SeO3 + 2SO2 + H2O = 2H2SO4 + Se
