
- •Вопрос 1. Термодинамические параметры. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •Вопрос 2. Закон Гесса – основной закон термохимии. Следствия из закона Гесса.
- •1 Следствие.
- •Вопрос 4. Энергия Гиббса. Уравнение Гельмгольца-Гиббса: энтальпийный и энтропийный факторы. Критерии самопроизвольного протекания химического процесса.
- •Вопрос 5. Скорость химической реакции. Кинетическое уравнение. Факторы, определяющие скорость химической реакции
- •4) Природа реагентов
- •5) Площадь соприкосновения твердого вещества Вопрос 6. Химическое равновесие. Константа равновесия. Принцип Ле Шателье, примеры.
- •Вопрос 7. Растворы: разбавленные, концентрированные, насыщенные, ненасыщенные, перенасыщенные. Способы выражения концентрации растворов. Эквивалент. Закон эквивалентов.
- •Вопрос 8. Свойства растворов неэлектролитов. Давление пара над растворами. Закон Рауля. Температуры кипения и замерзания растворов. Осмотическое давление
- •Вопрос 10. Растворы слабых электролитов. Константа диссоциации. Ступенчатый характер электролитической диссоциации. Смещение ионных равновесий в растворах слабых кислот и оснований.
- •Вопрос 11. Ионное произведение воды. Водородный и гидроксильный показатели. Буферные растворы: их состав, расчет ph
- •Вопрос 12. Электролитическая диссоциация комплексных соединений в растворах. Константы образования и нестойкости. Разрушение комплексных соединений
- •Вопрос 13. Гидролиз солей. Основные типы гидролиза. Обратимый гидролиз. Необратимый гидролиз
- •Вопрос 14. Количественные характеристики гидролиза солей (степень гидролиза, константа гидролиза). Вывод формул констант гидролиза, примеры. Влияние различных факторов на степень гидролиза солей.
- •Вопрос 15. Равновесие между раствором и осадком малорастворимого электролита. Константа растворимости Ksp. Условия растворения и образования осадков
- •Вопрос 16. Основные положения квантовой механики: корпускулярно-волновой дуализм, уравнение Шредингера, принцип неопределенности Гейзенберга.
- •Вопрос 22. Природа связи в комплексных соединениях по методу вс. Геометрия комплексных ионов. Магнитные свойства.
- •Вопрос 23. Химическая связь в комплексных соединениях. Понятие о теории кристаллического поля. Параметр расщепления. Спектрохимический ряд лигандов
- •Вопрос 24. Основные типы геометрических форм молекул. Использование теории гибридизации для прогнозирования геометрической формы молекулы.
- •28 Вопрос. Межмолекулярные взаимодействия: ориентационное, индукционное, дисперсионное и их природа. Энергия межмолекулярного взаимодействия
- •29 Вопрос. Окислители и восстановители, часто применяемые в химической практике. Влияние pH, температуры, концентрации реагентов и их природы на протекание овр.
- •Вопрос 30. Электродные потенциалы металлов. Факторы, определяющие положение металла в активности металлов. Уравнение Нернста.
- •31 Вопрос. Общая характеристика p-элементов VII группы. Получение галогенов, их свойства. Соединения галогенов с водородом. Вопрос 32. Галогены. Методы получения, химические свойства простых веществ.
- •Вопрос 36. Кислород. Методы получения, физические свойства. Химические свойства кислорода. Соединения (оксиды, пероксиды, надпероксиды). Получение, свойства.
- •Вопрос 37. Пероксид водорода. Получение и химические свойства. Пероксикислоты и их соли (строение, получение, свойства).
- •Вопрос 38. Соединения серы с водородом и кислородом (получение и свойства). Тиосульфат натрия (строение, получение, свойства).
- •I. Сульфид водорода (сероводород) h2s и сульфиды
- •Вопрос 40. Серная кислота. Методы получения. Химические свойства
- •Вопрос 43. Общая характеристика элементов V группы. Строение атомов. Степени окисления. Отношение простых веществ к кислотам.
- •Вопрос 45. Соединения азота с водородом: аммиак, гидразин, гидроксиламин, азотоводородная кислота. Кислотно-основные и окислительно-восстановительные свойства.
- •1. Аммиак
- •2 . Гидразин
- •3. Гидроксиламин
- •Вопрос 48. Соединения фосфора с металлами, водородом, кислородом, галогенами (получение и химические свойства)
- •1. Соединения фосфора с металлами
- •2. Соединения фосфора с водородом
- •3. Галогениды фосфора
- •Вопрос 49. Соединения мышьяка, сурьмы, висмута (оксиды, гидроксиды, галогениды, сульфиды). Получение и свойства этих соединений
- •Вопрос 50. Галогениды азота, фосфора, мышьяка, сурьмы, висмута. Получение. Характер связи элемент-галоген. Гидролиз галогенидов. Галогениды азота
- •Вопрос 51. Оксиды p-элементов группы IV. Изменения кислотно-основных и окислительно-восстановительных свойств в зависимости от природы элемента.
- •Вопрос 52. Углерод. Аллотропия, типы гибридизации. Оксиды углерода. Угольная кислота и ее соли.
- •Вопрос 53. Кремний. Степени окисления. Свойства кремния. Диоксид кремния. Кремниевые кислоты и их соли
- •Вопрос 54. Олово и свинец. Их химическая активность. Гидроксиды, галогениды, сульфиды этих элементов. Свинцовый сурик
- •Вопрос 55. Хром. Строение атома, степени окисления. Оксиды, гидроксиды, соли, комплексные соединения.
- •Вопрос 56. Марганец. Строение атома, степени окисления. Оксиды, гидроксиды, соли. Перманганат калия
- •Вопрос 57. Железо, кобальт, никель. Строение атомов, степени окисления. Их отношение к кислотам. Оксиды, гидроксиды, соли, комплексные соединения этих элементов
- •Вопрос 58. Общая характеристика d-элементов группы I (медь, серебро, золото). Их степени окисления. Химические свойства металлов. Оксиды, гидроксиды, соли этих металлов
- •Вопрос 59. Общая характеристика d-элементов II группы. Их оксиды, гидроксиды, соли, комплексные соединения. Химические свойства этих соединений
Вопрос 45. Соединения азота с водородом: аммиак, гидразин, гидроксиламин, азотоводородная кислота. Кислотно-основные и окислительно-восстановительные свойства.
1. Аммиак
М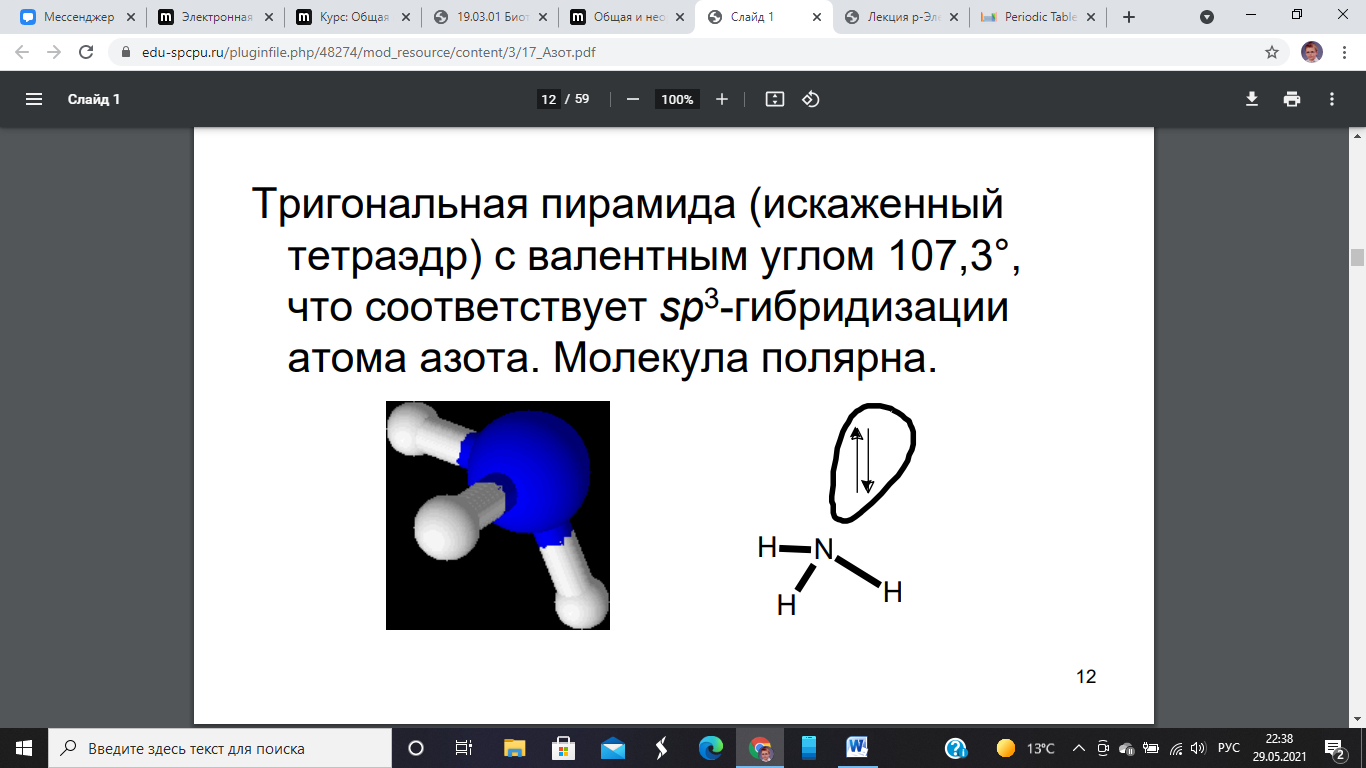 олекула
аммиака – тригональная пирамида
(искаженный тетраэд) с валентным углом
107,3◦,
что
соответствует sp3-гибридизации
атома азота. Молекула полярна, проявляет
электродонорные свойства.
олекула
аммиака – тригональная пирамида
(искаженный тетраэд) с валентным углом
107,3◦,
что
соответствует sp3-гибридизации
атома азота. Молекула полярна, проявляет
электродонорные свойства.
Водородная связь между молекулами аммиака слабее, чем в воде, поэтому вязкость аммиака меньше, а температура плавления ниже, чем у воды. Аммиак легко сжижается.
При обычных условиях аммиак – газ с резким запахом, хорошо растворимый в воде. При 20◦С в одном литре воды растворяется до 700л газообразного аммиака. В водном растворе аммиака устанавливается равновесие NH3 + H2O ↔K=0,2 NH3*H2O ↔K=1,8*10^(-5) NH4+ + OH-
Получение аммиака
Промышленный синтез аммиака – каталитический процесс, протекающий при высоких давлениях и температурах в присутствии катализатора (98% Fe3O4 + 2% KAlO2) N2 + 3H2 ↔ 2NH3
В лаборатории аммиак получают, действуя на соли аммония растворами щелочей NH4Cl + KOH = NH3 + KCl + H2O
Химические свойства аммиака
Аммиак вступает в реакции присоединения, проявляя свойства основания NH3 + HCl = NH4Cl CuSO4 + 4NH3 = [Cu(NH3)4]SO4
Газообразный или жидкий аммиак вступает в реакции замещения водорода активными металлами 2Na + 2NH3 = 2NaNH2 + H2 В зависимости от количества замещенных атомов различают амиды NaNH2, имиды Na2NH и нитриды Na3N. Как и нитриды, амиды и имиды разлагаются водой NaNH2 + H2O = NH3 + NaOH
В ОВР аммиак, амиды, имиды и нитриды проявляют восстановительные свойства, окисляясь до азота
Соли аммония термически неустойчивы. Если анион окислитель, то при нагревании идет ОВР NH4NO3 =t N2O + 2H2O В других случаях происходит отщепление аммиака (NH4)3PO4 =t NH3 + (NH4)2HPO4 (NH4)2CO3 =t 2NH3 + CO2 + H2O NH4Cl =t NH3 + HCl
2 . Гидразин
Гидразин N2H4 – бесцветная, дымящая на воздухе жидкость. Соединение менее устойчивое, чем аммиак.
Степень окисления азота в гидразине -2
Гидразин – слабое двухкислотное основание, с кислотами образует соли гидразиния, например N2H2*H2SO4 – сульфат гидразиния С водой образует гидразин-гидрат N2H4*H2O
Получение
Гидразин получают окислением водного раствора аммиака гипохлоритом натрия в присутствии желатина 2NH3 + NaClO = N2H4 + NaCl + H2O
Химические свойства
В ОВР гидразин – сильный восстановитель 2CuSO4 + N2H4*H2SO4 = 2Cu + N2 + 3H2SO4
В реакциях с сильными восстановителями гидразин может проявлять окислительные свойства N2H4 + H2 (в момент выделения) = 2NH3
3. Гидроксиламин
Гидроксиламин NH2OH – кристаллическое вещество. Слабое основание. Степень окисления азота -1
Получение
Гидроксиламин NH2OH получают электролитическим восстановлением азотной кислоты на свинцовом катоде HNO3 + 6H* = NH2OH + 2H2O
Может быть получен при медленном разложении HN3 водой HN3 + H2O = NH2OH + N2
Химические свойства
В щелочной среде гидроксиламин хороший восстановитель 2NH2OH + I2 + 2KOH = N2 + 2KI + 4H2O
В кислой среде гидроксиламин может быть и окислителем – до аммиака 4FeSO4 + 2NH2OH + 3H2SO4 = 2Fe2(SO4)3 + (NH4)2SO4 + 2H2O
Азид водорода (азотоводородная кислота)
HN3 – бесцветная жидкость с резким запахом, токсичен, распадается со взрывом
Л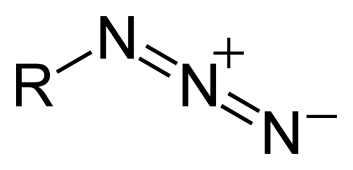 инейное
строение азид-ионы по методу валентных
связей объясняется следующим образом.
Центральный атом азота (N+)
имеет 4 неспаренных электрона. Две его
sp-гибридные
орбитали образуют -связи,
а две p-орбитали
–
инейное
строение азид-ионы по методу валентных
связей объясняется следующим образом.
Центральный атом азота (N+)
имеет 4 неспаренных электрона. Две его
sp-гибридные
орбитали образуют -связи,
а две p-орбитали
–
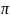 -связи
с атомами азота.
-связи
с атомами азота.
Получение
Азид водорода получают окислением азотистой кислотой гидразина N2H4 + HNO2 = HN3 + 2H2O
Химические свойства
В водном растворе азид водорода – слабая кислота. Под действием воды медленно разлагается HN3 + H2O = N2 + NH2OH
В ОВР проявляет окислительные свойства подобно азотной кислоте HN3 + 2HI = I2 + NH3 + N2
При взаимодействии с металлами образуются азиды, азот и аммиак 3HN3 + Mg = Mg(N3)2 + N2 + NH3
Азиды тяжелых металлов, как и сама кислота – взрывчатые вещества
В ряду NH3, N2H4, NH2OH, HN3 основные свойства ослабевают. HN3 уже проявляет слабые кислотные свойства. Свойства восстановителя также ослабевают. NH2OH проявляет восстановительные свойства в щелочной среде, а в кислой может окисляться до аммиака. HN3 проявляет свойства окислителя, окисляясь до N2 и NH3.
