
- •Вопрос 1. Термодинамические параметры. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •Вопрос 2. Закон Гесса – основной закон термохимии. Следствия из закона Гесса.
- •1 Следствие.
- •Вопрос 4. Энергия Гиббса. Уравнение Гельмгольца-Гиббса: энтальпийный и энтропийный факторы. Критерии самопроизвольного протекания химического процесса.
- •Вопрос 5. Скорость химической реакции. Кинетическое уравнение. Факторы, определяющие скорость химической реакции
- •4) Природа реагентов
- •5) Площадь соприкосновения твердого вещества Вопрос 6. Химическое равновесие. Константа равновесия. Принцип Ле Шателье, примеры.
- •Вопрос 7. Растворы: разбавленные, концентрированные, насыщенные, ненасыщенные, перенасыщенные. Способы выражения концентрации растворов. Эквивалент. Закон эквивалентов.
- •Вопрос 8. Свойства растворов неэлектролитов. Давление пара над растворами. Закон Рауля. Температуры кипения и замерзания растворов. Осмотическое давление
- •Вопрос 10. Растворы слабых электролитов. Константа диссоциации. Ступенчатый характер электролитической диссоциации. Смещение ионных равновесий в растворах слабых кислот и оснований.
- •Вопрос 11. Ионное произведение воды. Водородный и гидроксильный показатели. Буферные растворы: их состав, расчет ph
- •Вопрос 12. Электролитическая диссоциация комплексных соединений в растворах. Константы образования и нестойкости. Разрушение комплексных соединений
- •Вопрос 13. Гидролиз солей. Основные типы гидролиза. Обратимый гидролиз. Необратимый гидролиз
- •Вопрос 14. Количественные характеристики гидролиза солей (степень гидролиза, константа гидролиза). Вывод формул констант гидролиза, примеры. Влияние различных факторов на степень гидролиза солей.
- •Вопрос 15. Равновесие между раствором и осадком малорастворимого электролита. Константа растворимости Ksp. Условия растворения и образования осадков
- •Вопрос 16. Основные положения квантовой механики: корпускулярно-волновой дуализм, уравнение Шредингера, принцип неопределенности Гейзенберга.
- •Вопрос 22. Природа связи в комплексных соединениях по методу вс. Геометрия комплексных ионов. Магнитные свойства.
- •Вопрос 23. Химическая связь в комплексных соединениях. Понятие о теории кристаллического поля. Параметр расщепления. Спектрохимический ряд лигандов
- •Вопрос 24. Основные типы геометрических форм молекул. Использование теории гибридизации для прогнозирования геометрической формы молекулы.
- •28 Вопрос. Межмолекулярные взаимодействия: ориентационное, индукционное, дисперсионное и их природа. Энергия межмолекулярного взаимодействия
- •29 Вопрос. Окислители и восстановители, часто применяемые в химической практике. Влияние pH, температуры, концентрации реагентов и их природы на протекание овр.
- •Вопрос 30. Электродные потенциалы металлов. Факторы, определяющие положение металла в активности металлов. Уравнение Нернста.
- •31 Вопрос. Общая характеристика p-элементов VII группы. Получение галогенов, их свойства. Соединения галогенов с водородом. Вопрос 32. Галогены. Методы получения, химические свойства простых веществ.
- •Вопрос 36. Кислород. Методы получения, физические свойства. Химические свойства кислорода. Соединения (оксиды, пероксиды, надпероксиды). Получение, свойства.
- •Вопрос 37. Пероксид водорода. Получение и химические свойства. Пероксикислоты и их соли (строение, получение, свойства).
- •Вопрос 38. Соединения серы с водородом и кислородом (получение и свойства). Тиосульфат натрия (строение, получение, свойства).
- •I. Сульфид водорода (сероводород) h2s и сульфиды
- •Вопрос 40. Серная кислота. Методы получения. Химические свойства
- •Вопрос 43. Общая характеристика элементов V группы. Строение атомов. Степени окисления. Отношение простых веществ к кислотам.
- •Вопрос 45. Соединения азота с водородом: аммиак, гидразин, гидроксиламин, азотоводородная кислота. Кислотно-основные и окислительно-восстановительные свойства.
- •1. Аммиак
- •2 . Гидразин
- •3. Гидроксиламин
- •Вопрос 48. Соединения фосфора с металлами, водородом, кислородом, галогенами (получение и химические свойства)
- •1. Соединения фосфора с металлами
- •2. Соединения фосфора с водородом
- •3. Галогениды фосфора
- •Вопрос 49. Соединения мышьяка, сурьмы, висмута (оксиды, гидроксиды, галогениды, сульфиды). Получение и свойства этих соединений
- •Вопрос 50. Галогениды азота, фосфора, мышьяка, сурьмы, висмута. Получение. Характер связи элемент-галоген. Гидролиз галогенидов. Галогениды азота
- •Вопрос 51. Оксиды p-элементов группы IV. Изменения кислотно-основных и окислительно-восстановительных свойств в зависимости от природы элемента.
- •Вопрос 52. Углерод. Аллотропия, типы гибридизации. Оксиды углерода. Угольная кислота и ее соли.
- •Вопрос 53. Кремний. Степени окисления. Свойства кремния. Диоксид кремния. Кремниевые кислоты и их соли
- •Вопрос 54. Олово и свинец. Их химическая активность. Гидроксиды, галогениды, сульфиды этих элементов. Свинцовый сурик
- •Вопрос 55. Хром. Строение атома, степени окисления. Оксиды, гидроксиды, соли, комплексные соединения.
- •Вопрос 56. Марганец. Строение атома, степени окисления. Оксиды, гидроксиды, соли. Перманганат калия
- •Вопрос 57. Железо, кобальт, никель. Строение атомов, степени окисления. Их отношение к кислотам. Оксиды, гидроксиды, соли, комплексные соединения этих элементов
- •Вопрос 58. Общая характеристика d-элементов группы I (медь, серебро, золото). Их степени окисления. Химические свойства металлов. Оксиды, гидроксиды, соли этих металлов
- •Вопрос 59. Общая характеристика d-элементов II группы. Их оксиды, гидроксиды, соли, комплексные соединения. Химические свойства этих соединений
31 Вопрос. Общая характеристика p-элементов VII группы. Получение галогенов, их свойства. Соединения галогенов с водородом. Вопрос 32. Галогены. Методы получения, химические свойства простых веществ.
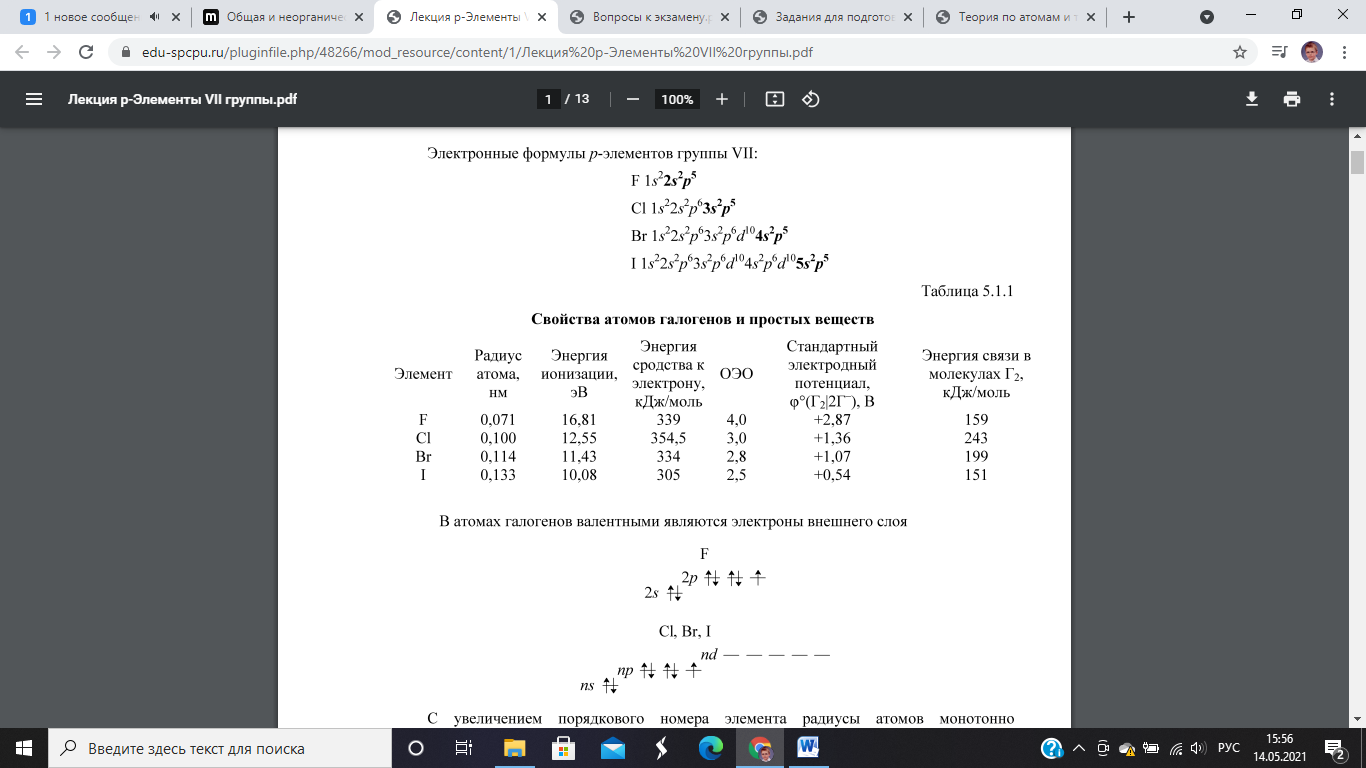
С увеличением порядкового номера элемента: • радиусы возрастают • энергия ионизации уменьшается • энергия сродства к электрону уменьшается
Аномальное значение энергии сродства к электрону у фтора объясняется более высокой электронной плотностью и значительно меньшим, чем у других галогенов, радиусом атома (и в связи с этим более сильным отталкиванием электрона) |
• ОЭО уменьшается • энергия связи уменьшается, что приводит к возрастанию степени термической диссоциации (при 1000К (Cl2, Br2, I2): 0,035% -> 0,23% ->2,8%)
Аномально
низкое значение энергии связи и высокую
степень диссоциации в молекуле фтора
можно объяснить отсутствием дативных
связей, которые имеют место в молекулах
других галогенов за счет d-подуровня
и, соответственно, невозможны у фтора
|
• окислительные свойства ослабляются • восстановительные свойства нарастают • неметаллические свойства уменьшаются. Если фтор – типичный неметалл, то йод проявляет такие свойства металлов, как металлический блеск в кристаллическом состоянии, способность к образованию солей катионного типа I(ClO4)3, I(CH3COO)3. Также стоит обратить внимание на амфотерность HIO.
Степени окисления
• Cl,
Br
и I
в соединениях проявляют степени окисления
от -1 до +7, что обусловлено наличием
d-подуровня
в атомах. Положительные степени окисления
они имеют в соединениях с кислородом
(оксиды, кислородсодержащие кислоты и
их соли), азотом (хлорамины
![]() и
др.) и в межгалоидных соединениях.
•
степень окисления фтора в соединениях
с другими элементами всегда равна -1
и
др.) и в межгалоидных соединениях.
•
степень окисления фтора в соединениях
с другими элементами всегда равна -1
Нахождение в природе и способы получения
Вследствие высокой химической активности галогены в природе встречаются только в виде соединений. Наибольшее значение имеют минералы.
Хлор Cl |
- В виде солей в воде морей и океанов |
В лаборатории получают окислением соляной кислоты различными окислителями (KMnO4, PbO2, MnO2, K2Cr2O7 и др.), например: 4HCl + MnO2 = Cl2 + MnCl2 + 2H2O |
Бром Br |
- В виде солей в воде морей и океанов - В нефтяных буровых водах |
Получают из буровых йод, окисляя бромиды: 2NaBr + Cl2 = Br2 + 2NaCl Эту реакцию также используют в лаборатории |
Йод I |
- В виде солей в воде морей и океанов - Некоторые морские водоросли (например, ламинария) накапливают йод - Йодат и перйодат как примесь в чилийской селитре KNO3 |
Получают из золы морских водорослей, окисляя йодиды: 2KI + 2KNO2 + 2H2SO4 = I2 + 2K2SO4 + 2NO + 2H2O 2NaI + MnO2 + 2H2SO4 = I2 + MnSO4 + Na2SO4 + 2H2O 2NaI + Cl2 = 2NaCl + I2 Эти реакции также используют в лаборатории |
Фтор F |
- Дигидрофторид калия KF*2HF |
Электролиз расплава дигидрофторида калия |
Физические свойства галогенов

В обычных условиях: •Фтор – бледно-желтый газ •Хлор – желто-зеленый газ, в растворе бесцветен •Бром – жидкость красно-бурого цвета •Йод – темно-серые кристаллы, в р-ре бурого цвета. Пары фиолетовые
Химические свойства свободных галогенов
Свободные галогены – сильные окислители. Взаимодействуют с металлами и большинством неметаллов, кроме углерода, азота и кислорода 2Al + 3I2 =h2o (капля) 2AlI3 2P + 5Cl2 = 2PCl5 Фтор – самый сильный окислитель. Способен окислить даже криптон и ксенон SiO2 + 2F2 = SiF4 + O2 фтор разрушает стекло H2O + F2 = 2HF + O◦ разлагает воду (одновременно с атомарным кислородом могут выделяются H2O2, OF2 и O3)
Реагируют с водородом с образованием галогеноводородов F2 + H2 = 2HF, со взрывом при любых условиях (∆H = -535 кДж) Cl2 + H2 = 2HCl, в обычных условиях медленно, при нагревании или освещении со взрывом I2/Br2 + H2 ↔ 2HI/2HBr, возможно лишь при нагревании, реакция обратима
Хлор, бром и йод при растворении взаимодействуют с водой: Г2 + H2O ↔ HГ + НГО Глубина протекания этой реакции зависит от природы галогена. K для Cl2, Br2, I2 соответственно равны 4,2*10-4; 7,2*10-9; 2*10-13 Водные растворы хлора и брома называют хлорной и бромной водой. Йод малорастворим (0,3 г/л), поэтому его раствор готовят с добавлением KI (растворимость йода увеличивается за счет образования полийодата KI + I2 = KI3)
Хлор, бром и йод диспропорционируют не только в воде, но и в щелочах. Причем с щелочами реакция необратима. При комнатной температуре образуются гипогалогенид и галогенид, а при нагревании – галогенат и галогенит. Cl2 + 2KOH = KCl + KClO + H2O Cl2 + 6KOH =t 5KCl + KClO3 + 3H2O Однако получение гипойодида затруднено вследствии его малой устойчивости, поэтому с йодом, как при комнатной температуре так и при нагревании, образуется йодат
Восстановительные свойства увеличиваются в ряду Cl, Br, I Йод, например, способен восстанавливать азотную кислоту 3I2 + 10HNO3 = 6HIO3 + 10NO + 2H2О
Галогены образуют межгалоидные соединения (ClF3, ClF, ICl3 и другие), которые являются галогенангидридами и гидролизуются с образованием соответствующих кислот ClF + H2O = HClO + HF
Более высокую восстановительную активность йода в сравнении с хлором можно доказать следующей реакцией: I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
Галогеноводороды Физические свойства
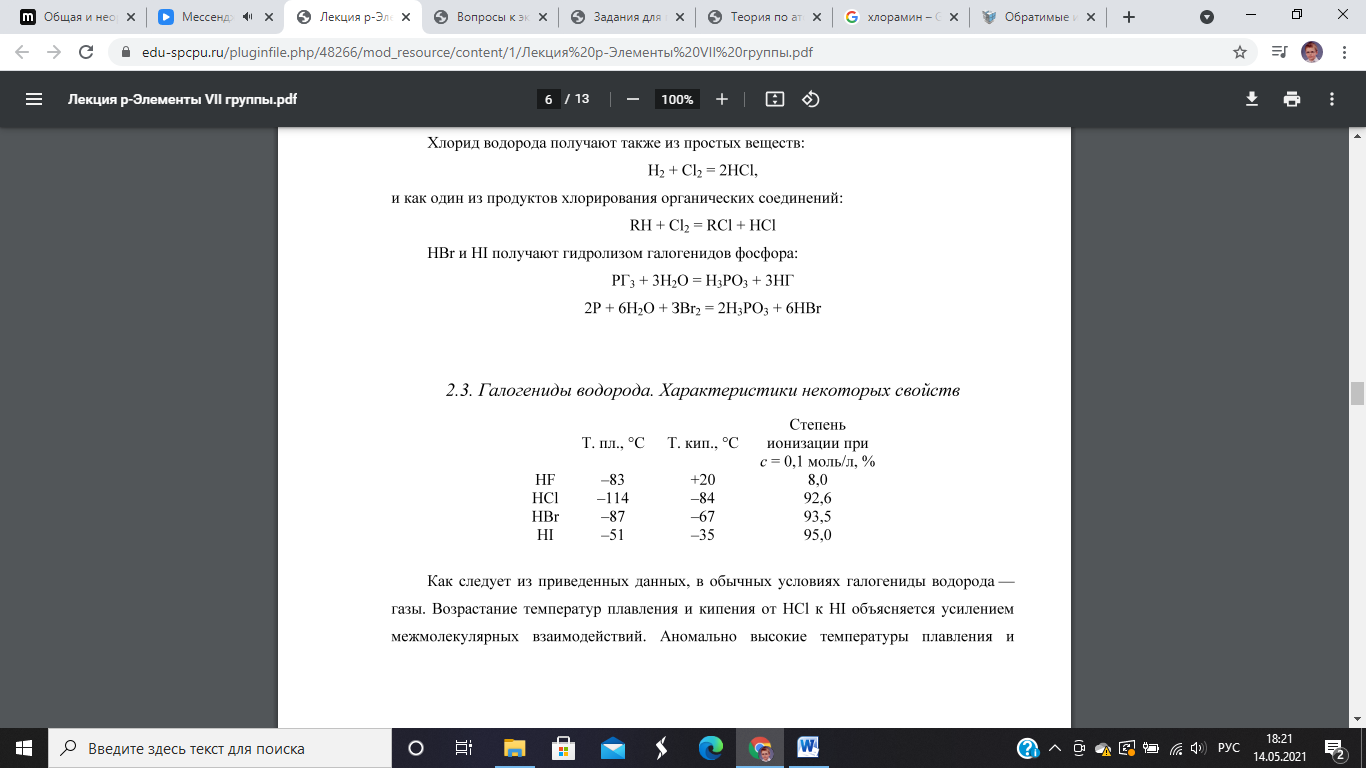
В обычных условиях галогениды водорода – газы. Возрастание температур плавления и кипения от HCl к HI объясняется усилением межмолекулярных взаимодействий.
Аномально высокие температуры плавления и кипения фторида водорода обусловлены ассоциацией молекул HF в (HF)n за счет водородных связей. В жидком фториде водорода n = 2-6, а в твердом -> ∞. |
Водные растворы HCl, HBr и HI – сильные кислоты, степень ионизации которых несколько возрастает в ряду HCl, HBr, HI.
Фтороводородная (плавиковая) кислота – слабый электролит вследствие малой поляризуемости молекул и их ассоциации. По этой причине для плавиковой кислоты характерно образование кислых фторидов, невозможное для других галогенидов водорода HF + HF = H+ + HF2- 2HF + NaOH = NaHF2 + H2O |
Получение галогеноводородов
HF и HCl можно получить действием концентрированной серной кислоты на сухие галогениды CaF2 + H2SO4(конц) = CaSO4 + 2HF Бромоводород и йодоводород таким образом получить нельзя, так как пойдет ОВР
Хлороводород также получают из простых веществ H2 + Cl2 = 2HCl к тому же он выделяется как один из продуктов хлорирования орагнических соединений RH + Cl2 = RCl + HCl
HBr и HI получают гидролизом галогенидов фосфора или из соответствующих солей PI3 + 3H2O = H3PO3 + 3HI 2P + 3Br2 + 6H2O = 2H3PO3 + 6HBr (или, если брома избыток, P0 уходит в P+5)
Химические свойства
В ряду F-,Cl-,Br-,I- восстановительная активность увеличивается вследствие возрастания радиуса иона. Фториды и плавиковая кислота восстановительных свойств практически не проявляют. А вот йодиды и йодоводород – сильные восстановители и в водных растворах легко окисляются кислородом воздуха 4HI + O2 = 2H2O + 2I2
Увеличение восстановительной активности в ряду Cl-,Br-,I- можно продемонстрировать реакциями галогенидов с концентрированной серной кислотой. NaCl + H2SO4(конц) = NaHSO4 + HCl 2NaBr + 3H2SO4 = 2NaHSO4 + Br2 + SO2 + 2H2O 8NaI + 9H2SO4 = 8NaHSO4 + 4I2 + H2S + 4H2O
В последних двух реакциях сначала в результате реакции ионного обмена образуются соответствующие кислоты – HBr и HI, и именно они уже потом вступают в ОВР |
Вопрос 33. Соединения галогенов со степенью окисления +5 (кислоты, соли). Методы получения, кислотно-основные, окислительно-восстановительные свойства этих соединений. Вопрос 34. Кислородсодержащие соединения галогенов (оксиды, кислоты, соли). Их получение и химические свойства. Хлорная известь. Вопрос 35. Кислородсодержащие кислоты хлора. Метод получения. Закономерности в изменении кислотно-основных и окислительно-восстановительных свойств кислот.
1. Галогены в степени окисления +1
HClO – хлорноватистая к-та ClO- - гипохлорит HBrO – бромноватистая к-та BrO- - гипобромит HIO – йодноватистая к-та IO- - гипойодит
Кислоты
НГО – слабые электролиты, сила которых
уменьшается в ряду HClO,
HBrO,
HIO.
Йодноватистая кислота и вовсе проявляет
амфотерные свойства
![]() Существование
иона I+
- одно из проявлений металлических
свойств йода.
Существование
иона I+
- одно из проявлений металлических
свойств йода.
Кислоты HГО существуют только в разбавленных растворах и неустойчивы. HClO =hv HCl + O• на свету 2HClO = Cl2O + H2O в присутствии водоотнимающих средств 3HClO = HClO3 + 2HCl при нагревании Соли кислот НГО образуются при растворении галогенов в щелочах. При комнатной температуре образуются гипогалогенид и галогенид, а при нагревании – галогенат и галогенит. Cl2 + 2KOH = KCl + KClO + H2O Cl2 + 6KOH =t 5KCl + KClO3 + 3H2O Однако получение гипойодида затруднено в следствии его малой устойчивости, поэтому с йодом, как при комнатной температуре так и при нагревании, образуется йодат
Соединения галогенов со степенью окисления +1 проявляют сильные окислительные свойства во всех средах (наиболее сильные свойства проявляют в кислой), восстанавливаясь преимущественно до галогенидов в щелочной и нетйральной среде и до свободных галогенов в кислой. ГО- + 2e- = Г-
Наибольшее практическое значение имеют хлорная известь и жавелевая вода Cl2 + Ca(OH)2 = CaOCl2 + H2O хлорная известь Cl2 + 2KOH = KCl + KClO + H2O жавелевая вода Хлорная известь является смешанной солью – гипохлорит хлорид кальция, CaCl(OCl). Качество ее определяют по количеству хлора, выделившегося в реакции CaOCl2 + 2HCl(конц) = Cl2 + CaCl2 + H2O Применение хлорной извести основано на сильных окислительных свойствах гипохлоритов. Ее используют для отбеливания растительного волокна (ткани, бумаги) и для дезинфекции. Во влажном воздухе хлорная известь постепенно разлагается 2СаOCl2 + CO2 + H2O = CaCO3 + CaCl2 + 2HClO
2. Галогены в степени окисления +3
Хлор образует хлористую кислоту HClO2 и ее соли – хлориты. Хлористая кислота слабая (Ка = 1*10-2), неустойчивая, существует только в разбавленных растворах. Соли хлористой кислоты, хлориты, более устойчивы, чем к-та. Могут быть получены восстановлением диоксида хлора ClO2. 2ClO2 + BaO2 = Ba(ClO2)2 + O2 4ClO2 + C + 6NaOH = 4NaClO2 + Na2CO3 + 3H2O 2ClO2 + PbO + 2NaOH = PbO2 + 2NaClO2 + H2O
Хлористая кислота и ее соли обладают сильными окислительными свойствами, реакции +- аналогичны реакциям с гипохлоритами
3. Галогены в степени окисления +5
HClO3 – хлорноватая к-та ClO3- - хлорат HBrO3 – бромноватая к-та BrO3- - бромат HIO3 – йодноватая к-та IO3- - йодат
Кислоты НГО3 – сильные электролиты, в ряду HClO3, HBrO3, HIO3 кислотные свойства несколько ослабевают. Хлорноватая и бромноватая кислоты неустойчивы, существуют только в растворе. Если концентрация раствора более 50%, то эти кислоты разлагаются со взрывом. Йодную кислоту можно выделить в виде расплывающихся на воздухе белых кристаллов. Соединения галогенов +5 более устойчивы, чем соединения галогенов +1, так как обладают чуть меньшей окислительной активностью.
Соли кислот +5 можно получить при растворении галогенов в горячих растворах щелочей 3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
Кислоты можно получить из соответствующих солей Ba(ClO3)2 + H2SO4 = BaSO4 + 2HClO3 5AgBrO3 + 3Br2 + 3H2O = 5AgBr + 6HBrO3
Йодноватую кислоту получают окислением йода I2 + 10HNO3 = 2HIO3 + 4H2O + 10NO2 I2 + 5Cl2 + 6H2O = 10HCl + 2HIO3
Йодная кислота в растворе образует ассоциаты (HIO3)n, где n = 2-3, в связи с чем она легко кристаллизуется с солями, образуя кислые соли, например KIO3*2HIO3. При нагревании до 200◦С HIO3 разлагается 2HIO3 = I2O5 + H2O Для HClO3 и HBrO3 ангидриды не получены.
Окислительные свойства в ряду HClO3, HBrO3, HIO3 уменьшаются. KClO3 + 6HCl = 3Cl2 + 3H2O + KCl реакция сопропорционирования
Хлорат калия KClO3, бертолетова соль, имеет наибольшее применение в качестве окислителя. При нагревании диспропорционирует: 4KClO3 = 3KClO4 + KCl а в присутствии катализаторов (наиболее популярный – MnO2) разлагается с выделением кислорода: 2KClO3 =MnO2,t 2KCl + 3O2 При быстром нагревании выше 400◦С такое разложение идет со взрывом. При сплавлении хлорат калия окисляет многие вещества 6P + 5KClO3 = KCl + 3P2O5 KClO3 + Cr2O3 + 4KOH = 2K2CrO4 + KCl + 2H2O
4. Галогены в степени окисления +7
HClO4 – хлорная к-та ClO4- - перхлорат HBrO4 – бромная к-та BrO4- - пербромат HIO4 – йодная к-та IO4- - перйодат
Хлорная кислота самая сильная из всех кислот. Получают ее электролитически из HCl или отгонкой в вакууме при 16◦С из смеси перхлората и серной к-ты.
Безводная HClO4 – подвижная, дымящая на воздухе жидкость, при нагревании разлагается со взрывом. 4HClO4 =t 4ClO2 + 3O2 + 2H2O
Образует хлорный ангидрид 4HClO4 + P4O10 = 2Cl2O7 + 4HPO3
Хлорная кислота практически не проявляет окислительных свойств в растворах. Перхлораты в р-рах также не проявляют ок-х свойств. Однако в сухом состоянии перхлорат термически неустойчив KClO4 =t KCl + 2O2
Бромная кислота наименее устойчива из всех кислот НГО4, существует лишь в водных растворах (w < 55%)
Соль этой кислоты может быть получена может быть окислением бромата фторидом ксенона KBrO3 + XeF2 + H2O = KBrO4 + Xe + 2HF
По свойствам близка к хлорной кислоте.
Йодная к-та при нагревании разлагается с образованием I2O5 2HIO4 =t I2O5 + H2O + O2 Ангидрид йодной кислоты не получен Кислоту получают электролитическим окислением HIO3 либо из соответствующих солей. Выделяется она в виде ортоформы H2IO5 Перйодаты получают окислением йодатов KIO3 + KClO = KCl + KIO4
Йодная кислота и перйодаты – сильные окислители, но, в отличие от HClO4, не взрывоопасны, поэтому часто применяются 4H5IO6 + AsH3 = H3AsO4 + 4HIO3 + 8H2O
Из солей йода (+5) также известны помимо метаперйодатов NaIO4 еще и ортоперйодаты Na5IO6 и кислые соли перйодатов типа Na2H3IO6 KIO3 + Cl2 + 3KOH = K2H3IO6 + 2KCl
Закономерность изменения кислотно-основных и окислительно-восстановительных свойств кислородсодержащих кислот Окислительная активность анионов в ряду ClO-, ClO3-, СlO4- уменьшается. Гипохлориты сильные ок-ли во всех средах, хлораты – довольно сильные о-ли в кислой среде или при сплавлении, а перхлораты в р-ре не проявляют ок-ных св-в (зато проявляют перйодаты в кислой среде – аномалия какая-то)
Кислотные свойства кислот в этом ряду увеличиваются. Если HClO – слабый электролит, то HClO4 уже, напротив, является чуть ли не сильнейшим электролитом.
Оксиды галогенов
Оксиды галогенов получают только косвенным путем |
1. Оксиды хлора
• Cl2O – хлорноватистый ангидрид, газ желто-бурого цвета 2Cl2 + 2HgOсуспензия = HgCl2*HgO + Cl2O также может быть получен при осушении HClO
• ClO2 – диоксид хлора, желтый газ 2KClO3 + H2SO4 + SO2 = 2ClO2 + 2KHSO4 2KClO3 + HOOC-COOH = K2CO3 + 2ClO2 + CO2 + H2O
При взаимодействии с водой или щелочами диспропорционирует 2ClO2 + 2KOH = KClO2 + KClO3 + H2O
Оксид хлора (IV) широко используется в качестве сильного окислителя
•ClO3 – маслообразная жидкость красного цвета ClO2 + O3 = ClO3 + O2
Энергично взаимодействует с водой и растворами щелочей, тоже диспропорционирует 2ClO3 + H2O = HClO3 + HClO4
•Cl2O7 – бесцветная маслянистая жидкость, ангидрид хлорной кислоты
2. Оксиды брома Для брома известны Br2O, BrO2 и BrO3, существующие только в атмосфере озона. Мало изучены
3. Оксиды йода
•I2O5 – белое кристаллическое в-во, ангидрид йодноватой кислоты
При нагревании выше 500◦С разлагается 2I2O5 =>300◦C 2I2 + 5O2
Сильный окислитель I2O5 + 5CO = I2 + 5CO2
•Оксиды I2O4 и I4O9 – кристаллические вещества желтого цвета

