- •Вопрос 1. Термодинамические параметры. Внутренняя энергия и энтальпия. Первый закон термодинамики.
- •Вопрос 2. Закон Гесса – основной закон термохимии. Следствия из закона Гесса.
- •1 Следствие.
- •Вопрос 4. Энергия Гиббса. Уравнение Гельмгольца-Гиббса: энтальпийный и энтропийный факторы. Критерии самопроизвольного протекания химического процесса.
- •Вопрос 5. Скорость химической реакции. Кинетическое уравнение. Факторы, определяющие скорость химической реакции
- •4) Природа реагентов
- •5) Площадь соприкосновения твердого вещества Вопрос 6. Химическое равновесие. Константа равновесия. Принцип Ле Шателье, примеры.
- •Вопрос 7. Растворы: разбавленные, концентрированные, насыщенные, ненасыщенные, перенасыщенные. Способы выражения концентрации растворов. Эквивалент. Закон эквивалентов.
- •Вопрос 8. Свойства растворов неэлектролитов. Давление пара над растворами. Закон Рауля. Температуры кипения и замерзания растворов. Осмотическое давление
- •Вопрос 10. Растворы слабых электролитов. Константа диссоциации. Ступенчатый характер электролитической диссоциации. Смещение ионных равновесий в растворах слабых кислот и оснований.
- •Вопрос 11. Ионное произведение воды. Водородный и гидроксильный показатели. Буферные растворы: их состав, расчет ph
- •Вопрос 12. Электролитическая диссоциация комплексных соединений в растворах. Константы образования и нестойкости. Разрушение комплексных соединений
- •Вопрос 13. Гидролиз солей. Основные типы гидролиза. Обратимый гидролиз. Необратимый гидролиз
- •Вопрос 14. Количественные характеристики гидролиза солей (степень гидролиза, константа гидролиза). Вывод формул констант гидролиза, примеры. Влияние различных факторов на степень гидролиза солей.
- •Вопрос 15. Равновесие между раствором и осадком малорастворимого электролита. Константа растворимости Ksp. Условия растворения и образования осадков
- •Вопрос 16. Основные положения квантовой механики: корпускулярно-волновой дуализм, уравнение Шредингера, принцип неопределенности Гейзенберга.
- •Вопрос 22. Природа связи в комплексных соединениях по методу вс. Геометрия комплексных ионов. Магнитные свойства.
- •Вопрос 23. Химическая связь в комплексных соединениях. Понятие о теории кристаллического поля. Параметр расщепления. Спектрохимический ряд лигандов
- •Вопрос 24. Основные типы геометрических форм молекул. Использование теории гибридизации для прогнозирования геометрической формы молекулы.
- •28 Вопрос. Межмолекулярные взаимодействия: ориентационное, индукционное, дисперсионное и их природа. Энергия межмолекулярного взаимодействия
- •29 Вопрос. Окислители и восстановители, часто применяемые в химической практике. Влияние pH, температуры, концентрации реагентов и их природы на протекание овр.
- •Вопрос 30. Электродные потенциалы металлов. Факторы, определяющие положение металла в активности металлов. Уравнение Нернста.
- •31 Вопрос. Общая характеристика p-элементов VII группы. Получение галогенов, их свойства. Соединения галогенов с водородом. Вопрос 32. Галогены. Методы получения, химические свойства простых веществ.
- •Вопрос 36. Кислород. Методы получения, физические свойства. Химические свойства кислорода. Соединения (оксиды, пероксиды, надпероксиды). Получение, свойства.
- •Вопрос 37. Пероксид водорода. Получение и химические свойства. Пероксикислоты и их соли (строение, получение, свойства).
- •Вопрос 38. Соединения серы с водородом и кислородом (получение и свойства). Тиосульфат натрия (строение, получение, свойства).
- •I. Сульфид водорода (сероводород) h2s и сульфиды
- •Вопрос 40. Серная кислота. Методы получения. Химические свойства
- •Вопрос 43. Общая характеристика элементов V группы. Строение атомов. Степени окисления. Отношение простых веществ к кислотам.
- •Вопрос 45. Соединения азота с водородом: аммиак, гидразин, гидроксиламин, азотоводородная кислота. Кислотно-основные и окислительно-восстановительные свойства.
- •1. Аммиак
- •2 . Гидразин
- •3. Гидроксиламин
- •Вопрос 48. Соединения фосфора с металлами, водородом, кислородом, галогенами (получение и химические свойства)
- •1. Соединения фосфора с металлами
- •2. Соединения фосфора с водородом
- •3. Галогениды фосфора
- •Вопрос 49. Соединения мышьяка, сурьмы, висмута (оксиды, гидроксиды, галогениды, сульфиды). Получение и свойства этих соединений
- •Вопрос 50. Галогениды азота, фосфора, мышьяка, сурьмы, висмута. Получение. Характер связи элемент-галоген. Гидролиз галогенидов. Галогениды азота
- •Вопрос 51. Оксиды p-элементов группы IV. Изменения кислотно-основных и окислительно-восстановительных свойств в зависимости от природы элемента.
- •Вопрос 52. Углерод. Аллотропия, типы гибридизации. Оксиды углерода. Угольная кислота и ее соли.
- •Вопрос 53. Кремний. Степени окисления. Свойства кремния. Диоксид кремния. Кремниевые кислоты и их соли
- •Вопрос 54. Олово и свинец. Их химическая активность. Гидроксиды, галогениды, сульфиды этих элементов. Свинцовый сурик
- •Вопрос 55. Хром. Строение атома, степени окисления. Оксиды, гидроксиды, соли, комплексные соединения.
- •Вопрос 56. Марганец. Строение атома, степени окисления. Оксиды, гидроксиды, соли. Перманганат калия
- •Вопрос 57. Железо, кобальт, никель. Строение атомов, степени окисления. Их отношение к кислотам. Оксиды, гидроксиды, соли, комплексные соединения этих элементов
- •Вопрос 58. Общая характеристика d-элементов группы I (медь, серебро, золото). Их степени окисления. Химические свойства металлов. Оксиды, гидроксиды, соли этих металлов
- •Вопрос 59. Общая характеристика d-элементов II группы. Их оксиды, гидроксиды, соли, комплексные соединения. Химические свойства этих соединений
Вопрос 24. Основные типы геометрических форм молекул. Использование теории гибридизации для прогнозирования геометрической формы молекулы.
Условимся представлять молекулы в виде AXn, где A – центральный атом, X – лиганды в количестве n. В соответствии с такой концепцией гибридизации геометрическая форма частицы определяется типом гибридизации центрального атома. Необходимо иметь в виду, что: а) Тип гибридизации центрального атома определяется только числом σ-связей б) π-связи не влияют на геометрическую форму молекулы в) Если гибридизированные орбитали содержат электронные неподеленные пары, то форма молекулы может отличаться от соответствующей этой форме гибридизации. Так, например, атом кислорода в молекуле воды имеет sp3-гибридизацию, но молекула имеет угловую форму – на двух из четырех гибридизированных орбиталях размещены неподеленные электронные пары кислорода
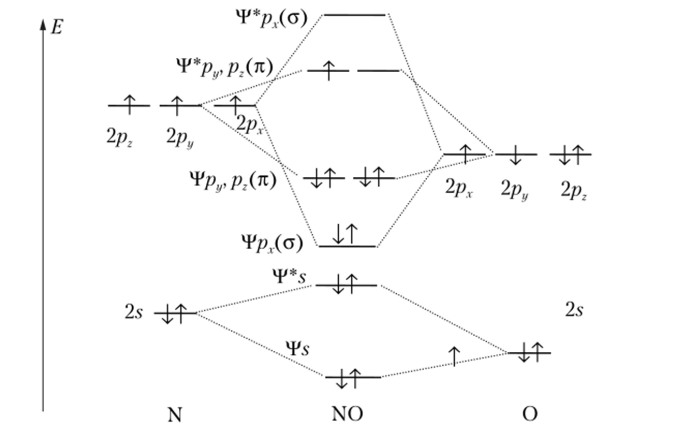
Вопрос 25. Основные положения метода молекулярных орбиталей (ММО). Порядок заполнения молекулярных орбиталей. Условия устойчивости молекул. Кратность связи в ММО. Вопрос 26. Метод молекулярных орбиталей (ММО). Энергетические диаграммы гомоядерных молекул (N2, О2, F2). Порядок связи, магнитные свойства этих молекул. 27 Описание химической связи методом молекулярных орбиталей. Энергетические диаграммы гетероядерных молекул (NO, HF). Понятие о несвязывающих молекулярных орбиталях.
Основные положения метода молекулярных орбиталей
В методе молекулярных орбиталей волновая функция рассматривается как комбинация волновых функций всех электронов и всех атомов молекулы.
Для
описания волновой ф-ии можно использовать
разные подходы, но наиболее популярным
является метод молекулярных орбиталей
- линейная комбинация атомных орбиталей
(МО ЛКАО). В этом случае молекулярная
орбиталь представляется линейной
комбинацией атомных орбиталей. Волновые
ф-ии, описывающие состояние электрона
в молекуле, называются молекулярными
орбиталями. Совокупность МО определяет
электронную конфигурацию молекулы.
Волновая ф-ия молекулы строится из
волновых функций отдельных электронов.
По форме МО близки к АО.
 Из
схемы видно, что энергия связывающей
МО должна быть ниже энергии атомных
орбиталей, в любом другом случае молекула
не может быть устойчивой.
Подведем
некоторые итоги:
- атомные орбитали
могут комбинировать с образованием
молекулярных орбиталей
- при комбинации
двух атомных орбиталей возникают две
молекулярные орбитали – связывающая
и разрыхляющая. Если комбинируются n
атомных орбиталей, то число молекулярных
орбиталей тоже будет равно n.
-
энергия связывающих орбиталей должна
быть меньше энергии разрыхляющих
орбиталей и энергии исходных атомных
орбиталей
Из
схемы видно, что энергия связывающей
МО должна быть ниже энергии атомных
орбиталей, в любом другом случае молекула
не может быть устойчивой.
Подведем
некоторые итоги:
- атомные орбитали
могут комбинировать с образованием
молекулярных орбиталей
- при комбинации
двух атомных орбиталей возникают две
молекулярные орбитали – связывающая
и разрыхляющая. Если комбинируются n
атомных орбиталей, то число молекулярных
орбиталей тоже будет равно n.
-
энергия связывающих орбиталей должна
быть меньше энергии разрыхляющих
орбиталей и энергии исходных атомных
орбиталей
Порядок заполнения МО. Устойчивость молекул
Основные принципы заполнения МО аналогичны описанным ранее принципам заполнения АО (правило Хунда, принцип Паули, принцип наименьшей энергии). Порядок заселения МО должен быть таким, чтобы при данном числе электронов обеспечивалась минимальная энергия молекулярной системы. Орбитали с одинаковой энергией заполняются последовательно по электрону на каждую.
Размещение электронов на связывающих орбиталях стабилизирует молекулу, а на разрыхляющих – наоборот, делает связи менее прочными.
Условие устойчивости молекул: молекула будет устойчивой только тогда, когда сумма электронов на связывающих орбиталях превышает сумму электронов на разрыхляющих.
Удаление
электрона (ионизация молекулы) с
разрыхляющей орбитали стабилизирует
молекулу, и наоборот, если электрон
удаляется со связывающей орбитали, то
молекула дестабилизируется (энергия
связи уменьшается).
При ионизации
молекулы удаляется электрон с высшей
по энергии заселенной орбитали.
 В
методе МО понятие «ковалентность»
заменяет понятие «порядок связи» или
«кратность связи». Рассчитывается по
формуле
В
методе МО понятие «ковалентность»
заменяет понятие «порядок связи» или
«кратность связи». Рассчитывается по
формуле
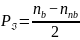 .
Порядок связи в устойчивой молекуле
должен быть больше нуля
.
Порядок связи в устойчивой молекуле
должен быть больше нуля
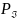 ≥ 0. В отличие от ковалентности, порядок
может быть как целой величиной, так и
дробной. Прочность связи увеличивается
при возрастании порядка связи.
≥ 0. В отличие от ковалентности, порядок
может быть как целой величиной, так и
дробной. Прочность связи увеличивается
при возрастании порядка связи.
Магнитные свойства молекул определяются наличием неспаренных электронов на МО. Молекулы, имеющие неспаренные электроны – парамагнитны, а не имеющие – диамагнитны.
Энергетические диаграммы гетероядерных двухатомных молекул элементов I и II периодов.
Ряд
отличий от диаграмм гомоядерных
молекул:
1) Энергетические уровни
атомов, образующих молекулу, различны.
Для оценки их положения на диаграмме
можно использовать потенциалы ионизации.
Чем больше потенциал (энергия ионизации),
тем ниже на диаграмме будут расположены
орбитали элемента.
Тот,
кто забирает электроны – ниже, кто
отдает – выше
 2)
Общее число молекулярных орбиталей
отличается за счет присутствия
несвязывающих орбиталей. Несвязывающими
называют
орбитали, энергия которых практически
равна энергии комбинируемых атомных
орбиталей. Фактически несвязывающие
орбитали являются неподеленными
электронными парами всяких орбиталей,
которые не принимают участия в образовании
связи. Сколько
у нас неподеленных орбиталей тех
подуровней, что не принимают участия в
образовании общей орбитали, столько
несвязывающих орбиталей и даст этот
элемент.
3)
Число МО не равно общему числу АО как
раз из-за несвязывающих орбиталей
Примеры:
2)
Общее число молекулярных орбиталей
отличается за счет присутствия
несвязывающих орбиталей. Несвязывающими
называют
орбитали, энергия которых практически
равна энергии комбинируемых атомных
орбиталей. Фактически несвязывающие
орбитали являются неподеленными
электронными парами всяких орбиталей,
которые не принимают участия в образовании
связи. Сколько
у нас неподеленных орбиталей тех
подуровней, что не принимают участия в
образовании общей орбитали, столько
несвязывающих орбиталей и даст этот
элемент.
3)
Число МО не равно общему числу АО как
раз из-за несвязывающих орбиталей
Примеры:
1) Энергетическая диаграмма фтороводорода (и как бонус LiH)
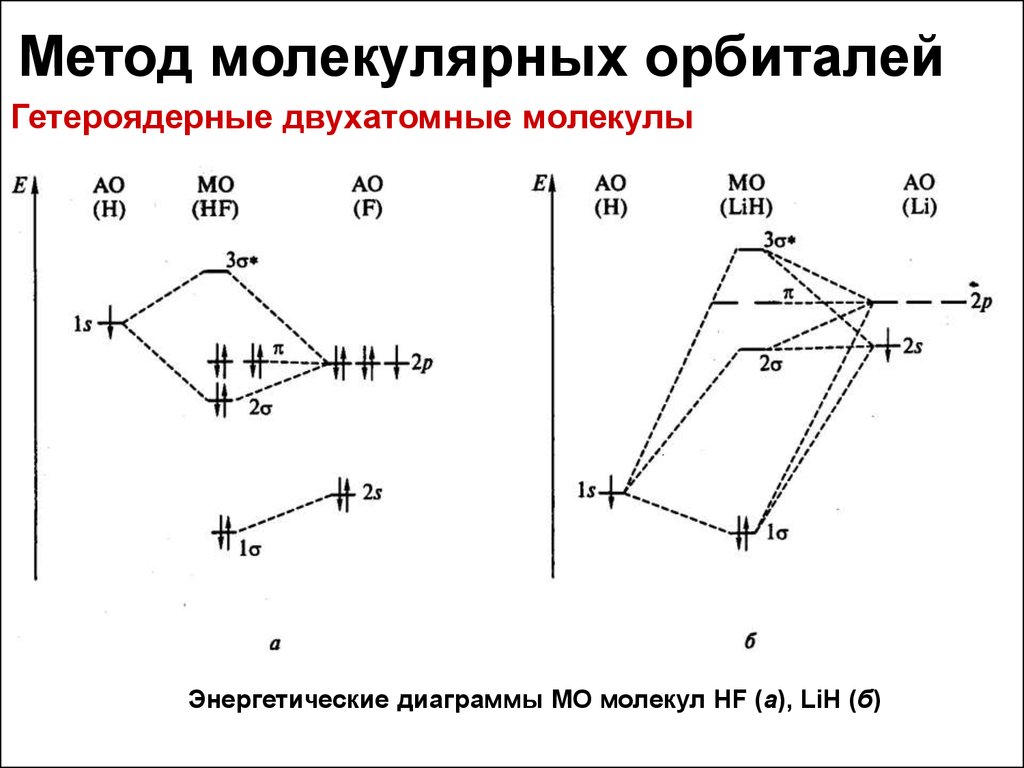 У
атома водорода лишь одна орбиталь. Она,
вместе с одной из p-орбиталей
атома фтора, образует связывающую и
разрыхляющую орбитали. Оставшиеся
s-орбиталь
и две p-орбитали
атома фтора образуют несвязывающие
орбитали и располагают на них оставшиеся
электроны. Фактически, несвязывающие
орбитали являются неподеленными
электронными парами фтора
1s-орбитали
водорода и 2s-орбитали
фтора не комбинируют в виду большой
разности в энергии.
У
атома водорода лишь одна орбиталь. Она,
вместе с одной из p-орбиталей
атома фтора, образует связывающую и
разрыхляющую орбитали. Оставшиеся
s-орбиталь
и две p-орбитали
атома фтора образуют несвязывающие
орбитали и располагают на них оставшиеся
электроны. Фактически, несвязывающие
орбитали являются неподеленными
электронными парами фтора
1s-орбитали
водорода и 2s-орбитали
фтора не комбинируют в виду большой
разности в энергии.
2)
Энергетическая диаграмма угарного
газа
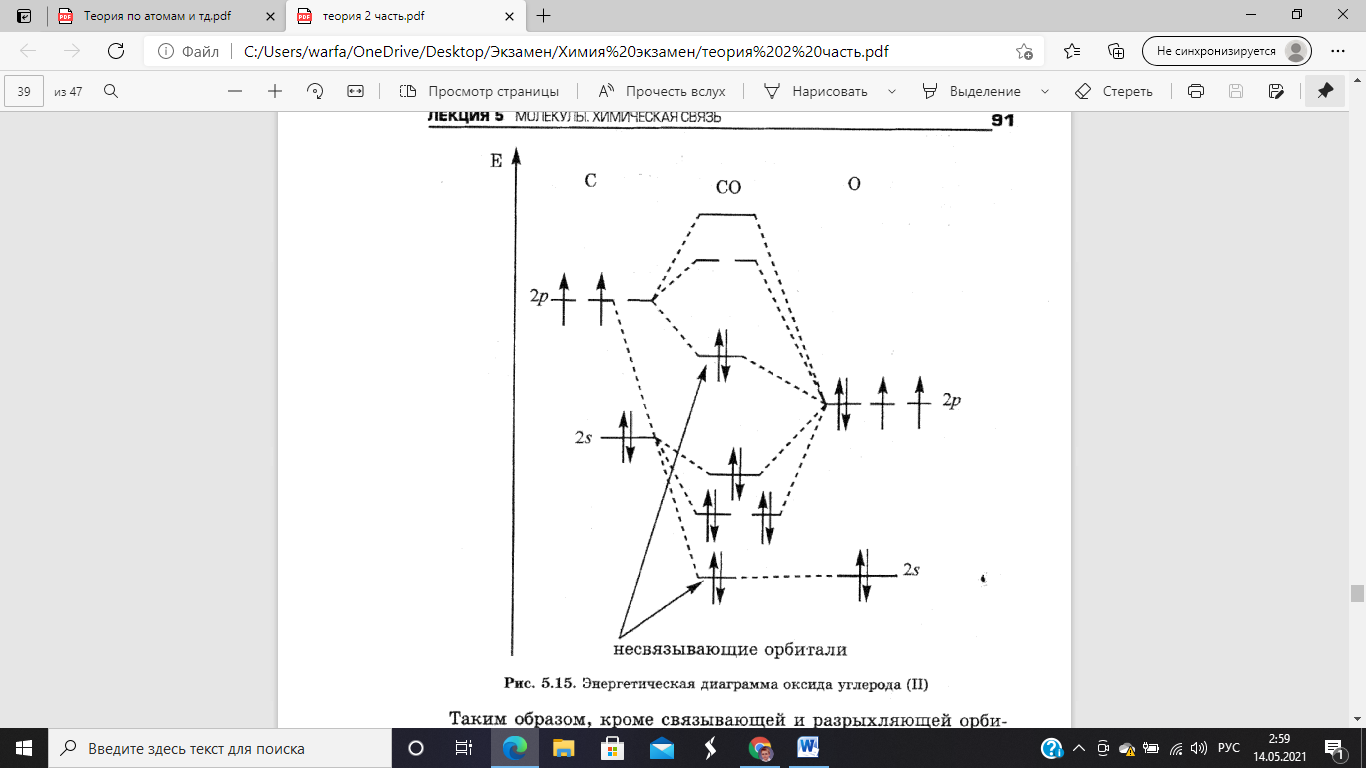
Орбитали
2s-углерода
и 2p-кислорода
комбинируют с образованием трех
связывающих орбиталей. Две p-орбитали
углерода, заселенные одним электроном
каждая, рекомбинируют в несвязывающую
орбиталь. 2s-углерода
так же образует несвязывающую
орбиталь.
Таким образом, в молекуле
CO
две несвязывающие орбитали, одна из
которых неподеленная пара электронов
кислорода, а вторая заселена неспаренными
электронами углерода. По своим свойствам
это p-орбиталь,
вытянутая в пространстве. Это свойства
делает молекулу СО хорошим лигандом. В
настоящее время известно множество
карбонилов – комплексных соединений,
включающих в свой состав молекулу СО в
качестве лиганда.
Порядок
связи гетероядерных соединений
рассчитывается так же, как и порядок
связи гомоядерных соединений.
Вот
еще NO
для запоминания: