
Швырков_Неогнестрельные переломы челюстей
.pdf
Рис.6.34. Аппарат Рудько в собранном виде.
предыдущих аппаратов; аппарат Панчохи (1961) с устройством для репозиции отломков. Аппараты указанных и многих других авторов устроены по одному принципу и имеют лишь небольшие отличия в конструктивном решении отдельных деталей. В каждом аппарате есть накостные зажимы для каждого отломка, которые с помощью винтового устройства закрепляют на теле нижней челюсти немного выше ее основания; универсальные зажимы или шарниры, создающие единую жесткую систему, соединяя накостные зажимы посредством штанги.
Аппарат Рудько состоит из накостных зажимов (клемм) в виде крючков и прижимного винта в канале каждого крючка, универсальных зажимов, соединяющих крючки со штангой, которая имитирует непрерывность нижней челюсти (рис. 6.34). Этот аппарат, созданный для остеопластики, позднее стали применять для лечения больных с линейными и оскольчатыми переломами нижней челюсти при отсутствии зубов на отломках. Для остеосинтеза сломанной нижней челюсти применяют накостные зажимы с заостренным концом крючка, что облегчает его введение в ткани через небольшой разрез мягких тканей.
Перед операцией на коже лица обозначают краской направление щели перелома, основание челюсти и место введения клемм на расстоянии 2 см от щели перелома. Под проводниковой и инфильтрационной анестезией выполняют первый линейный разрез длиной 1—1,5 см до кости вдоль основания челюсти, из его центра ведут вверх второй разрез кожи и под-
262
кожной клетчатки (до щечной мышцы) такой же длины. Мы рекомендуем Т-образный разрез, потому что очень часто мягкие ткани зажимаются между клеммами аппарата и нижней челюстью. Тупым инструментом раздвигают ткани на основании и отчасти на внутренней поверхности челюсти. Рукой или с помощью крампонных щипцов крючок накостного зажима вводят в рану и перемещают его заостренный конец на внутреннюю поверхность тела челюсти, обязательно добиваясь контакта с этой поверхностью и основанием челюсти. С помощью торцевого ключа завинчивают прижимной винт до плотного контакта с наружной поверхностью челюсти. Удерживая рукой отломок челюсти, покачиванием зажима проверяют прочность его фиксации на кости. Аналогичным образом закрепляют на челюсти вторую клемму. Если около зажимов сохраняются небольшие раны, их зашивают. Универсальный зажим широким каналом надевают на наружное плечо клеммы, а в узкий канал вставляют объединяющую накостные зажимы штангу. После репозиции отломков (контроль по восстановлению прикуса) гайки на каждом универсальном зажиме туго затягивают. Небольшие раны и кожу вокруг накостных зажимов прикрывают йодоформной марлей, которую заменяют через день. При необходимости накладывают швы.
Наложенный аппарат требует постоянного ухода, тщательной обработки клемм и кожи вокруг них антисептическими растворами (растворы йода, хлоргексидина и др.), так как через щелевидное пространство между зажимом и кожей возможно инфицирование мягких тканей и кости. Через 8—10 дней после операции вследствие точечных контактов заостренных участков накостных зажимов с костью и ее перегрузки в этих местах начинается резорбция костной ткани и возникает подвижность накостных зажимов. Для ее устранения торцевым ключом подтягивают прижимные винты. Однако начавшееся рассасывание костной ткани не прекращается, и винты приходится подкручивать каждые 5—6 дней и даже чаще.
Обычно аппарат снимают через 4—5 нед. Иногда же при слишком интенсивной резорбции кости на месте зажимов образуются сквозные дефекты округлой формы, аппарат и отломки становятся подвижными и аппарат приходится снимать преждевременно. Перед его удалением демонтируют универсальные зажимы и штангу. Под инфильтрационной анестезией образовавшиеся вокруг клемм рубцы иссекают, клеммы расшатывают и извлекают дугообразным движением, а рану зашивают и прикрывают асептической наклейкой.
Среди статических аппаратов особо стоят аппараты ЕК [Ермолаев И.И., Кулагов СИ., 1979] и Дацко (1988), которые в качестве элементов крепления к кости имеют не зажимы, а
263

,
Рис.6.35. Аппарат ЕК наложен на нижнюю челюсть больного с двусторонним переломом нижней челюсти.
спицы. Это выгодно отличает их от клеммовых аппаратов и по способу введения крепящих элементов (спиц), и по реакции кости на инородное тело, передающее на нее определенную нагрузку. Хорошо известно, что чрезмерная нагрузка на кость вызывает ее рассасывание. Суммарная площадь спиц, проведенных сквозь кость, больше, чем у накостных зажимов, имеющих точечный контакт с костью, поэтому давление на каждую единицу площади меньше и резорбция кости вокруг спиц возникает крайне редко. Чаще всего причинами этого являются нарушение технологии введения спиц, перегрев и ожог кости.
264
В аппарате ЕК в каждый отломок нижней челюсти вводят по одной, реже по две спицы в ряд в горизонтальной плоскости, объединяют их с помощью штанги, имеющей форму удлиненной рамки, планок и гаек (рис. 6.35).
А.А.Дацко разработал три модели аппаратов, в которых спицы вводят попарно в наружную поверхность и основание нижней челюсти, укрепляют в дугообразных планках, объединяя их либо с помощью шарнирно соединенных прямолинейных планок, либо с использованием двух параллельных дуг от аппарата Рудько и зажимов, модернизированных Ю.И.Вернадским, либо на металлическом корпусе, искривленном по усредненной величине нижней челюсти.
В конструкции аппаратов предусмотрен компрессионно-ди- стракционный узел, возможности которого, судя по описанию, автор не использовал. Даже при наличии костных дефектов он предпочитал сомнительную свободную остеопластику остеопластике местными тканями, которую можно осуществить с помощью компрессионно-дистракционного аппарата.
6.3.10.Фиксация отломков
спомощью компрессионных аппаратов
Первым в нашей стране разработал и применил в клинике компрессионный аппарат С.И.Каганович (1964). С целью укрепления аппарата в каждый отломок под углом вводят по две спицы, попарно объединяют их между собой и затем — с наружной компрессионной системой. На протяжении всего периода лечения вращением гаек производят компрессию отломков. Как показали наблюдения автора, отломки срастались, однако постоянная компрессия приводила к укорочению поврежденной половины челюсти, нарушению окклюзии и деформации лица больного. Аналогичные осложнения были опи-
саны Г.Г.Мингазовым (1978), R.Becker (1974), J.Hartel (1975).
С целью создания компрессии отломков М.М.Соловьев и Е.Ш.Магарилл (1966) модифицировали аппарат Рудько, укрепляя на накостных зажимах специальное компрессирующее устройство — тальреп (рис. 6.36).
Компрессионный аппарат, разработанный А.А.Колмаковой (1970), был очень прост по устройству и состоял из двух шурупов с уплощенными поверхностями на месте головок, в каждой из которых имелось по два отверстия. Эти шурупы ввинчивали в каждый отломок и соединяли с помощью двух коротких штанг с резьбой, вводимых в отверстия на шурупах. Вращением гаек на штангах создавали компрессию отломков. Скрепление отломков у экспериментальных животных (собаки) было недостаточно прочным, о чем говорит энхондральный остеогенез в
265
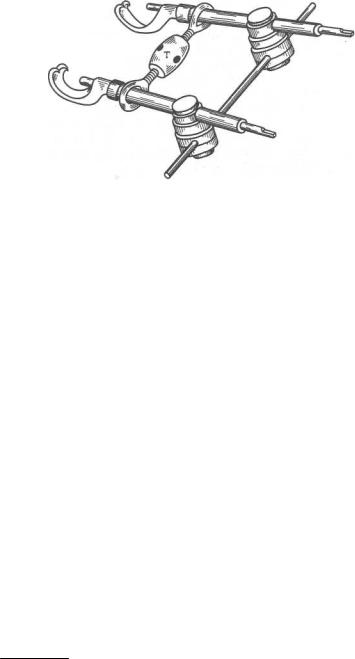
Рис.6.36. На клеммы аппарата Рудько наложен тальреп (обозначен буквой Т), позволяющий создавать компрессию отломков.
щели перелома. Как указывалось выше (см. раздел 6.3.9), постоянное чрезмерное давление на кость резко интенсифицирует резорбтивные процессы, поэтому длительная компрессия (сдавливание) концов отломков аппаратом вызывает значительную убыль костной ткани и укорочение кости. В настоящее время компрессию используют кратковременно (7—10 сут) и лишь как способ запуска (пусковой механизм) репаративнои регенерации кости. В дальнейшем приступают к дистракции (растяжению) новообразованной костной мозоли для прекращения резорбции и поддержания репаративного остеогенеза на высоком уровне, о чем пойдет речь в следующем разделе.
6.3.11. Остеосинтез с помощью компрессионно-дистракционных аппаратов
Теоретические основы компрессионно-дистракционного* остеосинтеза были заложены биологом Л.В.Полежаевым в 1939 г. В опытах на амфибиях он производил ампутацию кисти конечности.
В контрольной группе раны заживали с образованием культи. У животных опытной группы он осуществлял дозированное микроразрушение иглой возникшей ампутационной бластемы, что приводило к восстановлению всей четырехпалой конечности. Здесь отмечается определенное сходство с клиническими наблюдениями при компрессионно-дистракционном остеосинтезе.
Компрессия — сжатие, давление; дистракция — растяжение.
266
Роль дозированной деструкции (разрушения) в регенерации в дальнейшем неоднократно подтверждалась многими авторами. В настоящее время можно считать доказанным, что дест-
рукция и регенерация представляют собой диалектическое единство, связь между компонентами которого определяется особыми белками-регуляторами.
Пусковым механизмом репаративного остеогенеза является механическая травма кости (перелом, остеотомия), вызывающая интенсификацию физиологической остеокластической резорбции. При этом выделяются неколлагеновые белки—ре- гуляторы остеогенеза (морфогенетические белки кости, морфогены). Клетками-мишенями для морфогенетических белков кости (МБК) являются низкодифференцированные периваскулярные клетки (перициты), которые поэтапно трансформируются в препреостеобласты [Фриденштейн А.Я., Лалыкина К.С., 1973; M.R.Urist, 1984]. Эти клетки не способны строить кость, так как энергично пролиферируют, создавая огромное количество потомков. Каждый препреостеобласт, совершив около 50 делений, через ряд переходных форм превращается в остеобласт, который, наконец, начинает строить кость. При участии этих клеток через 7—10 дней образуется первичная костная мозоль, и регенерация постепенно начинает затухать, так как остеогенные клетки, замуровываясь в кость, выбывают из регенерации. Такое развитие событий можно наблюдать при нормальной консолидации закрепленных или незакрепленных костных отломков после перелома (или остеотомии) нижней челюсти.
Совершенно другая картина наблюдается при использовании компрессионно-дистракционных аппаратов. МБК, о которых шла речь выше, названы регуляторами короткодистантного действия, так как их влияние распространяется лишь на 400—500 нм от места выделения. Отсюда становится понятной необходимость создания компрессии отломков, которая, с одной стороны, уменьшает расстояние между отломками, приближая его к оптимальному для воздействия этих белков-регу- ляторов, а с другой стороны, способствует рассасыванию кости и дополнительному выходу из нее этих белков. Как было показано недавно, остеоиндуктивные факторы в костной ткани заблокированы специфическим ингибитором, препятствующим их взаимодействию с клетками-мишенями [Сумароков Д.Д., Швырков М.Б., Шамсудинов А.Х. и др., 1988]. Поэтому обязательным условием выделения остеоиндуктивных факторов как in vitro, так и in vivo является деминерализация кости, происходящая при компрессии и сопровождающаяся удалением ингибитора остеоиндукции. Дистракция, начатая после 7— 10 дней компрессии, вызывает микроскопическое разрушение
267
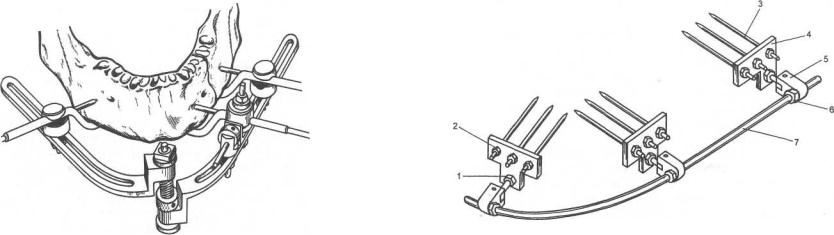
Рис.6.37. Аппарат ЕКО-1, предназначенный для компрессии и дистракции отломков нижней челюсти.
1 — гайка для крепления муфт; 2 — гайка спицы; 3 — спицы; 4 — планки; 5 — качающаяся муфта; 6 — гайка винтовой штанги; 7 — винтовая штанга.
(как в опытах Л.В.Полежаева) новообразованной (еще неминерализованной) костной мозоли и тем самым способствует выделению новых порций МБК. Они заставляют новую порцию перицитов превратиться в остеобласты. Последние построят новый участок кости, который при дистракции будет частично разрушен с выделением новых порций МБК, и весь цикл повторится снова. Таким образом, дистракция не только не дает регенерации затухнуть, но и стимулирует ее; при неограниченной во времени дистракции может быть построено неограниченное количество костной ткани. Непременным условием нормального костеобразования является прочная иммобилизация отломков кости при постоянной дистракции.
Известны компрессионно-дистракционные аппараты ЕК-1Д [Ермолаев И.И., Кулагов СИ., 1981], ЕКО-1 [Ермолаев И.И., Каганович СИ., Осипян Э.М., 1981], разработанные М.Б.Швырковым, А.Х.Шамсудиновым (1984), О.П.Чудаковым (1985).
Показания к компрессионно-дистракционному остеосинтезу:
•свежие переломы нижней челюсти;
•замедленная консолидация отломков (вследствие плохой
268
иммобилизации отломков или особенностей репаративной регенерации у больного);
•травматический остеомиелит (до или после секвестрэктомии);
•дефект нижней челюсти (травматический неогнестрель ный, огнестрельный, послеоперационный);
•ложный сустав.
Для скрепления отломков с помощью аппарата ЕК-1Д в наружную поверхность отломков вводят по одной спице, причем в больший отломок могут быть введены 2—3 спицы. Эти спицы с помощью гаек и планок объединяют прямой или дугообразной рамкой, что создает жесткую конструкцию. В случае необходимости на рамке может быть укреплено компрес- сионно-дистракционное устройство (тальреп), которое позволяет смещать отломки на расстояние до 1,5 см.
При использовании аппарата ЕКО-1 попарно под углом вводят спицы в каждый отломок нижней челюсти (рис. 6.37). Каждую пару спиц с помощью шарнирных элементов укрепляют на направляющих штангах, которые в свою очередь с помощью гаек фиксируют на двух полуосях с резьбой по всей длине. Полуоси соединены телескопически и в этом месте шарнирно укреплена подковообразная пружина, которая создает постоянную дистракцию с темпом 1 мм в сутки. Направляющие штанги можно свободно перемещать,вдоль полуосей с помощью компрессионных и дистракционных гаек. При клиническом применении аппарата [Осипян Э.М., 1982] величина устраняемых костных дефектов нижней челюсти не превышала 2 см. Конструкция аппарата ЕКО-1 позволяет репонировать смещенные отломки и прочно закреплять их на весь период сращения.
О.П.Чудаковым было сконструировано «устройство для лечения нижнечелюстных переломов», которое по сути является компрессионно-дистракционным аппаратом (рис. 6.38). Этот аппарат содержит клеммовые зажимы (как в аппарате Рудько), укрепляемые на теле челюсти через раны в поднижнечелюстной области, и муфты, которые осуществляют закрепление этих зажимов в сквозной продольной выемке на дугообразной штанге. Последняя состоит из двух равновеликих плоских дуг, образующих в месте соединения репонирующий блок, обеспечивающий репозицию отломков в сагиттальной плоскости при их смещении до 4 см. При необходимости около любой муфты может быть смонтирован компрессионно-дистракционный блок.
Экспериментальные и клинические испытания этого устройства провела А.З.Бармуцкая (1987) под руководством О.П.Чудакова. Она пришла к выводу, что темп дистракции должен быть
269
'
Рис.6.38. Устройство Чудакова для лечения нижнечелюстных переломов, с помощью которого можно производить дистракцию и компрессию отломков.
0,5 мм каждые 24 ч или 1 мм через 48 ч, начиная с 11-го дня после 10-дневной компрессии. С помощью этого устройства обеспечивается хорошая фиксация отломков в течение всего периода лечения. Однако у ряда больных возникали пролежни в кости на месте наложения зажимов, что говорит о малой площади опоры и вследствие этого чрезмерном давлении на кость. Авторы устраняли дефекты нижней челюсти длиной до
2 см.
Показания к использованию компрессионно-дистракцион- ного аппарата М.Б.Швыркова и А.Х.Шамсудинова, кроме перечисленных выше, включают неправильно срастающиеся переломы и уже сросшиеся переломы сроком до одного года после травмы (смещение отломков по длине и наложение их друг на друга), а также ложный сустав, врожденную или приобретенную деформацию нижней челюсти.
Компрессионно-дистракционный аппарат (рис. 6.39) состоит из спиц (3) с винтовой нарезкой, которые укрепляют в нижней челюсти; планок (4) различной формы, объединяющих спицы в группы; гаек (2), с помощью которых происходит соединение спиц; муфт (5) и гаек (1), которыми муфты крепят к планкам (4); винтовой штанги (7), объединяющей муфты, а следовательно, отломки челюсти; гаек (6), которыми муфты (5) прикрепляют к штанге и производят компрессию
идистракцию отломков нижней челюсти.
Взависимости от величины отломка на нем размещают одну или две группы спиц по 2—4 штуки в каждой. Группы спиц
Рис.6.39. Принципиальная схема компрессионно-дистракционного аппарата Швыркова и Шамсудинова. Объяснение в тексте.
объединяют планкой (4), выбор формы которой зависит от расположения спиц, что в свою очередь обусловлено строением кости на месте введения спиц.
Спицы вводят в наиболее толстые участки нижней челюсти, где корковые пластинки имеют значительную толщину. Так, на теле челюсти вводят 3 спицы в линию под нижнечелюстным каналом. На ветви челюсти спицы вводят в передний, наиболее толстый ее край и для уменьшения нагрузки на каждую спицу используют 3—4 спицы, объединяя их в группу с помощью крестообразной планки.
Перед операцией на коже лица краской обозначают основание челюсти, линию (линии) перелома и место введения первой (ближайшей к щели перелома) спицы на каждом из отломков. Первую спицу вводят на расстоянии 1,5 см от щели перелома. В этом месте инфильтрируют ткани до кости 2 мл раствора анестетика. Спицу зажимают в патроне электродрели или в специальной цанге, вставленной в наконечник бормашины. В месте инъекции кожу прокалывают невращающейся спицей до кости. Перед включением мотора с целью предотвращения наматывания мягких тканей на спицу ассистент прижимает кожу инструментом (гаечным ключом, пинцетом и пр.). Во избежание ожога кости и последующего «спицевого» остеомиелита скорость вращения спицы должна быть минимальной, с кратковременными, но достаточно частыми остановками.
Для удержания отломка челюсти и для контроля прохождения спицы через всю толщу челюсти хирург вводит II палец левой руки в рот больного и помещает на язычной поверхно-
270 |
271 |
|

сти в проекции вводимой спицы, а I палец в это время находится на основании челюсти. Необходимо следить за тем, чтобы спица не перфорировала слизистую оболочку язычной поверхности челюсти, но на 1 — 1,5 мм выступала из кости.
После введения первой спицы на нее надевают предварительно выбранную планку крайним отверстием к щели перелома и располагают в нужном положении. Через ближайшее к спице отверстие вводят в мягкие ткани иглу и впрыскивают раствор анестетика. Снимают планку и, ориентируясь на инъекционное отверстие на коже, вводят спицу в кость, как было указано выше. При этом хирург с одной стороны, а ассистент с другой контролируют параллельность введения второй и всех последующих спиц данной группы с первой спицей. Используя таким образом планки, вводят спицы «по месту» их крепления, что обеспечивает высокую точность и легкость надевания планки.
После введения спиц в отломки на них навинчивают по одной внутренней гайке, надевают объединяющую планку и закрепляют наружными гайками. Аналогичную процедуру выполняют на всех отломках. Постоянно следят за тем, чтобы расстояние от внутренних гаек и планки до кожи было не менее 1 см. Перед закреплением планок проверяют положение отверстий, в которых будут фиксированы муфты, а через них — и штанга: они должны находиться в одной плоскости после ручного вправления отломков.
При одиночном переломе нижней челюсти обычно достаточно двух групп спиц и одной прямой штанги. Однако фиксация отломков будет прочнее, если на большем отломке разместить две группы спиц. В случае двустороннего или двойного перелома таких групп будет уже четыре — по одной с каждой стороны от щели перелома. С целью фиксации отломков дугообразно изогнутую штангу по контуру нижней челюсти прикладывают к отверстиям для муфт двух планок и, перемещая выступ с отверстием для муфты третьей планки, добиваются их расположения в одной плоскости. Таким же образом подгоняют и четвертую планку.
Муфты фиксируют к планкам с помощью гаек и винтовую штангу поочередно пропускают через муфты. По мере введения винтовой штанги в муфты на нее навинчивают гайки из расчета по одной гайке с каждой стороны муфты. При большой кривизне штанги удобнее сначала надеть муфты и навинтить гайки, а затем укрепить муфты на планках.
После репозиции отломков гайками закрепляют муфты на штанге, что создает жесткую единую систему, имитирующую целостность нижней челюсти. Вращением гаек в сторону перелома создают компрессию отломков. Вращая гайки в противоположную от щели перелома сторону, производят дистракцию
272
Рис.6.40. Компрессионно-дистракционный аппарат Швыркова и Шамсудинова, наложенный на нижнюю челюсть больного.
костной мозоли. Этим приемом пользуются для разрыва костной мозоли при неправильно сросшихся отломках даже годовалой давности.
После репозиции таких отломков производят сильную компрессию в течение 10 дней с целью вызвать усиленную резорбцию костной ткани, добиться выхода МБК и достичь конгруэнтности поверхности концов отломков. После закрепления отломков вокруг спиц каждой группы наматывают узкие йодоформные марлевые полоски, которые в течение первой недели меняют ежедневно. При этом удаляют засохшие комочки сукровицы, кожу обезжиривают спиртом, эфиром и смазывают раствором йода.
Обычно через неделю выделения из щелевидного пространства между спицами и кожей значительно уменьшаются, и
10-348 |
273 |
|

такую обработку производят реже. Этому можно обучить больного и выписать домой с обязательной явкой на амбулатор - ный прием 2 раза в неделю. Постоянно требуется контроль за гайками, которые в случае необходимости подтягивают. После окончания лечения снимают штангу, проверяют прочность сращения отломков покачиванием их руками и, если подвижности нет, снимают планки и вывинчивают спицы. В случае обнаружения небольшой подвижности, что случается крайне редко, отломки вновь фиксируют штангой на 2 нед.
Компрессионно-дистракционный аппарат (КДА) прочно фиксирует отломки, что позволяет больному уже в ближайшие дни употреблять обычную пищу, за исключением наиболее жестких продуктов (рис. 6.40).
Аппарат создавался прежде всего для лечения раненых с огнестрельными переломами, дефектами нижней челюсти и окружающих мягких тканей. Поэтому КДА позволяет производить бескровную остеопластику нижней челюсти. Разработаны четыре способа несвободной остеопластики и один способ остеопластики местными тканями [Швырков М.Б., 1984, 1987]. С помощью КДА можно устранять костные дефекты величиной от 1 до 15 см. В процессе дистракции вместе с костным дефектом мы одновременно замещали дефекты мягких тканей — кожи, слизистой оболочки, сосудов, нервов, мышц, слюнных протоков и пр.
Огнестрельные переломы значительно сложнее неогнестрельных, и поэтому использование компрессионно-дистракцион- ного аппарата гарантирует успех при лечении больных с такими переломами.
Данные литературы и личный опыт указывают на явное преимущество спиц, используемых во всех видах аппаратов (статичный, компрессионный, компрессионно-дистракцион- ный) перед накостными зажимами. Несмотря на кажущуюся непрочность и даже хрупкость тонких спиц, с их помощью осуществляются не только компрессия и дистракция отломков нижней челюсти, но и прочная их иммобилизация в течение нескольких месяцев. Резорбции костной ткани вокруг спиц, объединенных в группы, обычно не происходит.
В последние 6—7 лет в Западной Европе и Америке активно разрабатываются компрессионно-дистракционные аппараты для нижней и верхней челюстей в основном для устранения врожденных и приобретенных деформаций, причем для устранения этих деформаций у детей предпочтение отдается внутриротовым аппаратам.
Глава 7
МЕДИКАМЕНТОЗНАЯ И ФИЗИОТЕРАПИЯ ПРИ
ПЕРЕЛОМАХ ЧЕЛЮСТЕЙ
7.1. МОРФОБИОХИМИЧЕСКИЕ И ПСИХОЛОГИЧЕСКИЕ АСПЕКТЫ РЕПАРАТИВНОЙ РЕГЕНЕРАЦИИ КОСТИ
Прежде чем приступить к обсуждению лечения больного с переломом нижней челюсти, следует напомнить, какие морфологические и биохимические изменения происходят на месте перелома, как влияют некоторые биохимически активные вещества и препараты на обменные процессы в организме и, в частности, в кости.
Нами в экспериментах на белых крысах были изучены изменения в отломках нижней челюсти при их неосложненной (нормальной) и замедленной консолидации и при травматическом остеомиелите [Швырков М.Б., Сумароков Д.Д., ТТТямсудинов А.Х. и др., 1981, 1982, 1983, 1984]. В связи с тем что в главе 8 мы будем рассматривать осложнения переломов нижней челюсти, представляется целесообразным обсудить здесь те изменения в челюсти, которые происходят при нормальной консолидации отломков. Может показаться не совсем корректным переносить их на человека, однако аналогичные изменения были обнаружены у больных при переломах нижней челюсти [Скагер А.А., 1985].
Воспаление, возникающее на месте повреждения тканей, является пусковым механизмом репаративной регенерации и одновременно направлено на борьбу с инфекцией и устранением погибших тканей. Из этих тканей выходят биологически активные вещества, под влиянием которых расширяются артериолы, венулы, капилляры, ускоряется капиллярный кровоток и повышается проницаемость капилляров. Из расширенных сосудов в окружающие ткани выходит богатый белками экссудат, а несколько позже начинается эмиграция лейкоцитов, преимущественно нейтрофилов. Чем продолжительнее нейтрофильная стадия воспаления, тем хуже для регенерации.
10* |
275 |

Дело в том, что нейтрофилы фагоцитируют только поврежденные, но не мертвые клетки. С целью повреждения микробной клетки они выделяют в окружающую среду большое количество цитотоксинов, которые способны истребить все пролиферирующие клетки, что замедляет заживление раны и приводит к образованию грубого рубца. При благоприятном течении раневого процесса примерно через сутки реакция нейтрофилов уменьшается, и на смену им приходят лимфоциты и макрофаги. Последние образуются из моноцитов крови. Макрофаг превосходит нейтрофил по типу и количеству поглощаемого материала и переваривает не только микробы, но и тканевый распад, образовавшийся на месте перелома. Преобладание макрофагальной стадии обусловливает нормотипическую регенерацию, заканчивающуюся морфогенезом, присущим конкретной ткани. Очень важным моментом является то, что макрофаг образует ангиогенный фактор, стимулирующий рост сосудов. Происходит, таким образом, подготовка места для регенерации кости, которой предшествует восстановление микроциркуляторного русла.
Для изучения микрососудистого русла регенерирующей нижней челюсти мы использовали взвесь сульфата бария, измельченного воздействием ультразвука. Эту взвесь вводили крысе, находящейся под наркозом, в общую сонную артерию. После удаления челюсти ее декальцинировали, готовили срезы, производили их рентгенографическое исследование и полученные микроангиограммы (МАГ) изучали под микроскопом [Швырков М.Б. и др., 1986]. На МАГ уже в конце первой недели был виден аваскулярный участок в месте перелома, окруженный сетью новообразованных сосудов, от которых тонкие капилляры направляются в щель перелома. На окрашенных гистологических срезах выявлено, что направление роста костных балочек в периосте и эндосте совпадает с направлением капилляров, что говорит о начале формирования интермедиарной костной мозоли. Происходит резорбция концов отломков остеокластами, которые, удаляя омертвевшие участки кости, готовят место для регенерации сосудов. Костные осколки окружены грануляционной тканью и либо атакуются остеокластами, либо подвергаются пазушному растворению с образованием «жидкой кости» [Русаков А.В., 1959]. Костный мозг умеренно отечен и инфильтрирован.
Известно, что пусковым механизмом репаративной регенерации являются резорбция концов отломков и высвобождение остеоиндукторов (морфогенетических белков кости, морфогенов — МБК), которые влияют на индуцибельную систему: полипотентные
276
клетки, перициты. Эти клетки через ряд переходных форм превращаются в препреостеобласты, которые в результате пролиферации создают огромное количество остеобластов, строящих кость на месте повреждения.
Следует особо подчеркнуть, что установлена прямая зависимость интенсивности регенерации от этой пусковой стадии [Сумароков Д.Д., Гуткин Д.В., Швырков М.Б., 1991], причем полипотентные клетки могут дифференцироваться по остеогенному (либо хондрогенному, либо фиброгенному) пути. Дифференцировка в остеогенные клетки прямо зависит от оксигенации тканей, т.е. от степени восстановления микроциркуляторной сети в месте перелома. При быстром восстановлении микроциркуляции в зоне перелома костные балочки энергично растут вдоль капилляров от каждого отломка навстречу друг другу и соединяют их — происходит нормальная консолидация отломков по ангиогенному типу. Таким образом, при нормальной консолидации максимум изменений в отломках происходит в первую неделю, которая и определяет исход перелома нижней челюсти.
Построение новой кости начинается с синтеза остеобластами коллагенового матрикса. Для этого остеобластам, кроме аминокислот, требуется достаточное количество кислорода, витамина С, а-кетоглутаровой кислоты и железа. Быстрое восстановление микроциркуляторной сети позволяет в ближайшее время доставить к месту перелома необходи - мые органические и минеральные компоненты. Кроме того, с врастанием капилляров появляются новые порции перицитов, которые после трансформации пополняют пул остеобластов.
И действительно, уже в течение первых 2 нед после перелома восстанавливаются непрерывность сосудистой сети и костная структура нижней челюсти, что мы обнаружили с помощью МАГ. Резорбтивная активность остеокластов значительно снижена, а костная мозоль образуется столь энергично, что в нее замуровываются костные осколки с погибшими остеоцитами. При этом формирование костной мозоли беспорядочным нагромождением костных балок напоминает аварийное заделывание пробоины на корабле и демонстрирует стремление организма любым путем реставрировать непрерывность поврежденного органа на всех уровнях.
Создавая внеклеточный костный матрикс, остеобласты синтезируют не только коллаген и гликозаминогликаны, но и неколлагеновые белки, в том числе костные факторы роста, остеонектин и остеокальцин. Образованный остеонектин запускает следующий этап остеогенеза — минерализацию органи-
277

ческого матрикса кости. В результате этого процесса остеобласты замуровываются в кость и превращаются в остеоциты.
Синтезируемый остеобластами остеокальцин повторно стимулирует миграцию и активацию остеокластов на заключительном этапе репаративной регенерации. Остеокласты, резорбируя кость, высвобождают морфогенетический белок кости, который стимулирует остеогенез. В дальнейшем происходит спокойное и планомерное ремоделирование созданных в экстремальных условиях сосудистого и костного регенератов, придание им органоспецифической архитектоники, свойственной только нижней челюсти данного субъекта. Ведущим в этом процессе, безусловно, является сосудистый компонент.
Установлено, что потенциальная остеоиндуктивная активность кости у разных индивидов (крыс) различна и представляет вариационный ряд [Сумароков Д.Д., 1988]. В нижних пределах этого вариационного ряда находятся 25 % животных с врожденной сниженной потенциальной остеоиндуктивной активностью кости, что является причиной посттравматических осложнений. В верхних пределах этого вариационного ряда располагаются также 25 % животных с врожденной высокой потенциальной остеоиндуктивной активностью кости. У этих животных репаративная регенерация проходит без осложнений.
В середине вариационного ряда у 50 % животных репаративная регенерация может не осложниться, но возможны и осложнения при определенных неблагоприятных обстоятельствах. Эти экспериментальные данные удивительным образом совпадают со статистическими данными, полученными в клинике у больных. Количество осложнений при переломах нижней челюсти колеблется от 15 до 30 %. Можно предположить, что такой же генетически запрограммированный вариационный ряд существует и для мягких тканей.
Еще одним подтверждением генетической зависимости характера репаративной регенерации являются данные, полученные при сопоставлении психического статуса больного и исхода перелома
нижней челюсти [Швырков М.Б. и др., 1985]. Известно, что по психическому статусу, данному человеку природой и являющемуся постоянным, как, например, группа крови, независимо от сиюминутного настроения люди могут быть поделены на интравертов и экстравертов, среди которых выделяют лиц с преобладанием эмоциональной устойчивости (стабильные) или лабильности (невротики). Нами установлено, что интраверты в 2,3 раза чаще получают переломы нижней челюсти, чем экстраверты; у них же чаще развиваются острые воспалительные процессы в мягких тканях, требующие вскрытия гнойников (р<0,01). Травматический остеомиелит возникает у каждого третьего интраверта и лишь у каждого десятого экстра-
278
верта. Среди интравертов это осложнение перелома в 2 раза чаще встречается у невротиков, а среди экстравертов — в 2 раза чаще у стабильных.
Из сказанного ясно, что генетически запрограммированный психический статус является индикатором, который указывает на особенности обмена веществ, состояние иммунной системы и, в частности, характер репаративной регенерации кости. Он может использоваться для прогнозирования течения перелома нижней челюсти.
Репаративная регенерация предопределяется двумя факторами: генетическим и эпигенетическим. Известно, что скорость регенерации тканей генетически жестко лимитирована в неболь-
ших пределах. Так, для синтеза молекулы коллагена требуется от 4 до 11 ч. Если синтез молекулы прекратится раньше, она будет неполноценной и подвергнется разрушению внутри клеток или тканевыми протеазами вне клетки. На современном
уровне развития науки невозможно выйти за пределы, разрешен-
ные генотипом. Невозможно повысить скорость синтеза молекулы коллагена и сократить время этого процесса; невозможно ускорить сращение отломков. Возможно лишь оптимизировать этот процесс, создав идеальные условия для его прохождения через эпигенетический фактор.
Эпигенетический фактор слагается из многих составляющих: гормональный статус, интенсивность резорбции кости, обеспеченность клеток строительным материалом, витаминами и кислородом, прочность иммобилизации отломков и многое другое. Эпигенетический фактор весьма вариабелен и вполне доступен внешним воздействиям, поэтому имеется реальная возможность создания оптимальных условий для прохождения метаболических процессов в клетке. Это позволит клетке синтезировать необходимые вещества в максимально короткие сроки, заложенные в генотипе.
7.2. ФАРМАКОЛОГИЧЕСКИЕ ПРЕПАРАТЫ, ВЛИЯЮЩИЕ НА РЕПАРАТИВНЫЙ ОСТЕОГЕНЕЗ
Представляют интерес биологически активные вещества и препараты, участвующие в репаративной регенерации кости, регулирующие и оптимизирующие ее. Не касаясь всех участников этого процесса, отметим лишь те, использование которых оправдано и возможно в клинических условиях.
Гормоны. Паратиреоидин (паратиреоидный гормон, паратгормон, паратиреокрин, паратирин, ПТГ) секретируется около-
279

щитовидными железами. Потомки мезенхимальных клеток, реализовавшие свои остеогенные потенции (остеоциты), находятся под контролем ПТГ. Он также увеличивает активность остеокластов. На остеокласты ПТГ действует через Са-зависи- мые рецепторы. Под его влиянием в остеокластах усиливается синтез лактата, цитрата и гиалуроновой кислоты, повышается активность коллагеназы, карбоангидразы, кислой фосфатазы, лизосомальных гидролаз, что повышает остеолитическую активность клеток. Это сопровождается повышением концентрации Са в сыворотке крови.
Таким образом, применение ПТГ сразу же после перелома способствует усиленной резорбции кости, очищению костной раны и высвобождению морфогенетических белков кости. Введение же его в поздние сроки будет препятствовать репаративной регенерации.
Кальцитрин (тирокальцитонин, кальцитонин, КТ) секретируется С-клетками щитовидной железы.
Кальцитонин стимулирует дифференцировку полибластов в фибро- и остеобласты, потенцируя, таким образом, интрамембранозный, но не энхондральный остеогенез.
Однако рецепторы к КТ находятся не на остеобластах, а на остеокластах, торможение активности которых сопровождается снижением резорбции костной ткани и концентрации ионов Са в крови. Это влияние гормона на остеокласты длится всего 3—4 дня, и позже клетки становятся нечувствительными к экзогенному КТ. Именно поэтому длительные курсы КТ нецелесообразны.
Многие исследователи считают, что КТ в ранние сроки после перелома (3—8-й день) дает наибольший эффект. Из сказанного ясно, что применение КТ в поздние сроки неэффективно.
Анаболический стероид ретаболил оказывает слабое вирили-
зирующее действие, но обладает сильным и длительным анаболическим эффектом. Он стимулирует репаративную регенерацию кости, что может быть связано со стимуляцией выработки полипептидных факторов роста. Известно, что к активным биосинтезам способны клетки, завершившие дифференцировку.
Поэтому введение ретаболила рациональнее начинать тогда, когда подавляющее большинство клеток окажется именно в этой фазе репаративной регенерации, т.е. через 1,5—2 нед с момента перелома.
280
Витамины. Витамин А (ретинола ацетат), одним из действу-
ющих начал которого является ретиноевая кислота, регулирует пролиферацию и дифференцировку клеток. Он определяет межтканевые взаимодействия, предположительно лежащие в основе остеоиндукции, регулирует синтез гликопротеидов (и, возможно, МБК, принадлежащего к этой группе), увеличивает остеоиндуктивную активность костного матрикса, ингиби-рует перекисное окисление липидов и стимулирует активность макрофагов.
Следовательно, назначение витамина А показано на ранних стадиях репаративной регенерации и при наличии воспаления с преобладанием высокой нейтрофильной активности, которая сопровождается значительным разрушением окружающих тканей.
Витамин D стимулирует синтез остеокальцина и морфогенетического фактора, участвует в регуляции клеточной активности кости на разных этапах жизненного цикла клеток. Воздействие его на костную ткань зависит от соотношения метаболически активных дериватов, особенно 1,25- и 24,25-(ОН)2-Dr При достаточном количестве витамина D3 в организме преобладает дериват 1,25-(OH),-D3 (кальцитриол), при его недостатке — дериват 24,25-(OH)2-D3. Кальцитриол усиливает синтез Са-связывающего белка в кишечнике, что повышает транспорт ионов Са через его стенку в кровь, увеличивает количество остеокластов и стимулирует резорбцию старой кости, усиливает реабсорбцию Са и Р в почечных канальцах. Возникающая под действием кальцитриола гиперкальциемия подавляет секрецию ПТГ и стимулирует выработку КТ.
Кальцитриол, таким образом, создает условия для минерализации новообразованной кости, которая начинается через 2 нед после перелома. Это особенно интересно, если учесть, что имеются данные о I стимулировании кальцитриолом остеоиндуктивной потенции кости [Сумароков Д.Д., 1988].
Механизм действия 24,25-(OH)2-D3 изучен мало. Существуют данные, что он усиливает синтетическую активность остеобластов — синтез органического матрикса [Спиричев В.Б., Исаев В.А., 1984]. Совокупное действие всех дериватов витамина D — омоложение костной ткани.
Витамин С (аскорбиновая кислота) является косубстратом в
реакциях гидроксилирования, особенно активно протекающих в печени, почках, надпочечниках и соединительной ткани. В печени и почках эти процессы протекают в микросомах и служат для дезинтоксикации как эндо-, так и экзотоксинов. Ко-
281
