
- •Лабораторная работа №26
- •II. Алгоритм процесса кибернетического моделирования
- •III. Одночастевая математическая модель фармакокинетики
- •Структурная схема одначастевой модели введения препарата в орган
- •II. Двухчастевая модель непрерывной инфузии в кровь
- •Структурная схема двухчастевой модели введения препарата в кровь
- •Порядок выполнения работы
- •2. 1-Ый метод – однократное внутривенное введение препарата
- •3. 2-Ой метод – непрерывное внутривенное введение препарата
- •4. 3-Ий метод – периодическое внутривенное введение препарата
- •5. Сочетание 1-го и 2-го способов
- •6. Сочетание 3-го и 2-го способов
- •Варианты заданий Вариант № 1
III. Одночастевая математическая модель фармакокинетики
а) Метод однократного введения препарата в орган
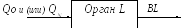
Рис. 1.
Структурная схема одначастевой модели введения препарата в орган
Терапевтический эффект препарата зависит от его концентрации и времени пребывания в действующей концентрации. Изменение концентрации dLпрепарата в органепропорциональноего концентрацииLи промежутку времени, за который происходит изменение:
dL= – BLdt,(1)
где B- коэффициент скоростивыведенияпрепарата из органа. Решение этого уравнения имеет вид убывающей экспонентыL(t) = L0exp(–Bt)(L0– начальная концентрация), график которой представлен кривой 1 на рис.2.
б) Метод непрерывного введения препарата
Дифференциальное уравнение такой системы (см. рис.1):
dL/dt = QN – BL,(2)
где QN- скорость введения препарата.
Решение уравнения (2) имеет вид возрастающей экспоненты (кривая 2, рис.2).

Рис. 2.
Изменение концентрации препарата в органе
Сочетанием двух методов введения, а) и б) меняя Q, можно достичь постоянной концентрации препарата в органе (кривая 3, рис.2), что часто необходимо на практике. Данные рис. 2 подтверждены экспериментально.
II. Двухчастевая модель непрерывной инфузии в кровь
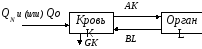
Рис. 3.
Структурная схема двухчастевой модели введения препарата в кровь
В этой структурной схеме:
QN- скорость непрерывного введения препарата в кровь,
К- концентрация препарата в крови,
А- коэффициент скорости выведения препарата из крови в орган,
B- коэффициент скорости выведения препарата из органа в кровь,
G- коэффициент удаления препарата из крови почками.
Скорость изменения концентрации препарата в крови равна:
dK/dt = – AK+BL – GK+QN. (3)
Скорость изменения препарата в органе:
dL/dt = AK – BL. (4)
Система уравнений (3)-(4) решается наиболее просто численным методом Эйлера. Величину скорости изменения концентрации препарата в органе приближенноможно вычислить как отношение приращенияL(ti+h)-L(ti)концентрации препарата к промежутку времениh, за который оно произошло (см. рис.2):
dL(ti)/dt (L(ti+h) – L(ti))/h. (5)
В пределе при h-->0выражение (5) в точности выполняется. Найдем из уравнения (5):
L(ti+h) L (ti)+h(dL(ti)/dt). (6)
Подставив уравнение (4) в (6) получим:
L(ti+h) L(ti)+h[AK(ti)– BL(ti)](7)
Аналогично выводится формула для вычислений K(ti+h):
K(ti+h) K(ti)+h[QN+BL(ti)-AK(ti)-GK(ti)] (8)
По формулам (7) и (8) и осуществляется расчет. Как видно из уравнений (7) и (8), для подсчета L(ti+h), K(ti+h) необходимо знать предыдущие значенияL(ti), K(ti) и задаться шагом по оси времениh. При различных сочетаниях значений индивидуальных коэффициентовA, B, Gрешение системы уравнений (7) и (8) приводит к различным вариантам зависимостиL(t), K(t)при разных значенияхQ0иQN.
Рассмотренные модели фармакокинетики позволяют рассчитать и подобрать оптимальную схему дозирования лекарственного препарата. Оптимальной является схема, удовлетворяющая следующим условиям:
1. Концентрация препарата в крови или органе больного после первичного приема должна достаточно быстро достигать уровня, не ниже эффективного, терапевтического значения Стер, а между приемами препарата, не стать меньше этой величины.
2. Максимальная концентрация препарата в крови или органе не должна быть больше предельной концентрации Сдоп.
Таким образом, оптимальная концентрация препарата должна быть в пределах:
Стер < Сопт < Сдоп .
Если С< Стер, то препарат мало активен или не активен, еслиС > Сдоп, то будет высока вероятность возникновения токсических явлений.
