
№1 Основные понятия, законы химии
.pdf
В последнее время в учебной литературе часто предлагается определение для молекул как мельчайших частиц, обладающих всеми химическими свойствами молекулярных веществ. Однако, как следует из законов химической кинетики, и в химические реакции молекулы не вступают по отдельности.
Например, даже разложение молекул активируется за счет соударения с другими.
При этом распадаться будут только те молекулы, которые смогут в результате
столкновений накопить достаточную для распада связей энергию.
Если речь идет о реакциях с ионным типом распада связи, то в этом случае
абсолютно необходимы поляризующие воздействия дополнительных молекул
(см. теория электролитической диссоциации). Например, молекулы уксусной кислоты диссоциируют очень по-разному в окружении других молекул СН3СООН
(самоионизация) и в водной среде:
СН3СООНaq |
Н+aq + СН3СОО‒aq |
(Кд = 1.8∙10‒5) |
СН3СООНАc |
Н+Аc + СН3СОО‒Аc |
(Кд = 2.5∙10‒13) |
Таким образом, |
приходится признать, что единственным объективным |
|
свойством отдельных молекул является их способность к движению, диффузии,
соударению с поверхностями. Именно на этих свойствах основаны разнообразные методы определения молекулярных масс, т.е. идентификация молекул:
а. Определение молекулярных масс по давлению, создаваемому молекулами в
газовой фазе ( |
|
|
|
); |
|
|
|
||
|
|
|
|
||||||
б. |
молекулярных |
|
масс по осмотическому давлению, создаваемому |
||||||
Определение ∙ |
= ∙ ∙ |
|
|
|
|
|
|||
молекулами на полупроницаемую мембрану ( осм |
|
|
); |
||||||
|
|||||||||
в. |
Определение |
молекулярных |
давления |
насыщенного пара |
|||||
масс по величине∙ = ∙ ∙ |
|
||||||||
растворителя над раствором, по температурам кипения, замерзания растворов
(см. коллигативные свойства растворов) и т.п.
41
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)

2.4 Положение немолекулярных веществах
Атомы могут связываться в очень большие полимерные ассоциаты,
которые, будучи очень крупными объектами, не могут участвовать в тепловом движении, а поэтому молекулами не являются (крупинки песка, поваренной соли,
цинковые гранулы). Так устроенные вещества называются немолекулярными33. Единицу состава таких веществ называют формульной единицей. Единицей их структуры являются цепочечные, слоистые или трехмерные (объемные) элементарные фрагменты, регулярно продолжающиеся от
"одного края" и до "противоположного края" кристаллического полимера34.
Степень полимеризованности таких соединений зависит от нескольких факторов,
важнейшими среди которых являются координационные числа (КЧ) атомов и степень ионности связей (структуры).
Координационное число атома (иона) – это число атомов (ионов), с
которыми связана рассматриваемая частица. Молекулы состоят из ограниченного количества атомов. Это обязательно означает, что атомы в их составе имеют сравнительно низкие КЧ. В молекулах практически всегда имеются атомы, КЧ которых равно единице (концевые атомы). Чем меньше таких атомов в формульной единице вещества, тем более полимеризованной становится структура. В полимерных (немолекулярных веществах) КЧ атомов наоборот высокие (много мостиковых атомов).
Степень ионности (полярности) связи зависит от электроотрицательности атомов. Чем больше разность электроотрицательностей связанных атомов, тем легче они способны перераспределить между собой часть (или все валентные электроны).
33Отдельную промежуточную группу образуют органические полимеры естественного (жиры, белки, полисахара, каучук) и синтетического происхождения (полиэтилен, фенолформальдегидные смолы, резина). Их часто называют высокомолекулярными соединениями.
34Особенности структуры неокристаллизованных гелеобразных, стекольных соединений будут рассмотрены позднее.
42
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)
Межатомная связь в этом случае становится все более полярной. Усиление
полярности (степени ионности) связей, предполагает растущую склонность к
ненаправленному (делокализованному) взаимодействию, что, в свою очередь,
предопределяет рост координационныхчисел и переход к полимерным структурам.
Например, СО и Н2О содержат атомы неметаллических элементов, которые
по электроотрицательности отличаются не так сильно, как атомы Na и Ca, с одной
стороны, и F и O - с другой (CaO, Na2O, CaF2). Поэтому оксид углерода (II) – СО
и вода – Н2О являются ковалентными молекулярными
веществами
В молекуле СО оба
атома являются концевы-
ми (КЧ = 1), оксид
углерода (II) состоит из
двухатомных молекул. В
молекуле Н2О атом
кислорода является мос-
.С
О |
. |
О.. |
|
Н Н |
|||
|
|||
|
|
тиковым (КЧ = 2), атомы |
а |
б |
водорода – концевыми (КЧ = 1), вода состоит из |
|
|
трехатомных молекул. В обычных условиях СО
представляет собой газ, т.к. соответствующие
молекулы друг к другу притягиваются плохо и
существуют обособленно. Вода является жидкостью,
т.к. молекулы Н2О способны образовывать |
|
достаточнопрочныемежмолекулярные водородныесвязи. |
в |
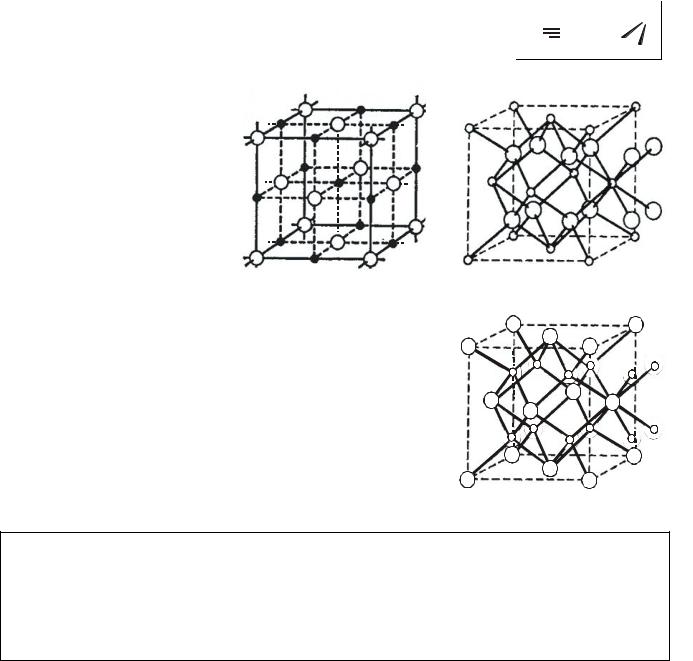
Рис.2.2 – Фрагмент структуры СаО (а) и CaF2 (б), Li2O (в). В структуре оксида кальция КЧ ионов равны 6. В кристалле CaF2 КЧ(Ca2+) = 8 (мелкие кружочки имеют кубическое окружение), КЧ(F‒) = 4 (крупные кружочки имеют
тетраэдрическое окружение). Оксид Li2O имеет "обращенную" структуру CaF2: у катионов Li+ КЧ = 4, у анионов О2‒ КЧ = 8.
43
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)

Структуры приведенных на рис.2.2, веществ полимерны, показать их "целиком" нельзя. Для полимеров принято изображать фрагмент, который передает важнейшие особенности, закономерности структуры. В данном случае кристаллы полимеризованы в трех направлениях пространства.
Связность структуры (D) ‒ число направлений пространства, в которых развивается система равноценных (или мало отличающихся по энергии) связей, объединяющих атомы в полимерные цепи (D = 1), сетки (D = 2), каркасы (D = 3).
Более подробно эти вопросы будут разобраны в ходе подробного анализа теории строения веществ, а сейчас в таблице№2.1 приведены некоторые примеры для предварительного ознакомления. Видно, что структуры соединений закономерно меняются. С увеличением порядкового номера элемента постепенно уменьшаются КЧ атомов35, уменьшается степень полимеризованности веществ:
трехмерные → сетчатые → цепочечные полимеры → соединения с молекулярной структурой.
Молекулярные и немолекулярные вещества могут иметь одинаковую (HCl ‒ NaCl (CaO)…, H2O ‒ Na2O…) или сходную стехиометрию (H2O – CaF2
(SiO2), SO2 ‒ Na2S). Но при этом нужно понимать, что формулы молекулярных веществ передают реальный состав молекул (HCl состоит из двухатомных молекул, H2O и SO2 ‒ из трехатомных). В то время как формулы полимерных соединений передают брутто состав кристаллов. Любая крупинка NaCl (CaO) состоит из колоссального числа атомов (ионов), причем, как следует из формул, катионов и анионов в структуре упомянутых кристаллов поровну (без учета
35 Координационные числа атомов в бинарном соединении АаВв связаны между собой соотношением КЧ(А)∙а = КЧ(В)∙в. Координационные числа, исходя из смысла этого понятия, могут быть только целочисленными. Если при расчете по приведенному выше соотношению получаются дробные числа, значит в данной структуре соответствующие атомы (в табл.№2.1 – это атомы кислорода в некоторых оксидах) отличаются друг от друга (неравноценны). Часть из них имеет чуть меньшее целочисленное значение КЧ, а другая часть – чуть большее и тоже целочисленное.
44
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)

Таблица №2.1 |
|
|
|
|
|
|
Краткая информация о составе и структуре |
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
некоторых соединений элементов III периода |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
(простые вещества, высшие оксиды, высшие хлориды)36 |
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
№ группы |
|
I |
|
II |
III |
|
IV |
|
|
|
V |
|
|
|
|
|
|
|
|
VI |
|
|
VII |
|
VIII |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
КЧ |
8+6 |
12 |
12 |
|
4 |
|
3 |
|
|
3 |
|
|
|
2 |
|
|
|
|
|
|
2 |
|
1 |
|
0 |
|||
|
формульная |
Na |
Mg |
Al |
|
Si |
Pчерный |
|
P4 |
|
|
|
S8 |
|
|
|
|
Sпластическая |
|
Cl2 |
|
Ar |
|||||||
|
единица |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
связность |
D = 3 |
D = 3 |
D = 3 |
D = 3 |
|
D = 2 |
|
|
D = 0 |
|
|
|
D = 0 |
|
|
|
|
|
|
D = 1 |
|
D = 0 |
|
D = 0 |
||||
|
структуры |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
8 5 |
1 |
|
8 5 |
1 |
|
4 |
1 |
|
|
4 |
|
1 |
|
|
|
8 7 |
1 |
|
|
|
КЧ |
4 |
8 |
6 |
6 |
6 |
4 |
4 2 |
4 |
4 |
4 |
|
4 |
|
|
3 1 |
4 |
|
|||||||||||
|
|
|
|
|
|||||||||||||||||||||||||
|
формульная |
Na2O |
MgO |
Al2О3 |
SiO2 |
|
2 |
|
2 |
|
3 |
|
|
3 |
|
SO3 (г) |
|
2 |
|
||||||||||
|
единица |
P2O5 |
P4O10 |
SO3 (тв) 2 |
|
|
S3O9 (ж2) |
|
Cl2O7 |
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
связность |
D = 3 |
D = 3 |
D = 3 |
D = 3 |
D = 2 |
|
D = 0 |
|
|
D = 1 |
|
|
D = 0 |
|
D = 0 |
|
D = 0 |
|
|
|||||||||
|
структуры |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
КЧ |
6 |
6 |
6 |
3 |
6 |
2 |
4 |
1 |
|
|
5 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
формульная |
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
|
|
PCl5 |
|
|
|
|
|
|
SCl6 |
|
|
Cl2 |
|
|
|||||||||
|
единица |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
связность |
D = 3 |
D = 3 |
D = 2 |
D = 0 |
|
|
D = 0 |
|
|
|
|
не известен |
|
|
D = 0 |
|
|
|||||||||||
|
структуры |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
36 Из-за ограниченности места в таблице не приведена информация о структурных модификациях ряда веществ (Ркрасный, SiO2(стишовит), γ-Al2О3, Al2Cl6). В случае фосфора, серы и их оксидов первыми упоминаются самые стабильные при комнатной температуре формы.
45
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)

незначительного дефектообразования). В кристалле Na2O катионов вдвое больше,
чем анионов, а в CaF2, SiO2 и Na2S, наоборот, вдвое больше анионов.
2.5 Положение о тепловом движении атомов и молекул
Все частицы (атомы, молекулы, ионы) находятся в непрерывном тепловом движении (по мере увеличения подвижности: вращательном,
колебательном или поступательном). Из молекулярно-кинетической теории газов, разработанной во второй половине XIXв.(Р.Клаузиус, Д.К.Максвелл,
Л.Больцман), следует, что средняя кинетическая энергия отдельной молекулы прямо пропорциональна абсолютной температуре:
|
|
кин |
= |
|
∙ ∙Т |
, |
(4) |
||
|
|
|
|||||||
|
|
|
|
|
|||||
где k – константа |
Больцмана. |
|
|
|
|||||
Е |
|
|
|
|
|||||
Учитывая, что кинетическая энергия связана со скоростью тела: |
|
||||||||
|
Екин = |
|
∙ |
молекулы ∙ , |
(5) |
||||
|
|
||||||||
получаем |
|
= |
|
|
∙ |
∙ Т |
, |
|
(6) |
|
|
|
|
|
мол |
|
|
||
т.е. при фиксированной температуре наибольшей подвижностью
(максимальными скоростями диффузии) обладают легкие молекулы водорода. Более удобный вид эти выражения приобретают, если пересчитать их на 1 моль вещества. Современное понятие моль было принято в 1971г. на
XIV Генеральной конференции по мерам и весам:
1 моль вещества ‒ это такое число его структурных единиц (атомов,
молекул, ионов), сколько атомов содержится в г углерода 12С.
Число это называется константой Авогадро: NA = 6.02∙1023моль-1.
46
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)

Из определения следует, что
= |
структ.единиц |
. |
(7) |
Если домножить числитель и знаменатель на массу отдельной молекулы (формульной единицы) вещества, то
= |
структ.единиц ∙ молекулы |
= |
вещества. |
(8) |
∙ молекулы |
|
|
Отсюда видно, что, если теперь в выражении (6) домножить числитель и знаменатель под корнем на NA, то
= |
∙ |
∙ |
∙Т |
= |
∙ ∙ Т |
, |
(9) |
|
мол ∙ |
|
|
|
|||
где R ‒ универсальная газовая постоянная, ‒ молярная масса вещества (масса одного моль вещества).
Таблица №2.2
Средняя скорость молекул некоторых газов
при 25 ºС
|
H2 |
СН4 |
N2 |
O2 |
CO2 |
|
|
|
|
|
|
веществ, г/моль |
2 |
16 |
28 |
32 |
44 |
υ, м/с |
1930 |
680 |
515 |
480 |
410 |
|
|
|
|
|
|
υ, км/ч |
6950 |
2450 |
1850 |
1730 |
1480 |
|
|
|
|
|
|
Анализом уравнений молекулярно-кинетической теории можно получить уравнения всех газовых законов. Мы же поступим иначе: покажем, как из частных газовых законов может быть получено Уравнение Клапейрона-
Менделеева.
47
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)

Таблица №2.3.
Сводная таблица частных газовых законов
|
При фиксированной температуре и |
|
|
|
|
|
Закон Бойля-Мариотта |
неизменном количестве идеального газа |
VT,ν = K1 |
∙ |
|
|
|
его объем обратно пропорционален |
|
|
||||
|
|
|
|
|
||
|
давлению. |
|
|
|
|
|
|
|
|
|
|
|
|
|
При фиксированном давлении и |
|
|
|
|
|
закон Гей-Люссака |
неизменном количестве идеального газа |
VР,ν = K2 |
∙ Т |
|||
его объем прямо пропорционален |
||||||
|
|
|
|
|
||
|
температуре. |
|
|
|
|
|
|
|
|
|
|
|
|
|
В равных объемах различных газов, |
|
|
|
|
|
|
находящихся при неизменных |
|
|
|
|
|
закон Авогадро |
температуре и давлении, находится |
VР,Т = K3 ∙ ν |
||||
равное число молекул, или при |
||||||
|
фиксированных температуре и |
|
|
|
|
|
|
давлении объем идеального газа прямо |
|
|
|
|
|
|
пропорционален его количеству. |
|
|
|
|
|
|
|
|
|
|
|
|
Если какая-то функция пропорциональна нескольким величинам в отдельности,
то она пропорциональна произведению этих величин:
V = K ∙ |
|
|
T ∙ |
или |
Р ∙ V = K |
T ∙ |
или |
Р ∙ V = R T ∙ |
. (9) |
|
|
|
|||||||||
Теперь Σ |
можно∙ ν |
определить численноеΣ ∙ ν |
значение коэффициента∙ ν |
|||||||
пропорциональности |
KΣ, |
который |
называется |
универсальной |
газовой |
|||||
постоянной (R): |
|
|
|
|
∙ |
|
|
|
|
|
|
|
|
|
|
KΣ = R = |
. |
|
|
(10) |
|
Так как по 2-му следствию из закона Авогадро 1моль идеального газа при температуре 0ºС (273К) и давлении 1атм (101.3 кПа) занимает объем 22.4 литра,
то в системе СИ
R = |
(Па)∙ . |
(м /моль) |
= |
8.3144 Дж/моль∙К. |
|
. (К) |
48 |
|
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)

Из уравнения (9) следует, что объем одного моль идеального газа (молярный объем) при любых условиях, не нарушающих идеальности, может быть рассчитан:
|
|
∙ |
, |
(11) |
тогда находим еще одну формулу |
для |
|
расчета |
количества вещества, но |
= |
|
|
|
применимую только к идеальным газам и к тем реальным, которые по межмолекулярному взаимодействию мало отличаются от идеального:
= ∙∙ = |
|
. |
(12) |
Таблица 10
Сводная таблица формул для расчета количества вещества, полученных анализом газовых законов
=структ.единиц Применима для расчета количества любых частиц
|
|
|
|
|
|
|
(тел): молекул, атомов, электронов, звезд…. |
||
|
|
|
|
|
|
|
|
|
|
= |
|
вещества |
|
Применима для расчета количества любых веществ. |
|||||
|
|
|
|
Применима для расчета количества идеального газа и |
|||||
= |
|
||||||||
|
|
|
|
|
реальных с очень слабым межмолекулярным |
||||
|
|
||||||||
|
|
притяжением. |
|
||||||
|
Варианты написания уравнения состояния идеального газа |
||||||||
|
|
|
|
|
|
|
|||
∙ = |
|
∙ ∙ |
|
P ∙ V = ν∙ R ∙T |
|
P = СМ ∙ R ∙T |
|||
49
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)

Проектное задание
Используя представления о таких атомных свойствах, как энергия
ионизации и электроотрицательность, а также учитывая характер их изменения в
периодах, предложите объяснение закономерному изменению состава и структур
простых веществ и оксидов (хлоридов), представленных в таблице №2.1.
ТЕСТ РУБЕЖНОГО КОНТРОЛЯ № 2
1.Все вещества в конечном итоге состоят из атомов,
1.но структурной единицей веществ являются молекулы
2.причем атомы являются и их структурными единицами
но структурная организация веществ различна в зависимости от
3.атомных свойств
4.а атомы, в свою очередь, состоят из протонов и электронов
2.Молекулы – это
1.мельчайшая электронейтральная частица, состоящая из двух и более связанных атомов
2.мельчайшие частицы, из которых состоят вещества в жидком и газообразном состояниях
3.частицы, которые можно полностью идентифицировать, изучая законы их движения
4.частицы, проявляющие все химические свойства молекулярных веществ
3.Молекулярные вещества от ионных можно отличить по наличию таких биохимическим свойств, как
1.запах
2.окраска
3.вкус
4.все вышеперечисленное
4.AlCl3 и Al2Cl6; CH2 и C2H4; Р2О5 и Р4О10 - это
1.соответственно, правильные и неправильные формулы
2.соответственно, неправильные и правильные формулы формулы мономерных и димерных частиц, стабильно существующих
3.при обычных условиях
4.формулы полимерной и молекулярной модификации вещества
50
Print to PDF without this message by purchasing novaPDF (http://www.novapdf.com/)
