
- •Введение
- •1. Строение атома
- •1.1. Спектры испускания
- •1.2. Теория н. Бора
- •1.3. Волновые свойства материальных объектов
- •1.4. Представление о квантовой механике
- •1.5. Характеристика состояния электрона в атоме системой квантовых чисел
- •Задачи и упражнения
- •2. Периодический закон д.И. Менделеева
- •2.1. Периодическая система элементов
- •2.2. Периодический закон и электронное строение атомов элементов
- •2.3. Примеры периодического изменения свойств
- •2.3.1. Атомные и ионные радиусы
- •Продолжение таблицы 2.3
- •Относительная сила кислот и оснований (схема Косселя)
- •2.3.2. Энергия ионизации
- •Задачи и упражнения
Продолжение таблицы 2.3
|
1 |
2 |
3 |
4 |
|
Cl5+ |
88 |
I– |
206 |
|
Cl7+ |
41 |
Ce3+ |
115 |
|
Cr6+ |
58 |
Nd3+ |
112 |
|
|
|
Lu3+ |
100 |
Периодический закон ведёт к следующим закономерностям в изменении атомных и ионных радиусов.
1) В периодах слева направо в целом радиус атома уменьшается, хотя и неравномерно, затем в конце резко возрастает у атома благородного газа.
2) В подгруппах сверху вниз происходит рост радиуса атома: более значительный в главных подгруппах и менее значительный – в побочных. Эти закономерности легко объяснить с позиции электронного строения атома. В периоде при переходе от предыдущего элемента к последующему электроны идут в один и тот же слой и даже в одну и ту же оболочку. Рас-тущий заряд ядра ведёт к более сильному притяжению электронов к ядру, не компенсируемому взаимным отталкиванием электронов. В подгруппах увеличение числа электронных слоёв и экранирование притяжения к ядру внешних электронов глубинными слоями ведёт к росту радиуса атома.
3) Радиус катиона меньше радиуса атома и уменьшается с ростом заряда катиона, например:
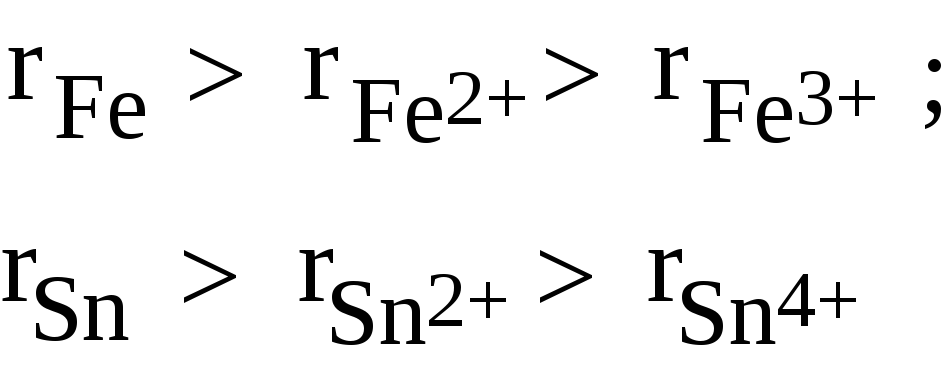
4) Радиус аниона больше радиуса атома, например:
![]()
5) В периодах радиусы ионов d-элементов одинакового заряда плавно уменьшаются, это так называемоеd-сжатие, например:
![]()
6) Аналогичное явление отмечается и для ионов f-элементов – в периодах радиусы ионовf-элементов одинакового заряда плавно уменьшаются, это так называемоеf-сжатие, например:
![]()
7) Радиусы однотипных ионов (имеющих сходную электронную “макушку”) в подгруппах плавно возрастают, например:
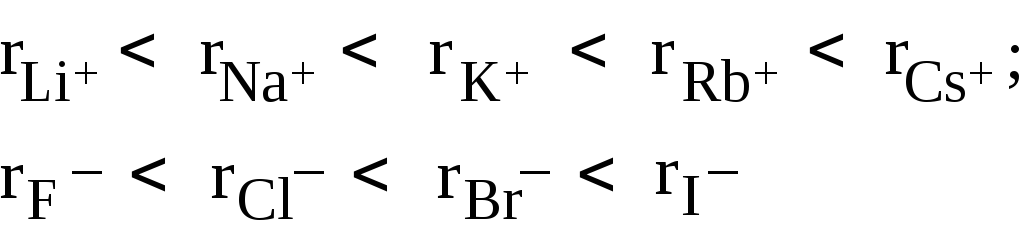
8) Если различные ионы имеют одинаковое число электронов (они называются изоэлектронными), то размер таких ионов, естественно, будет определяться зарядом ядра иона. Наименьшим будет ион с бóльшим зарядом ядра. Например, ионы Cl–,S2–,K+,Cа2+имеют одинаковое число электронов (18), это изоэлектронные ионы. Наименьшим из них будет ион кальция, поскольку у него наибольший заряд ядра (+20), а наибольшим – ионS2–, у которого наименьший заряд ядра (+16). Таким образом, вырисовывается следующая закономерность: радиус изоэлектронных ионов уменьшается с ростом заряда иона.
Относительная сила кислот и оснований (схема Косселя)
Все кислородные кислоты и основания содержат в составе своих молекул фрагмент Эn+ – О2– – Н+. Хорошо известно, что диссоциация соединения по кислотному или основному типу связана со степенью окисления (более строго, с валентностью) атома элемента. Примем, что связь в этом фрагменте чисто ионная. Это достаточно грубое приближение, поскольку с ростом валентности атома полярность его связей значительно ослабевает (см. гл. 3).
![]()
В этом жёстком фрагменте, вырезанном из молекулы кислородной кислоты или основания, место разрыва связи и диссоциация соответственно с выбросом протона или гидроксил-аниона будут определяться величиной взаимодействия между ионами Эn+и О2–. Чем сильнее это взаимодействие, а оно будет возрастать с увеличением заряда иона (степень окисления) и уменьшением его радиуса, тем более вероятны разрыв связи О–Н и диссоциация по кислотному типу. Таким образом,сила кислородных кислот будет возрастать с увеличением степени окисления атома элемента и уменьшением радиуса его иона.
Отметим, что здесь и далее более сильным из двух является тот электролит, который при одинаковой молярной концентрации в растворе имеет бóльшую степень диcсоциации. Подчеркнём, что в схеме Косселя анализируются два фактора – степень окисления (заряд иона) и радиус иона.
Например, необходимо выяснить, какая из двух кислот более сильная – селеновая H2SeO4или селенистаяH2SeO3. ВH2SeO4 степень окисления атома селена (+6) выше, чем в селенистой кислоте (+4). Одновременно радиус ионаSе6+меньше радиуса ионаSе4+. В результате оба фактора показывают, что селеновая кислота сильнее селенистой.
Еще один пример, марганцевая кислота (HMnO4) и рениевая (HReO4). Степени окисления атомовMnиReв этих соединениях одинаковы (+7), поэтому следует сопоставить радиусы ионовMn7+иRe7+. Поскольку радиусы однотипных ионов в подгруппе возрастают, делаем вывод, что радиус ионаMn7+меньше, а значит марганцевая кислота сильнее.
Ситуация с основаниями будет противоположной. Сила оснований возрастает с падением степени окисления атома элемента и увеличением радиуса его иона. Отсюда, если один и тот же элемент образует различные основания, например, ЭОН и Э(ОН)3, то второе из них будет слабее первого, поскольку степень окисления в первом случае меньше, а радиус иона Э+больше радиуса иона Э3+. В подгруппах сила однотипных оснований будет возрастать. Например, самым сильным основанием из гидроксидов щелочных металлов будетFrOH, а самым слабым –LiOH. Еще раз подчеркнём, что речь идёт о сравнении степеней диссоциации соответствующих электролитов и не касается вопроса об абсолютной силе электролита.
Используем этот же подход при рассмотрении относительной силы бескислородных кислот. Фрагмент Эn– – Н+, имеющийся в молекулах этих соединений, заменяем ионной связью:
![]()
Сила взаимодействия между этими ионами, разумеется, определяется зарядом иона (степенью окисления атома элемента) и его радиусом. Имея в виду закон Кулона, получаем, что сила бескислородных кислот возрастает с уменьшением степени окисления атома элемента и увеличением радиуса его иона.
Сила бескислородных кислот в растворе будет возрастать в подгруппе, например, галогеноводородных кислот, поскольку при одинаковой степени окисления атома элемента увеличивается радиус его иона.
