
Свойства газов
.pdf
Лабораторная работа 1.2.1
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ |
СР |
ДЛЯ ВОЗДУХА |
|
Сv |
|||
|
|
||
Т Е О Р Е Т И Ч Е С К И Е |
П О Л О Ж Е Н И Я |
||
Теплоемкостью тела называется величина, равная количеству теплоты, которое нужно сообщить телу, чтобы повысить его температуру на один градус. Согласно определению
С |
dQ |
, |
(1.1) |
|
dT |
||||
|
|
|
где dQ – количество теплоты, сообщенное телу ; dТ – изменение температуры тела.
Теплоемкость газа зависит от условий нагревания. Согласно первому началу термодинамики, количество теплоты dQ, переданное системе, затрачивается на изменение ее внутренней энергии dU и на работу dA,
совершаемую системой против внешних сил. |
|
|
|
||||
|
dQ = dU + dA , |
(1.2) |
|||||
Учитывается выражения (1.1) и (1.2) , можно записать: |
|
||||||
С = |
dU dA |
|
dU |
|
dA |
|
(1.3) |
dT |
|
dT |
dT |
||||
|
|
|
|||||
Элементарная работа dA , совершаемая газом против сил внешнего давления при нагревании на dT , равна
dA = pdV , |
(1.4) |
где p- давление газа; |
|
dV-изменение объема газа.
При изохорическом нагревании V = const, dV = O, следовательно, dA = O и
|
|
Cv = |
dU |
. |
|
|
(1.5) |
|||
|
|
|
|
|
|
|||||
|
|
dT |
|
|
||||||
При изобарическом нагревании dA = pdV |
|
и |
|
|
||||||
Cp = |
dU |
|
|
dA |
|
Cv |
pdV |
, |
(1.6) |
|
dT |
|
|
dT |
dT |
||||||
|
|
|
|
|
|
|||||
где Cv , Cp – теплоемкость газа при постоянном объеме и постоянном давлении соответственно.
Из формулы (1.5) видно, что для данной массы газа Cp> Сv .
Если количество газа равно одному киломолю, то |
pdV |
R , следовательно, |
|
dT |
|||
|
|
||
Cp = Cv+ R, |
|
(1.7) |
|
где R – универсальная газовая постоянная. |
|
|
В термодинамических расчетах важна величина отношения:
Ср ,
CV
Цель данной работы – определение отношения |
Cр |
|
для воздуха. |
||
CV |
|||||
|
|
|
|||
О п и с а н и е |
у с т а н о в к и |
|
|||
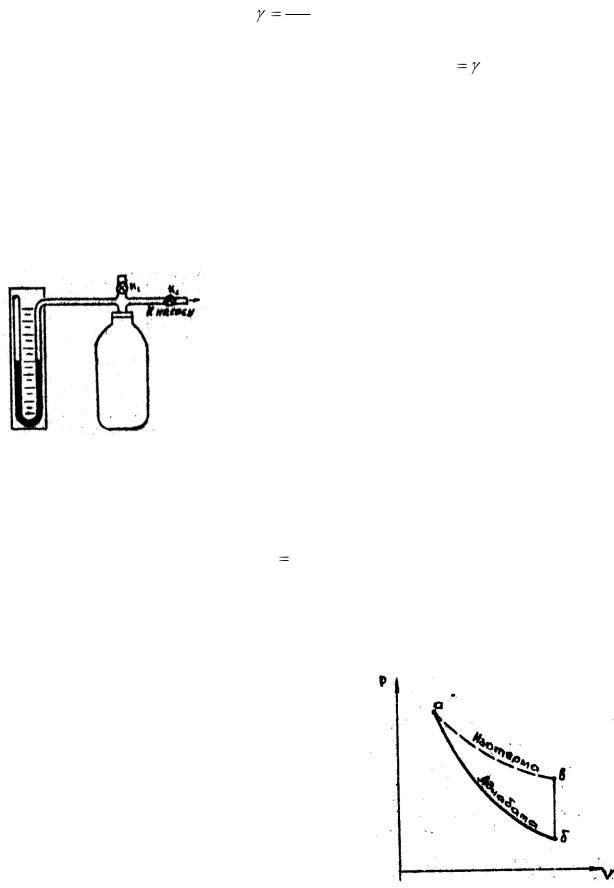
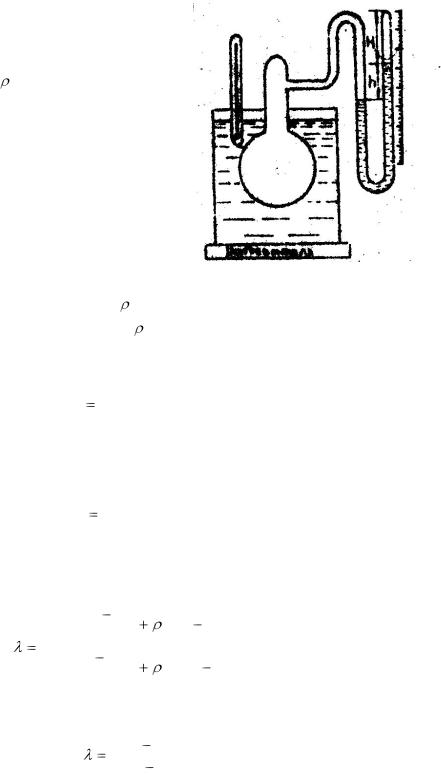
Установка для определения  состоит из сосуда с воздухом, насоса и манометра, служащего для определения разности давления в сосуде и атмосферного давления (рис 1.1).
состоит из сосуда с воздухом, насоса и манометра, служащего для определения разности давления в сосуде и атмосферного давления (рис 1.1).
Манометр наполнен подкрашенной водой. Рассмотрим изменения, которые будет претерпевать в процессе опыта газ, находящийся в сосуде.
В сосуд с помощью насоса накачивают воздух, создавая внутри избыточное, по сравнению с атмосферным, давление. Если процесс сжатия происходит достаточно быстро, то в результате работы внешних сил газ нагревается до температуры выше комнатной. После остановки насоса в результате тепло-
Рис .1.1.
обмена с окружающей средой температура воздуха в сосуде постепенно сравняется с комнатной, При этом состояние газа будет характеризоваться параметрами р1,V1,T1 , что соответствует точке а на рис (1.2)
р1 р o + ρgh1 , |
(1.8) |
где pо - атмосферное давление во время опыта;
ρgh1 – превышение давления в сосуде над атмосферным
(h1 измеряется как разность уровней жидкости в коленах манометра).
Когда температура воздуха сравняется |
|
с комнатной (об этом можно судить по |
|
установившемуся значению h1), на ко- |
|
роткое время с помощью крана соединим |
|
сосуд с атмосферой. Если расширение |
|
происходит достаточно быстро, то |
|
процесс расширения можно считать |
|
близким к адиабатическому. По опре- |
|
делению, адиабатическим называют |
|
процесс, происходящий без теплообмена |
|
между системой и окружающей средой. |
Рис .1.2. |
Впроцессе расширения газ совершает работу против сил внешнего давления за счет своей внутренней энергии. На рис 1.2. процесс изображен адиабатой а б.
Вточке б газ характеризуется параметрами р2,V2,T2 .
р2= рo ; V2>V1; T2<T1
Уравнение процесса, выраженное через параметры р,T, имеет вид
|
r 1 |
|
r |
|
|
р1 |
|
T1 |
. |
(1.9.) |
|
р2 |
T2 |
||||
|
|
||||
После закрытия крана температура воздуха в сосуде, благодаря теплопроводности стенок, постепенно повышается до комнатной. Давление при повышении температуры возрастает и становится больше атмосферного. Процесс является близким к изохорическому. В точке в параметры газа р3, V3, T3 .
р3 = рo +ρgh2; V3=V2 ; T3= T1.
Запишем уравнение процесса с учетом выражения (1.10.)
р3 T1
р2 T2
(1.10)
(1.11.)
Решив совместно уравнения (1.9.) и (1.11.), получим:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r 1 |
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
р3 |
|
|||||||
|
|
|
|
|
|
|
|
р1 |
|
r |
|
(1.12) |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
р2 |
|
|
|
|
|
|
|
р2 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
Выразив значение р1, р2, р3 |
через рo, h1 , h2 |
и подставив в уравнение (1.12.), |
|||||||||||||||||||||||||||
получим |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
рo |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
рo |
|
|
|
|
gh2 |
|
||||||
|
|
|
|
gh1 |
|
r |
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
рo |
|
|
|
|
|
|
|
|
|
|
|
|
рo |
|
|||||||||||||
отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
gh2 |
|
||||||||
|
|
|
|
|
gh1 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
r |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Po |
|
|
|
|
|
|
|
|
|
Po |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Раскладываем левую часть по биному Ньютона и, пренебрегая всеми |
|||||||||||||||||||||||||||||
членами, содержащими |
|
gh1 |
|
в степени выше первой, имеем: |
|
||||||||||||||||||||||||
|
рo |
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1+ |
1 |
|
|
|
|
|
gh1 |
|
1 |
|
|
|
gh2 |
|
|
||||||||||||
|
|
|
|
|
|
|
|
рo |
|
|
|
|
рo |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
отсюда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h1 |
|
|
|
|
|
|
|
|
(1.13) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
h1 |
|
h2 |
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
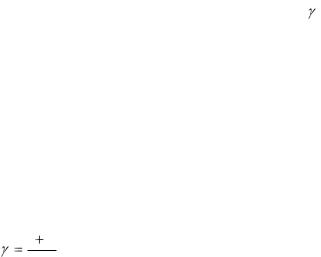
П о р я д о к в ы п о л н е н и я р а б о т ы
1.Накачивают в сосуд воздух так, чтобы разность уровней в манометре составила 20-30 см.
2.Перекрывают кран К2, соединяющий сосуд с насосом, и, дождавшись окончательной установки уровней жидкости в манометре, снимают показание манометра h1 (рис . 1.1.)
3.Открывают на короткое время кран К1, соединяющий сосуд с атмосферой. Закрыв кран, дожидаются окончательной установки уровней жидкости в манометре и снимают h2 .
4.Опыт проводят 8-10 раз. Результаты измерений заносят в таблицу.
№ |
Показания манометра |
|
|
п/п |
|
|
|
h1 |
h2 |
|
|
|
|
|
|
Об р а б о т к а р е з у л ь т а т о в
эк с п е р и м е н т а
По формуле (1.13) определить 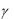 и из результатов всех измерений найти среднее значение ‹
и из результатов всех измерений найти среднее значение ‹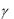 ›.
›.
В качестве дополнительного задания к данной работе рассчитать: 1. Число степеней свободы i молекулы воздуха, зная 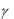 , по формуле
, по формуле
i 2
i
2.Молярную и удельную теплоемкость воздуха при постоянном давлении и постоянном объеме по известному i .
3.Произвести расчет абсолютной и относительной погрешностей.
К о н т р о л ь н ы е в о п р о с ы
1.Написать первое начало термодинамики для всех изопроцессов.
2.Что понимают под теплоемкостью газа, молярной и удельной теплоемкостью? Единицы их измерения.
3.Почему для газов различают теплоемкость при постоянном объеме и теплоемкость при постоянном давлении, как они связаны между собой?
4.Какой процесс называют адиабатическим? Написать закон адиабатического процесса.
5. |
Как и почему изменяется |
температура газа при адиабатическом |
|
расширении и адиабатическом сжатии? |
|
6. |
Единицы измерения давления (системные и внесистемные). |
|

Л А Б О Р А Т О Р Н А Я Р А Б О Т А 1. 2. 2. Определение термического коэффициента давления воздуха
|
|
при помощи газового термометра |
|
|
|
|
т е о р е т и ч е с к и е п о л о ж е н и я |
|
|
Согласно |
закона |
Гей–Люссака |
давление данной массы |
газа при |
постоянном объеме меняется с температурой линейно: |
|
|||
|
|
P = Рo( 1 + |
t) , |
(2.1.) |
где Р – давление газа при to C; |
|
|
||
Рo – давление газа при 0o C . |
|
|
||
Величину |
= ( Р-Рo) / Рot , показывающую, на каждую долю от того |
|||
давления, какое имел газ при 0o C, возрастает давление на один градус при V = const , называют термическим коэффициентом давления.
Цель данной работы – определение термического коэффициента давления воздуха.
О п и с а н и е у с т а н о в к и
Используемый при выполнении работы газовый термометр состоит из баллона, наполненного сухим воздухом, и манометра. Для нагревания воздуха баллон помещается в цилиндрический сосуд с водой, нагреваемый на электрической плитке. Процесс нагревания газа в баллоне близок к
изохорическому. При этом для двух различных температур t1 и t2 имеем: |
|
||||||||
P1 |
= Po( 1 + |
t1) |
(2.2) |
||||||
P2 |
= Рo ( 1+ |
t2 ) |
(2.3) |
||||||
Разделив выражение (2.2) на (2.3.) получим: |
|
||||||||
|
|
P1 |
1 |
t1 |
, |
|
|||
|
|
|
|
|
|
|
|
||
|
|
P2 |
1 |
t 2 |
|
||||
откуда |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
р2 |
р1 |
|
||
|
|
|
|
|
|
. |
(2.4) |
||
|
|
|
|
р1t2 |
р2t1 |
||||
Если мениски в левом и правом коленах манометра установлены на разной высоте, то давление воздуха в баллоне
P=P/+ gh , |
(2.5) |
где p/ – давление воздуха в правом (закрытом) колене манометра;
h - разность уровней масла в манометре;  - плотность масла;
- плотность масла;
g – ускорение свободного падения.
Соответственно для двух P1,P2 имеем: |
|
|
P1 =P1/+ |
gh1 |
(2.6) |
P2 = P2/ + |
gh2, |
(2.6а) |
Процесс сжатия газа в закрытом колене манометра является изотерическим, поэтому
|
Р / |
|
Р / |
V1 |
, |
|
||
|
|
|
|
|
|
|||
|
2 |
|
1 |
V2 |
|
|
||
где V1, |
V2 – объемы воздуха в закрытом колене манометра для первого и |
|||||||
второго состояний. |
|
|
|
|
|
|
|
|
Так как |
V=SH, то |
|
|
|
|
|
|
|
|
Р |
/ |
Р / |
H1 |
, |
(2.7 a) |
||
|
|
|
||||||
|
2 |
1 |
|
H 2 |
|
|
||
где H1, H2 – высоты столба воздуха в закрытом колене манометра.
Подставив выражения (2.6) и (2.6 а) c учетом (2.7 а) в уравнение (2.4), получим:
|
Р |
/ |
Н1 |
|
Н 2 |
g(h h ) |
|||
|
|
|
|
||||||
1 |
|
Н 2 |
2 |
|
1 |
|
|||
|
|
|
|
|
|
|
(2.8) |
||
Р/ |
t2 H 2 |
|
t1Н1 |
|
|
|
|||
|
g(h t |
|
h t ) |
||||||
|
|
|
2 |
||||||
1 |
|
|
Н |
|
1 |
2 1 |
|
||
|
|
|
2 |
|
|
|
|
||
Пренебрегая (ввиду малости) вторыми членами сумм, стоящих в числителе и знаменателе, и сокращая на Р1//Н2, получим
Н1 |
Н 2 |
. |
(2.9) |
|
Н 2t2 |
H1t1 |
|||
|
|
П о р я д о к в ы п о л н е н и я р а б о т ы
1.Погрузить баллон с воздухом в холодную воду и выждать 2-3 мин, пока температура воздуха в баллоне и температура воды не сравняются.
2.Записать начальную температуру и высоту Н столба воздуха в закрытом колене манометра.
3.Включить плитку, нагреть сосуд с водой на 5-7 оС и выключить плитку. Выждать момент, когда температура и высота жидкости в закрытом
колене манометра достигнут наибольшего значения, показания записать
в таблицу.
4.Аналогичные измерения провести 8-12 раз, нагревая воду до 80 оС.
5.Результаты наблюдений занести в таблицу.
О б р а б о т к а р е з у л ь т а т о в э к с п е р и м е н т а.
По полученным данным согласно выражению (2.9) для различных интервалов температур рассчитать , а затем найти его среднее значение.
№ п/п |
t ОС |
H |
|
|
|
|
|
|
|
|
|
К о н т р о л ь н ы е в о п р о с ы
1.Какой процесс называют изотермическим, изобарическим, изохорическим? Дать формулировки законов изопроцессов, начертить их графики в координатах рV, рТ, VT.
2.Каков физический смысл коэффициента ?
3.Перечислить единицы измерения давления. Найти соотношение между ними.
4.Пояснить с точки зрения молекулярно-кинетической теории физическую сущность давления газа и зависимость давления газа от температуры.
5.Какой процесс происходит с газом, находящимся в закрытом колене манометра?
6.Пользуясь основным уравнением кинетической теории идеального газа, вывести зависимость р = n k T.
Л А Б О Р А Т О Р Н А Я Р А Б О Т А 1.2.3.
Исследование зависимости давления насыщенного пара от температуры
Т е о р е т и ч е с к и е |
п о л о ж е н и я |
Пар над жидкостью может находиться в двух состояниях: насыщенном и ненасыщенном. Насыщенным паром называется пар, находящийся в динамическом равновесии со своей жидкостью. На основе молекулярнокинетической теории, в таком состоянии пара число молекул, вылетающих за единицу времени из жидкости, равно числу молекул, возвращающихся в нее.
Давление насыщенного пара над жидкостью не зависит от объема при данной температуре и растет с повышением температуры. Согласно молекулярно-кинетической теории давление пара можно подсчитать по уравнению
p = n k T |
(3.1) |
где n – число частиц в единице объема пара; k – постоянная Больцмана;
Т– абсолютная температура пара.
Сростом температуры в насыщенном паре увеличивается значение n. Отсюда кривая, отражающая зависимость р = f (T), носит нелинейный характер. Изменение давления насыщенного пара dр с изменением температуры dT выражается уравнением Клапейрона - Клаузиуса:
dр |
1 |
|
|
l |
, |
|
|
|
|
|
|
|
|
dТ |
Т v2 |
v1 |
||||
где T - абсолютная температура насыщенного пара l - удельная теплота парообразования жидкости
v1 - удельный объем (объем единицы массы) жидкости при данной температуре
v2 - удельный объем насыщенного пара над жидкостью при той же температуре.
Цель данной работы - экспериментальное определение зависимости давления насыщенного пара от температуры рn = f (T) и определение удельной
теплоты парообразования. |
|
|
|
|
|
О п и с а н и е у с т а н о в к и. |
|
|
|
||
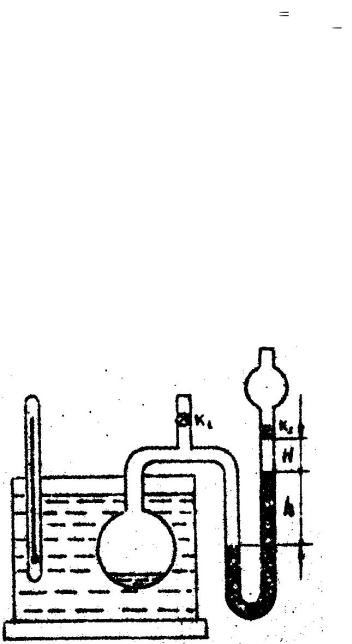
Экспериментальная |
установка |
||||
(см. рисунок) состоит из колбы, |
|||||
содержащей воздух |
и |
насыщенный |
|||
пар, |
масляного |
манометра |
и |
||
нагревателя. При открытых кранах |
|||||
K1 и |
К2 |
давление |
смеси газов |
||
(воздух |
плюс |
|
насыщенный |
||
пар) в колбе и воздуха в правом |
|||||
колене |
|
манометра |
равны |
||
атмосферному. Давление смеси газов |
|||||
в колбе по закону Дальтона равно |
|||||
сумме |
|
парциальных |
давлений |
||
насыщенного пара и газа (воздуха): |
|
||||

рсм = рn + р1 |
(3.3) |
Если краны закрыть и повышать температуру |
водяной бани, в которой |
находится сосуд со смесью газов, то давление смеси будет расти. В любой момент времени
|
рсм = р/ + ρ g h , |
( 3.4) |
|
где |
р/ - давление газа в правом (закрытом) колене манометра; |
|
|
|
ρgh - гидростатическое |
давление разности столбов масла в |
|
манометре |
( ρ - плотность масла, |
g - ускорение силы тяжести, |
|
|
h - разность высот масла в коленах манометра). |
|
|
Поскольку в уравнениях (3.3) и (3.4) выражается одна и та же величина, то |
|
||
|
рn + р1 = р/ + ρgh, |
|
|
откуда |
|
|
|
|
рn = р/ + ρgh – р1 . |
(3.5) |
|
Считая процесс сжатия газа в закрытом колене манометра изотермическим, давление р/ можно рассчитать на основании закона Бойля -
Мариотта: |
|
|
|
|
|
|
|
|
|
|
|
|
р / |
р |
|
|
V0 |
, |
(3.6) |
|
|
|
0 |
|
|||||
|
|
|
|
|
|
V |
|
||
|
|
|
|
|
|
|
|
||
где |
р0 |
- |
начальное |
давление |
газа, равное атмосферному; |
||||
V0,V - начальный |
и |
конечный |
объемы газа |
в правом колене манометра, |
|||||
соответствующие температурам смеси газов T0, T.
Учитывая, что V=SH, (S-сечение трубки манометра, H-высота столбика газа) имеем
р / р |
|
Н0 |
, |
(3.7) |
|
0 |
Н |
||||
|
|
|
|||
|
|
|
|
Давление воздуха р1, являющегося одним из компонентов смеси, также может быть рассчитано по данным эксперимента. Если считать процесс нагревания смеси близким к изохорическому, то
|
р |
р |
0 |
|
Т |
|
(3.8) |
|
|
|
|
|
|
||||
|
|
|
1 |
Т0 |
|
|
||
где |
рn0 - парциальное давление воздуха в колбе при начальной |
|||||||
температуре. |
|
|
|
|
|
|
|
|
|
р0 |
р |
атм |
р0 |
(3.9) |
|||
|
1 |
|
n |
|
||||
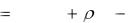
где рn0 - парциальное давление насыщенного пара при начальной температуре. Значение рn0 берется из табл.3.1.
Расчетное уравнение (3.5.) с учетом формул (3.7.) и (3.8.) принимает вид
р |
|
р |
|
H0 |
gh р |
0 |
|
Т |
(3.10) |
|
|
|
|
|
|
||||
|
n |
|
0 H |
1 |
Т0 |
|
|||
Порядок выполнения работы
1.По барометру определить атмосферное давление.
2.Открыть краны К1, К2, записать начальную температуру Т0.
3.Закрыть краны К1, К2, включить нагреватель. После того как водяная баня нагреется на 4-60С, отключить нагреватель и выждать момент, когда температура в бане и высота столбика в манометре перестанут изменяться,
записать показания T, h, H.
4.Подобные измерения провести до температуры 800С, сняв 10-12 значений h, H. Данные записать в таблицу 3.2.
Обработка результатов эксперимента.
Рассчитать парциальное давление газа в сосуде p10 ,согласно уравнению (3.9.). Значение p0n , соответствующее начальной температуре опыта, взять из табл. 3.1.
|
|
|
|
|
|
|
|
|
Таблица 3.1. |
|
||
T0 C |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
P0пмм |
12,79 |
13,63 |
14,53 |
15,48 |
16,48 |
17,54 |
18,65 |
19,83 |
21,07 |
23,38 |
23,76 |
|
рт. ст. |
|
|
|
|
|
|
|
|
|
|
|
|
P0п |
17,0 |
18,1 |
19,3 |
20,6 |
21,9 |
23,3 |
24,8 |
26,4 |
28,0 |
29,8 |
31,4 |
|
10-2 |
|
|
|
|
|
|
|
|
|
|
|
|
Па |
|
|
|
|
|
|
|
|
|
|
|
|
Произвести расчеты р/, р1 и гидростатического давления ргс. Данные занести в табл.3.2.
Таблица 3.2.
№ п/п |
T, K |
Н |
h |
р/ |
ргс |
р1 |
рn |
|
|
|
|
|
|
|
|
