
Химия. методические рекомендации
.pdf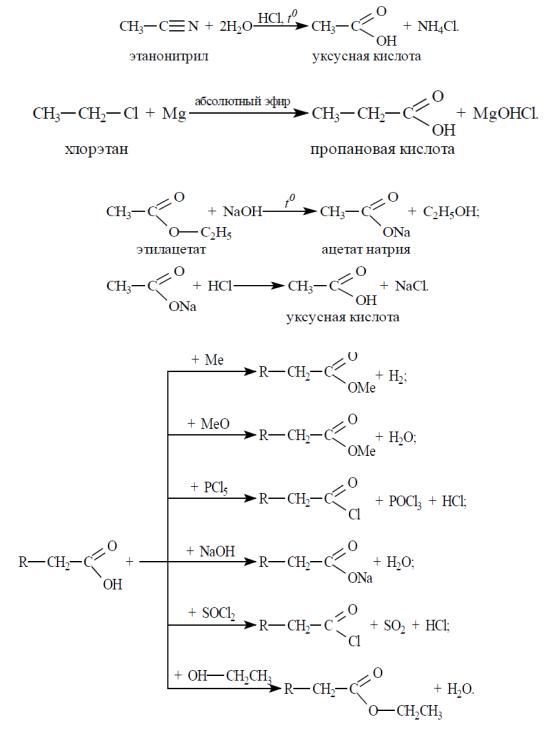
21
Карбоновые кислоты.
Карбоновыми кислотами называют производные углеводородов, которые содержат в молекуле одну или несколько карбоксильных групп – СООН.
Общая формула насыщенных одноосновных карбоновых кислот: R- COOH, пример, уксусная кислота CH3COOH.
Способы получения
1.Окисление спиртов, альдегидов, кетонов, алканов.
2.Гидролиз нитрилов:
ÏолесÃÓ3. Магнийорганический синтез использованием реактивов Гриньяра:
4. Щелочной гидролиз (омыление) ложных эфиров:
Химические свойства
22
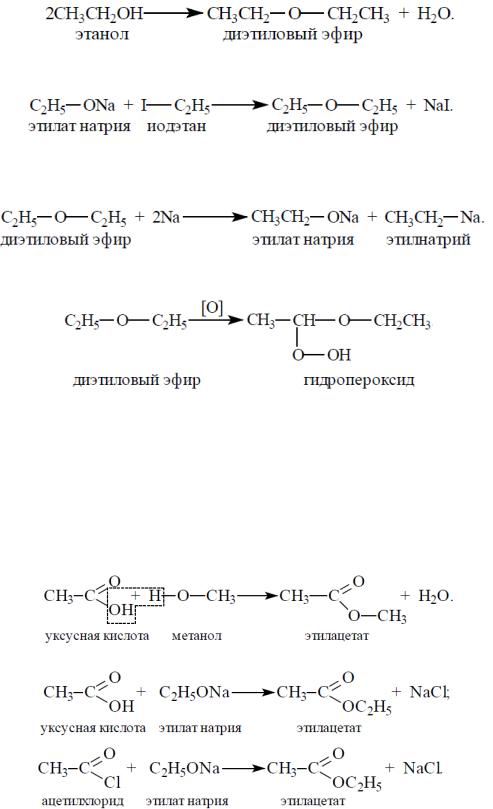
Простые эфиры Простые эфиры – это органические соединения, в которых два
углеродных радикала связаны между собой атомом кислорода (кислородным мостиком): R1 – O – R2. Радикалы могут быть одинаковыми или разными.
Способы получения простых эфиров
1.Межмолекулярная дегидратация:
2.Взаимодействие алкоголятов с галогеналканами (реакция Вильямсона):
ÏолесÃÓ
Химические свойства
1. Взаимодействие с металлическим натрием:
2. Окисление. При длительном пребывании на воздухе простые эфиры
окисляются с образованием взрывоопа ных гидропероксидов и пероксидов:
Сложные эфиры Сл жные эфиры – это производные карбоновых кислот, у которых
гидроксил в карб кси ьн й группе замещен на остаток спирта.
|
Общая ф рмула: RCOOR, |
Сп с бы п лучения сл жных эфиров |
|
1. |
Взаимодействие кислот со спиртами (реакция этерификации): |
2. |
Взаимодействие галогенангидридов алкоголятами спиртов: |
23
Практическая часть
Опыт 1. Образование и свойства этилата натрия
В сухую пробирку наливают 2 мл обезвоженного этилового спирта и аккуратно вносят кусочек металлического натрия. Пробирку закрывают пробкой с газоотводной трубкой. (Что происходит?) Через несколько минут после начала реакции поджигают выделяющийся газ у конца газоотводной трубки. Если реакция сильно замедляется, пробирку можно немного подогреть. В пробирку добавляют 1 каплю спиртового раствора фенолфталеина, а затем 1 – 2 капли дистиллированной воды. Что происходит с раствором? Какие свойства спирта (основные или кислотные) проявляются
в реакции с металлическим натрием? Запишите уравнения соответствующих реакцийÏолесÃÓ.
Опыт 2. Получение глицерата и гликолята меди
В пробирку наливают 3 – 4 капли 2%-го раствора сульфата меди (II) и 2
– 3 мл 10%-го раствора гидроксида натрия. К образовавшемуся осадку добавляют несколько капель глицерина. Что происходит? Напишите
уравнения реакции образования глицерата меди.
Опыт повторяют с этиленгликолем. Напишите уравнение реакции
образования гликолята меди. Какие вой тва глицерина и этиленгликоля
проявляются в опытах с гидрок идом м ди (II)?
Опыт 3. Реакция «с р бряного з ркала»
В три чистые об зжиренные пробирки вносят по 2 капли раствора нитрата серебра и по 3-4 кап и конц нтрированного раствора аммиака (до полного растворения осадка оксида с р бра(I)).
После этого в первую пробирку добавляют 2 капли раствора формальдегида, во вт рую 2 кап и бензальдегида, в третью 2 капли ацетона. Содержим е пр бир к сторожно нагревают в пламени спиртовки. Происходит реакция «серебряного зеркала».
Внимание! Раств р гидроксида диамминсеребра после реакции сдать лаборанту и пр мыть пр бирки.
Опыт 4. Реакция альдегидов и кетонов нитропруссидом натрия
В две пробирки наливают по 1 мл дистиллированной воды, затем в одну из них добавляют 2 – 3 капли формалина, а во вторую – 2 – 3 капли ацетона. К полученным смесям приливают по несколько капель 5% нитропруссидома натрия и 1 М раствора гидроксида натрия. Сравните наблюдаемые явления и запишите уравнения реакций.
Опыт 5. Получение уксусной кислоты
В пробирку помещают 0,5 г ацетата натрия и 2 мл концентрированной серной кислоты. Пробирку закрывают пробкой с газоотводной трубкой и осторожно подогревают. К отверстию пробирки поднесите лакмусовую бумажку, смоченную водой. Что происходит? Запишите уравнение реакции.
Опыт 6. Получение этилового эфира борной кислоты
В фарфоровую чашку помещают небольшое количество борной кислоты (H3BO3), которую смачивают метиловым или этиловым спиртом.
24
Поджигают, отмечают цвет пламени. Напишите уравнение реакций.
Опыт 7. Получение диэтилового эфира
В сухой пробирке прокаливают 1 г борной кислоты до полного ее обезвоживания (пробирку необходимо держать в горизонтальном положении и периодически всю ее прогревать для удаления капелек воды). После полного расплавления кристалликов кислоты пробирку охлаждают. К затвердевшему расплаву добавляют 2 – 3 мл этилового спирта и 1 мл концентрированной серной кислоты. В пробирку вносят несколько кусочков фарфора, закрывают ее пробкой с газоотводной трубкой и осторожно нагревают. При помощи лучины поджигают выделяющиеся пары у конца газоотводной трубки. В какой цвет окрашивается пламя? Напишите
уравнения реакций.
ÏолесÃÓа) хлоруксусная кислота; б) 3-метилпентановая кислота; в) пропандиовая кислота; г) 2,2-диметилпропановая кислота; д) янтарная кислота.
Опыт 8. Получение этилового эфира уксусной кислоты
В пробирку помещают 2 мл этилового спирта, 2 мл ацетата натрия и 1
мл концентрированной серной кислоты (что происходит?). Содержимое пробирки медленно нагревают до кипения и кипятят 10 – 15 минут. Затем раствор охлаждают. Для выделения эфира к содержимому пробирки приливают 3 – 4 мл раствора хлорида натрия. Объясните происходящие явления и запишите уравнения реакций.
Контрольные вопросы
1. Составьте уравн ния р акций, которые надо провести для осуществления следующих пр вращ ний:
пропанол-1 → А → Б → 2,3-дим тилбутан.
2. Напишите структурные формулы сл дующих соединений:
а) 2-метилпентанол-3; б) 2,4-диметилпентанол-2; в) этандиол-1,1; г) 2-метилбутин-3- -2; д) 2-метилбутанол-1.
3. |
Напишите и наз вите, структурные формулы изомерных альдегидов |
и кетонов става: С6Н12О. |
|
4. |
Напишите структурные формулы (и назовите) кетонов, изомерных |
изовалериан в му альдегиду. |
|
5. |
Синтезируйте изомасляную кислоту из ацетона. |
6. |
Какие вещества образуются, если взаимодействуют следующие |
соединения: втор-бутилмагнийбромид и диэтилкетон? |
|
7. |
Напишите структурные формулы соединений: |
8.Какое соединение образуется, если на изомасляную кислоту подействовать пятихлористым фосфором и полученное вещество обработать аммиаком?
9.Какое соединение образуется при гидролизе изопропилового эфира и валериановой кислоты?
10.Чем определяются свойства, характерные для спиртов, альдегидов и карбоновых кислот? Какие эти свойства?
25
РАЗДЕЛ 3
Задачи по теме «Кислородсодержащие органические соединения»
1.В 200 мл раствора натриевой соли глицина с массовой долей соли 9,7% плотностью 1 г/мл пропустили 6,72 л (н.у.) хлороводорода. Найдите массовые доли веществ в полученном растворе.
2.На нейтрализацию предельной карбоновой кислоты массой 4,8 г потребовался раствор гидроксида калия объёмом 16,96 мл плотностью 1,18г/мл с массовой долей щёлочи 22,4%. Определите формулу кислоты.
3.При гидролизе 14.8 г сложного эфира избытком водного раствора
гидроксида натрия получено 10,9 г формиата натрия (выход 80%) и алканол. КаковаÏолесÃÓформула исходного эфира?
4. Смесь уксусной и аминоуксусной кислот в растворе прореагировала с гидроксидом натрия массой 26 г. Определите массу аминоуксусной кислоты, зная, что её масса в 2 раза больше, чем масса уксусной кислоты.
5. Сколько граммов ацетальдегида образовалось при окислении соответствующего спирта (мас овая доля выхода ацетальдегида – 75% от теоретического), если известно, что при взаимодействии такого же количества спирта с м таллич ким натрием выделилось 5,6 л водорода
(н.у.)?
6. Определите возможную мол кулярную формулу сложного эфира, если известно, что д я гидро иза этого эфира одноосновной карбоновой кислоты, взятого объёмом 29,6 см3, плотностью 0,9г/см3 , потребовалось 14,4 г гидроксида натрия.
7. Смесь первых двух ч енов гомологического ряда насыщенных одноатомных спирт в бработа и металлическим натрием, при этом выделил сь 8,96 (н.у.) газа. При взаимодействии такого же количества этих же спирт в с бр м в д р д м образовалось 78,8 г смеси бромистых алкилов. Определите массу спирт в в смеси.
8. Рассчитайте объем (н. у.) водорода, выделившегося в реакции, для которой взяты этанол химическим количеством 1,5 моль и алюминий массой 20,25 г.
9. Сколько литров 10% раствора едкого натра (плотность 1,1 г/мл) потребуется для нейтрализации аминоуксусной кислоты, полученной из 320 кг карбида кальция?
10. Какое количество сложного эфира можно получить из 23 г этанола и 12 г уксусной кислоты? Назовите полученный эфир.
26
РАЗДЕЛ 4
Цепочки превращений по теме «Кислородсодержащие органические соединения»
1. C2H5OH X1 |
|
X2 |
С6Н5С2Н5 |
Х3 |
|
|||
|
Х4; |
|
|
|
|
|
|
|
2. |
Пропанол-1 |
|
|
Х1 |
X2→пропин |
|
X3 |
|
|
Х4; |
|
|
|
|
|
|
|
ÏолесÃÓX3. |
|
|
||||||
3. |
Ацетальдегид |
|
ацетат |
калия |
этановая кислота |
|||
|
этилацетат ацетат кальция ацетон; |
|
|
|||||
4. |
CH3CHO |
|
X1 |
|
|
С2Н6 |
Х2 |
X3 |
|
(C2H5)2O; |
|
|
|
|
|
||
5. |
ацетат калия |
|
этан |
X |
|
этанол |
диэтиловый |
|
|
эфир; |
|
|
|
|
|
|
|
6. H2C2O4 |
X1 |
СН3ОН |
|
X2 |
|
X3→ |
||
|
CH4; |
|
|
|
|
|
|
|
7. |
CH3CHO |
|
Х1 |
Х2 → этилен → CH3CHO |
|
|||
|
X3; |
|
|
|
|
|
|
|
8. |
C2H5OH |
|
X1 |
|
|
X2 |
X3 |
этин |
|
C2H4O; |
|
|
|
|
|
|
|
9. CH3CH2CH2OH → X1 |
C6H14 |
X2 |
|
C6H5СН3 |
||||
|
→ C6H5CООН; |
|
|
|
|
|
|
|
10.Этанол |
|
Х1 |
|
Х2 |
|
Ag2C2 |
X2 |
|
27
РАЗДЕЛ 5
Тестовые задания по теме «Кислородсодержащие органические соединения»
5.1 Карбоновые кислоты и их производные
1. Функциональная группа карбоновых кислот называется:
1) |
карбонильной; |
3) |
карбоксильной; |
|
2) |
гидроксильной; |
4)сложноэфирной. |
||
2. Реагирует с аммиачным раствором оксида серебра, давая реакцию |
||||
«серебряного зеркала», следующая кислота: |
|
|
||
ÏолесÃÓ |
|
|||
1) |
метановая; |
3) |
пальмитиновая; |
|
2) |
этановая; |
4) |
олеиновая. |
|
3. Уксусная кислота не взаимодействует : |
|
|
||
1) NaHCО3; |
3) NaOH; |
|
||
2) |
Na2SiО3; |
4) |
СО2 |
|
4. Для получения сложного эфира нельзя во пользоваться химической |
||||
реакцией: |
|
|
|
|
1) RCOСl + R2-OH ; |
4) |
эфиры |
получаются в |
|
2) R1COOMe + R2OH ; |
р зультате всех |
предложенных |
||
3) CH2OH-(CH2)3-COOH ; |
химиче ких реакций. |
|||
5. Наиболее удобный способ получения карбоновой кислоты в |
||||
лабораторных ус овиях: |
|
|
|
|
1) NaOH + CO ; |
3) HCN + H2O ; |
|||
2) R-COONa + H2SO4 ; |
4) CH2=CH2 + CO . |
|||
6. Из пр пан в й кис ты можно получить: |
|
|
||
а) бр мистый пр пи нил; |
в) пропилпропаноат; |
|||
б) ангидрид пр пан в й |
д) пропаноат кальция. |
|||
кисл ты; |
|
|
|
|
7.Ф рмула пальмитин вой кислоты |
|
|
|
|
1) C17H31COOH; |
3) C15H31COOH; |
|||
2) C5H11COOH; |
4) C6H5COOH. |
|||
8. В уравнении реакции между аммиачным раствором оксида серебра |
||||
(I) и метановой кислотой сумма коэффициентов равна: |
|
|||
1) |
6; |
3) |
4; |
|
2) |
5; |
4) |
3. |
|
9. Определите вещество X в следующей схеме превращений: |
||||
метанол → X→ уксусная кислота |
|
|
|
|
1) |
этилформиат; |
3) |
метаналь; |
|
2) |
этаналь; |
4) |
метилацетат. |
|
10. В порядке усиления кислотных свойств расположены кислоты:
1)стеариновая - уксусная – трихлоруксусная;
2)уксусная - стеариновая – трихлоруксусная;
28
3)трихлоруксусная - уксусная – стеариновая;
4)стеариновая - трихлоруксусная – уксусная. 11. Уксусная кислота не реагирует с:
1) |
пропанолом; |
3) |
хлоридом натрия; |
2) |
магнием; |
4) |
карбонатом калия. |
13. Продуктом окисления пропаналя является: |
|||
1) |
пропанол; |
3) |
пропанон; |
2) |
пропановая кислота; |
4) |
пропан. |
12. Муравьиная кислота реагирует с: |
|
|
|
1) |
хлоридом натрия; |
3) |
медью; |
2) |
аммиачным раствором |
4) |
гексаном. |
оксида серебра; |
|
|
|
ÏолесÃÓ |
|||
13. Ацетат натрия не образуется при действии на уксусную кислоту: |
|||
1) |
натрия; |
3) |
хлорида натрия; |
2) |
гидроксида натрия; |
4) |
карбоната натрия. |
5.2 Спирты |
|
|
|
1. Какой реагент используют для получения |
пиртов из алкенов? |
||
1) |
воду; |
3) |
лабый р-р Н2SО4; |
2) |
пероксид водорода; |
4) |
р-р брома. |
2. Этанол можно получить из этил на в результате реакции: |
|||
1) |
гидратации; |
3)галогенирования; |
|
2) |
гидрирования; |
4) |
гидрогалогенирования. |
3. Метанол не взаимод йству т с: |
|
|
|
1) |
К; |
3) |
СuО; |
2) |
Аg; |
4)О2. |
|
4. В пр мыш енн сти из оксида углерода и водорода под давлением, |
|||
при повышенн й температуре, в присутствии катализатора получают: |
|||
1) |
метан ; |
3) |
пропанол; |
2) |
этан л; |
4) |
бутанол. |
5. При воздействии на спирты щелочных металлов образуются: |
|||
1) |
легко гидролизуемые карбонаты; |
|
|
2) |
трудно гидролизуемые карбонаты; |
|
|
3) |
трудно гидролизуемые алкоголяты; |
|
|
4) |
легко гидролизуемые алкоголяты. |
|
|
6. Пропанол-1 образуется в результате реакции, схема которой |
|||
1) |
СН3СН2СОН + H2 → ; |
|
|
2)СН3СН2СОН + Cu(OH)2 →
3)СН3СН2Сl + H2O → ;
4)СН3СН2СОН + Ag2O → .
7. Из какого вещества нельзя получить пропанол-2:
1) |
пропен; |
3) |
2-бромпропан; |
2) |
пропаналь; |
4) |
пропанон-2. |
29
5.3 Карбонильные соединения
1. К классу предельных альдегидов принадлежит вещество состава:
1) |
СnH2n-2O; |
3) |
СnH2nO; |
|
2) |
СnH2n+2O; |
4) |
СnH2nO2 |
|
2. Гидратацией алкина может быть получен |
|
|
||
1) |
формальдегид; |
3) |
пропионовый альдегид; |
|
2) |
ацетальдегид; |
4) |
масляный альдегид. |
|
3. Изомером бутаналя не является |
|
|
|
|
1) |
бутен-2-ол-1; |
3) |
циклобутанол; |
|
2) |
бутанон; |
4) |
диэтиловый эфир. |
|
4. Среди утверждений: |
|
|
|
|
ÏолесÃÓ1) C2H5–O–CH3; 3) CH3–O–CH3; |
||||
А. В карбонильной группе альдегидов электронная плотность связи |
||||
смещена к атому углерода. |
|
|
|
|
Б. В молекулах альдегидов есть непрочная π-связь: |
|
|||
1) |
верно только А; |
3) |
верны оба утверждения; |
|
2) |
верно только Б; |
4) |
оба утверждения неверны. |
|
5. Число σ-связей в молекуле ацетальдегида равно |
|
|||
1) |
2; |
3) |
5; |
|
2) |
3; |
4) |
6 |
|
6. При восстановл нии бутаналя получает я: |
|
|||
1) |
бутанол-1; |
3) |
бутанол-2; |
|
2) |
бутановая кислота; |
4) |
дибутиловый эфир. |
|
7. Формальдегид можно по учить: |
|
|
|
|
1) |
крекингом метана; |
3) |
окислением метанола; |
|
2) |
гидратацией ацети ена; |
4) |
гидролизом хлорметана. |
|
8. Ф рмальдегид не испо ьзуется для: |
|
|
|
|
1) |
дезинфекции; |
3) |
удобрения почвы; |
|
2) |
п лучения пластмасс; |
4) |
протравливания семян. |
|
5.4 Пр стые эфиры |
|
|
|
|
1. Формула метоксипропана: |
|
|
|
|
1) C3H7OCH3; |
3) C8H17OC6H5; |
|||
2) C2H5COOCH3; |
4) CH3OCH3. |
|
||
2. Назовите продукт реакции в уравнении С2H5OH→ |
: |
|||
2) C2H5–O–C2H5; |
4) CH3COOH. |
|
||
3.Общая формула простых эфиров: |
|
|
|
|
1) CnH2n+2; |
3) CnH2n+2O; |
|
||
2) CnH2nO; |
4) CnH2n+CHO |
|
||
4. Выберите утверждения, характеризующие простые эфиры: |
||||
1) |
жидкости; |
3) |
твёрдые вещества; |
|
2. легкокипящие; |
4) |
хорошо растворимы в воде. |
||
|
|
30 |
|
5. Простые эфиры можно рассматривать как производные: |
|
|
1) альдегидов; |
3) карбоновых кислот; |
|
2) спиртов; |
4) жиров. |
|
6. Назовите соединение: |
|
|
|
CH3 |
|
|
| |
|
|
CH–O–CH2–CH2–CH3 : |
|
|
| |
|
|
CH3 |
|
1) пропилизопропиловый эфир; |
|
|
2) 1-изопропоксипропан; |
|
|
3) метилэтиловый эфир; |
|
|
ÏолесÃÓ |
|
|
4) метилпропиловый эфир. |
|
|
7. Простые эфиры не реагируют |
: |
|
1) H2SO4; |
3) HBr; |
|
2) NaOH(р-р); |
4) O2(свет). |
|
8. Какими реакциями можно получить простые эфиры: |
|
|
1) RONa + R’Hal=; |
3) RCH2OH + H2SO4 =; |
|
2) CH3COOH + HCHO=; |
4) HCOONa + CH3COOH= |
|
5.5 Сложные эфиры |
|
|
1.В результате чего образуются сложные эфиры? |
|
|
А) кислота+спирт; |
В) кислота+кетон; |
|
Б) кислота+а кан; |
Г) кислота+жир. |
|
2. С помощью какой формулы можно выразить состав сложных |
|
эфиров? |
|
|
|
А) СnHnO2; |
В) СnH2nO2n; |
|
Б) СnH3nO6n; |
Г) С2nHnO2n. |
|
3. Выберите верные утверждения, которые соответствуют сложным |
|
эфирам: |
|
|
|
А) нелетучие жидкости; |
В) не имеют запаха; |
|
Б) плохо растворяются в |
Г) твердые вещества. |
воде; |
|
|
|
4. Формула этилового эфира пропановой кислоты: |
|
|
А) C25H51COOC26H53; |
В) CH3H7COOC2H5 ; |
|
Б) СH3COOCH3; |
Г) С15H31COOC31H63. |
|
5. Число углерода в воске? |
|
|
А) 15-30; |
В) 5-10; |
|
Б) 10-15; |
Г) 30-35. |
|
6. Для гидролиза 11,8 г смеси этиловых эфиров метановой и этановой |
|
кислот нужно 54,1 см3 раствора NaOH с массовой долей щелочи 10%. Какова
масса каждого эфира в исходной смеси ? |
|
А) 74г и 4,4 г ; |
В) 6,7г и 83г; |
Б) 56г и 5,3 г; |
Г) 5,3г и 73г. |
