
- •§ 4. ФИЗИЧЕСКИЕ СВОЙСТВА, СТРОЕНИЕ, РЕАКЦИОННАЯ СПОСОБНОСТЬ СПИРТОВ И ФЕНОЛОВ
- •§ 5. КИСЛОТНЫЕ СВОЙСТВА СПИРТОВ И ФЕНОЛОВ
- •§ 6. СПИРТЫ И ФЕНОЛЫ КАК НУКЛЕОФИЛЬНЫЕ РЕАГЕНТЫ
- •§ 7. НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ ГИДРОКСИЛЬНОЙ ГРУППЫ В СПИРТАХ И ФЕНОЛАХ
- •§ 13. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ СПИРТОВ И ФЕНОЛОВ
- •§ 2. СПОСОБЫ ПОЛУЧЕНИЯ ПРОСТЫХ ЭФИРОВ
- •§ 3. ФИЗИЧЕСКИЕ СВОЙСТВА И СТРОЕНИЕ ПРОСТЫХ ЭФИРОВ
- •§ 5. ЦИКЛИЧЕСКИЕ ЭФИРЫ
- •§ 6. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ ПРОСТЫХ ЭФИРОВ
- •§ 2. СПОСОБЫ ПОЛУЧЕНИЯ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
- •§ 3. ФИЗИЧЕСКИЕ СВОЙСТВА, СТРОЕНИЕ, ХАРАКТЕРИСТИКА РЕАКЦИОННОЙ СПОСОБНОСТИ АЛЬДЕГИДОВ И КЕТОНОВ
- •§ 9. ОКИСЛЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ
- •§ 10. ВОССТАНОВЛЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
- •§ 11. РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ ПО АРОМАТИЧЕСКОМУ КОЛЬЦУ
- •§ 12. КАЧЕСТВЕННЫЕ РЕАКЦИИ АЛЬДЕГИДОВ И КЕТОНОВ
- •§ 3. ХИНОНЫ
- •§ 4. КЕТЕНЫ

O |
|
C O |
терефталевый альдегид |
C |
|
||
H |
|
H |
|
|
O O |
диацетил |
|
|
|
|
|
CH3 |
C |
C CH3 |
бутандион-2,3 |
|
O |
O |
ацетилацетон |
CH3 |
C |
CH2 C CH3 |
пентандион-2,4 |
O |
|
O |
1,4-бензохинон |
§ 2. СПОСОБЫ ПОЛУЧЕНИЯ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
1. Окисление алкенов
1.1. Озонирование (см. тему «Непредельные углеводороды»).
R |
1 |
1) O3 |
R C O |
1 |
|
C C |
R |
+ R |
C O |
||
H |
R2 |
2) H2O, Zn |
H |
R2 |
|
1.2. Цис-гидроксилирование алкенов с последующим расщепле-
нием образующегося диола иодной кислотой HIO4 или тетраацетатом свинца (CH3COO)4Pb.
R |
R1 |
KMnO4 |
R |
|
R1 |
HIO4 |
C |
C |
|
|
C C |
R2 |
|
H |
R2 |
H2O, OH H |
|
|||
|
|
|
|
OH OH |
|
|
|
|
R C |
O |
+ R1 C |
O |
|
|
|
|
H |
2 |
|
|
|
|
|
|
R |
|
|
1.3. Окисление алкенов хлоридом палладия (см. тему «Непре-
дельные углеводороды»).
77
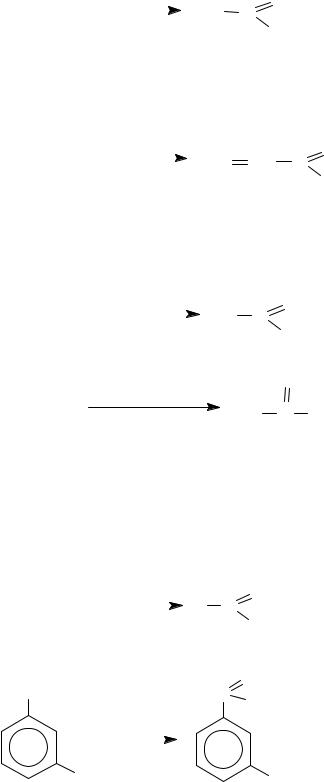
H2C=CH2 + PdCl2 + H2O |
CuCl2 |
CH3 |
C O + Pd + 2HCl |
|
|||
|
|
|
H |
Реакцию используют для промышленного получения уксусного альдегида (Вакер-процесс).
2. Аллильное окисление
H2C |
|
CH |
|
CH3 |
|
O2 |
H2C CH C |
O |
|
|
|
|
|||||
|
|
|
||||||
|
|
|
o |
|||||
|
|
|
|
|
Cu, 300 C |
|
H |
|
|
|
|
|
|
|
|
|
|
пропен |
|
|
акролеин |
|
||||
3. Окисление боковой цепи ароматических соединений
Окисление позволяет получать ароматические альдегиды и кетоны.
|
|
Ar |
|
CH3 |
|
O2 |
|
O |
||
|
|
|
|
|
Ar |
C |
||||
|
|
|||||||||
|
|
|
|
|
|
V2O5, 450oC |
|
H |
||
|
|
|
|
|
|
|
O2 |
|
O |
|
Ar |
|
CH2CH3 |
|
|
Ar |
C CH3 |
||||
|
(AcO) Mn, 130oC |
|||||||||
|
||||||||||
|
|
|
|
|
|
2 |
|
|
|
|
4. Окисление и дегидрирование спиртов (см. тему «Спирты и фенолы»)
Окисление первичных спиртов до альдегидов лучше проводить с помощью окислителей, содержащих Cr(VI): CrO3/Py, CrO3/CH3COOH, H2CrO4.
R |
|
CH OH |
[O] |
|
R C |
O |
|
|
|
|
|
||||
2 |
|
|
|
|
H |
||
|
|
|
|
|
|
альдегид |
|
CH2OH |
|
|
C |
O |
|||
|
|
H |
|||||
|
|
CrO3, Py |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
OH |
|
м-Гидрокси- |
|
м-Гидрокси- |
|||||
бензиловый спирт |
|
бензальдегид |
|||||
78
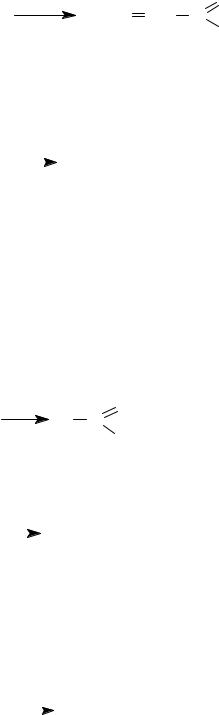
Использование мягких окислителей позволяет провести селективное окисление аллиловых спиртов в ненасыщенные альдегиды при сохранении связи С=С.
|
|
|
|
|
|
MnO2 |
CH CH C O |
|
CH2 |
|
CH |
|
CH2 |
|
OH |
||
|
|
|
||||||
|
|
|||||||
|
|
|
||||||
аллиловый |
H2O |
2 |
H |
|||||
акролеин |
||||||||
|
спирт |
|
|
|
||||
Кетоны получают при окислении вторичных спиртов, при этом возможно использование более жестких окислителей.
R |
|
CH |
|
R' |
[O] |
||||||||
|
|
|
R |
|
C |
|
R' |
||||||
|
|
|
|
|
|||||||||
|
|
||||||||||||
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
OH |
|
|
|
O |
|||||||
|
|
|
|
|
|
|
кетон |
||||||
[O]: KMnO4/H+, K2Cr2O7/H+, CrO3/H+
Альдегиды и кетоны можно получить также в результате дегидрирования спирта, которое идет под действием высоких температур в присутствии катализатора (в отсутствии воздуха): Cu/630°C; Ag/400°C; ZnO/400°C.
R |
|
|
|
CH OH k, to |
R C |
O + H |
||||||||||
|
|
|
||||||||||||||
2 |
|
|
|
|
|
|
H |
2 |
||||||||
|
первичный |
|
|
|
|
|
|
|||||||||
|
альдегид |
|
||||||||||||||
|
|
спирт |
|
|||||||||||||
R |
|
|
CH |
|
R' |
k, to |
R |
|
C |
|
R' + H2 |
|||||
|
|
|
|
|
||||||||||||
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
OH |
|
|
O |
|
|
|
||||||||
вторичный |
|
кетон |
|
|||||||||||||
спирт |
|
|
|
|
|
|
|
|
||||||||
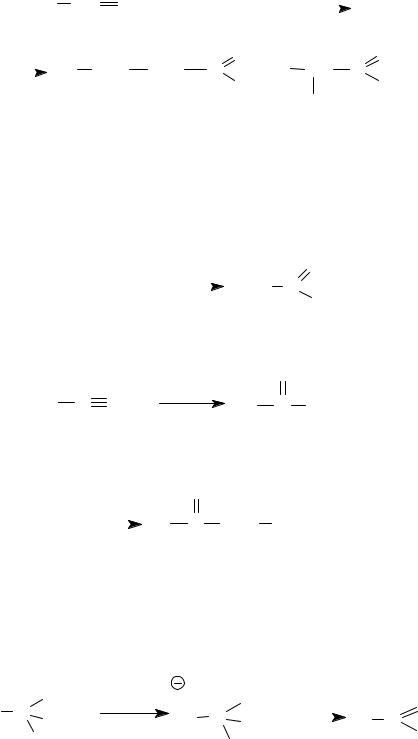
На этой реакции основан промышленный способ получения ацетона.
CH |
|
CH |
|
CH |
ZnO |
CH |
|
C |
|
CH |
+ H2 |
|||
|
|
|
|
|
||||||||||
|
||||||||||||||
|
|
|
|
|
||||||||||
3 |
|
|
|
|
3 380oC |
3 |
|
|
|
3 |
||||
|
|
|
OH |
|
|
|
|
O |
|
|||||
79
5. Реакции присоединения
5.1. Оксосинтез.
R CH CH2 + CO + H2 |
|
|
k, to |
|
|||
|
|
p |
|
||||
|
|
|
|
|
|
|
|
|
R CH |
CH |
C O |
+ R |
CH |
C O |
|
|
|||||||
2 |
2 |
H |
|
|
|
H |
|
|
|
|
|
|
|
||
CH3
k = HCo(CO)4, t° = 90−150°C, p = 10−30 Мпа
Основнойпродукт− альдегидснеразветвленнойуглероднойцепью. 5.2. Реакция Кучерова − гидратация алкинов (см. тему «Непредельные углеводороды»). В результате этой реакции из ацетилена об-
разуется ацетальдегид, из других алкинов − кетоны.
HC |
|
CH |
|
HOH |
O |
|
|
|
|
|
H3C C |
||
|
|
|
|
|||
|
HgSO4 |
|||||
|
||||||
ацетилен |
H |
|||||
H SO |
|
|||||
|
|
|
2 |
4 |
|
|
HOH O
HgSO4
R C CH H2SO4 R C CH3
алкин
Если R ≠ R’, то из диалкилацетилена, получают смесь кетонов.
|
|
|
|
|
|
|
HOH |
O |
|
|
|
|
O |
||||
R |
|
C |
|
C |
|
R' |
HgSO4 |
R C |
CH2 R' + R |
|
CH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
C |
|
R' |
||||||||||
|
|
|
|||||||||||||||
|
|
|
|
||||||||||||||
|
|
|
H2SO4 |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6. Гидролиз гем-дигалогенопроизводных углеводородов
Гидролиз гем-дигалогенопроизводных углеводородов первоначально приводит к образованию гем-диолов, которые неустойчивы и самопроизвольно подвергаются дегидратации с образованием соответствующего карбонильного соединения.
R C |
Hal H2O, OH |
R |
C |
OH |
|
|
R C |
O |
|
Hal |
to |
OH |
|
|
|||||
|
H2O |
||||||||
|
H |
|
|
|
|
H |
|||
|
|
|
|
|
|||||
|
|
|
|
H |
|
|
|
|
|
гем-дигалогенопроизводное |
гем-диол (неуст.) |
альдегид |
|||||||
80
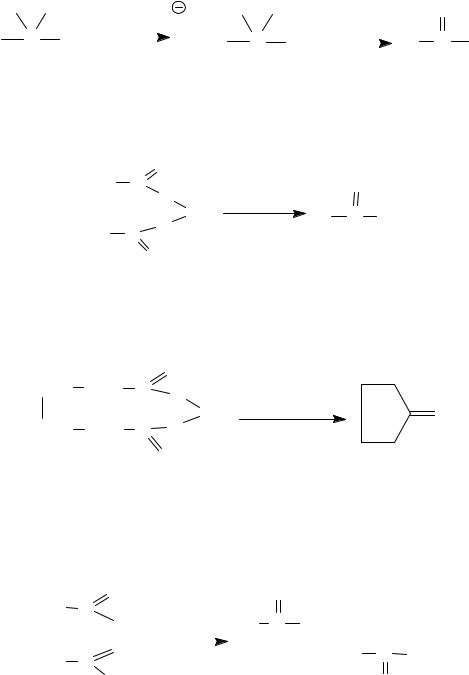
Аналогично можно получать кетоны.
|
Hal Hal |
H2O, OH |
HO |
OH |
O |
|
|||||
|
|
|
|
|
|
|
|
|
|||
Ar |
C CH3 |
|
|
Ar |
C CH |
|
Ar C |
CH |
|||
o |
|
|
|
||||||||
|
|||||||||||
|
|
|
t |
|
3 |
|
|
H2O |
|
3 |
|
|
|
|
|
|
|
||||||
7. Термическое разложение карбоновых кислот и их солей
В результате пиролиза кальциевых или бариевых солей карбоновых кислот образуются кетоны
R |
C |
O |
|
|
|
O |
O |
Ca |
|
400oC |
|||
|
|
O |
|
R |
C R |
|
R |
C |
|
|
CaCO3 |
|
|
|
|
|
||||
|
|
O |
|
|
|
|
Из солей дикарбоновых кислот в результате реакции образуются циклические кетоны, например, из адипината бария получают циклопентанон.
CH2 |
CH2 |
C |
O |
|
|
|
O |
|
o |
|
|||
|
|
|
O Ba |
|
400 C |
O |
CH |
CH |
C |
|
BaCO3 |
||
|
|
|||||
2 |
2 |
|
O |
|
|
|
|
|
|
|
|
|
Карбоновые кислоты подвергаются декарбоксилированию в присутствии оксидов марганца(II), кадмия(II), тория(II), при этом возможно образование смеси кетонов. Реакцию используют в промышленности.
R C |
O |
MnO |
|
|
O |
R' + H |
O + CO |
||||
|
OH |
R C |
|||||||||
+ |
O |
|
|
|
|
|
|
|
|
2 |
2 |
R' C |
|
to |
+ R' |
|
C |
|
R' + R |
C R |
|||
OH |
|
|
|||||||||
|
|
|
|
|
|
|
O |
||||
|
|
|
|
O |
|
||||||
8. SE-реакциивсинтезеароматическихальдегидовикетонов
8.1. Ацилирование аренов по Фриделю − Крафтсу как один из основных методов синтеза алкиларилкетонов. Синтез проводят с использованием хлорангидридов или ангидридов карбоновых кислот в присутствии кислот Льюиса.
81
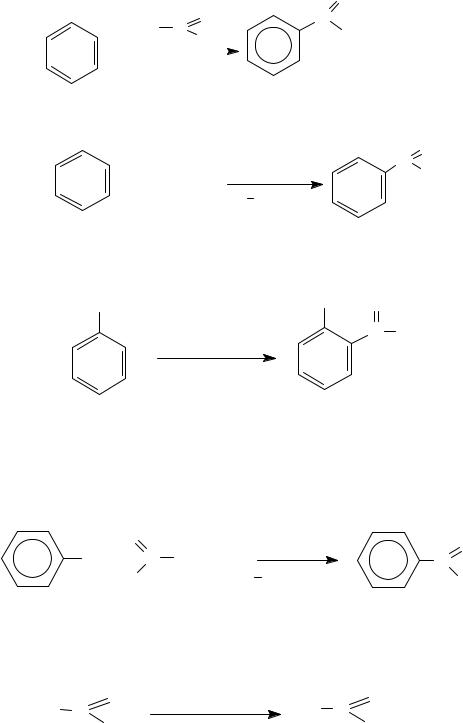
(R) |
|
O |
O |
|
|
C |
C |
|
|||
CH |
|
||||
3 |
|
Cl |
CH3 |
|
|
|
|
|
(R) |
+ HCl |
|
AlCl3, 80oC |
|||||
ацетофенон,95% |
|||||
|
|||||
8.2. Реакция Гаттермана − Коха − формилирование аренов.
|
AlCl3, CuCl |
C |
O |
+ CO + HCl |
H |
||
HCl |
|
|
|
|
|
|
|
|
|
40 60% |
|
8.3. Реакция Раймера − Тимана (см. тему «Спирты и фенолы»):
OH |
|
OH O |
|
CHCl3, NaOH |
C H |
|
|
|
|
70oC |
|
салициловый альдегид 2-гидроксибензальдегид
В условиях реакции преимущественно образуется о-изомер.
8.4. Реакция Вильсмейера также позволяет ввести в ароматическое кольцо формильную группу.
O |
POCl3 |
O |
H + C N(CH3)2 |
C |
|
H |
HN(CH3)2 |
H |
9. Реакции восстановления
9.1. Реакция Роземунда − каталитическое гидрирование хлорангидридов карбоновых кислот с образованием альдегидов.
R |
C |
O |
H2/Pd/BaSO4 |
R C |
O |
|
Cl |
80 180oC |
H + HCl |
||||
(Ar) |
|
(Ar) |
9.2. Синтез циклогексанона из фенола. Фенол можно восстано-
вить в условиях каталитического гидрирования при температуре 130−150°С и давлении 5−20 атм. до циклогексанола, а окисление последнего дает циклогексанон.
82
