
- •Разом
- •7.3. Ситуаційні задачі
- •Додаткова
- •Додаткова
- •Додаткова
- •Основна:
- •Основна:
- •8 Лабораторна робота: 1 Якісна реакція на тироксин (відкриття йоду в гідролізаті тиреоїдину). 2 Кількісне визначення 17-кетостероїдів в сечі.
- •Основна
- •Додаткова
- •Додаткова
- •Основна
- •Тема 53. «Біохімія м’язової тканини»
- •1. Перерахувати енергопостачальні процеси та вказати послідовність їх включення під час м’язової роботи
- •Написати реакції гідроксилування проліну та лізину, вказати ферменти та коферменти
- •Тема 55. «Біохімія нервової тканини»
- •Опишіть основні етапи синаптичної передачі нервового імпульсу через рецептори: а) монотропні; б) метаботропні
Вінницький національний медичний університет імені М.І.Пирогова
Кафедра біологічної та загальної хімії
МЕТОДИЧНІ РОЗРОБКИ З НАВЧАЛЬНОЇ ДИСЦИПЛІНИ БІОЛОГІЧНА ТА БІООРГАНІЧНА ХІМІЯ
(шифр і назва навчальної дисципліни)
напрям підготовки |
1201 “Медицина” |
|
(шифр і назва напряму підготовки) |
спеціальність |
7.12010001 – “Лікувальнасправа” |
|
7. 12010002 – “Педіатрія” |
|
(шифр і назва спеціальності) |
факультет |
мед. ф-т №1, мед. ф-т №2 |
2013 -2014 н.р.
Методичні розробки складено співробітниками кафедри біологічної та загальної хімії ВНМУ у відповідності до навчального плану, розробленому на засадах Європейської кредитно-транферної системи (ECTS) для вищих медичних закладів освіти України III-IV рівнів акредитації для спеціальностей 7.12010001 “Лікувальна справа”, 7. 12010002 “Педіатрія” напрямку підготовки 1201 “Медицина” у відповідності з освітньо-кваліфікаційними характеристиками (ОКХ) і освітньо-професійними програмами (ОПП) підготовки фахівців, затвердженими наказом МОН України від 16.04.03 №239.
Обговорено таухвалено назасіданні кафедри біологічної тазагальної хімії, протокол № 1 від 30.09.2013 року
Автори:
Д.мед.н. Заічко Н.В., доц. Тертишна О.В., доц. Качула С.О., доц. Ладутько С.В., доц. Личик Г.З., ст. викл. Мельник А.В., ст. викл. Колошко О.М.
Рецензенти:
Завідувач кафедрою патологічної фізіології ВНМУ ім. М.І. Пирогова д. мед. н., доцент Рикало Н.А.
Професор кафедри фармакології ВНМУ ім. М.І. Пирогова д. мед. н. Волощук Н.І.
2
Інструкція № 85.11 зохорони праці для студентів підчас практичних занять на кафедрі біологічної та загальної хімії
ЗАТВЕРДЖЕНО Наказ ректора ВНМУ ім. М.І. Пирогова від 07.11.2011р. №51
І. Вимоги безпеки передпочаткомроботи
Студент може бути допущений до виконання практичної роботи тільки після того, як пройде інструктаж з техніки безпеки (засвідчується підписом) і отримає дозвіл викладача.
Під час практичних занять на кафедрі біологічної та загальної хімії студент має бути у халаті стандартної довжини, застібнутому на всі ґудзики, оскільки це не лише уніформа, але і захисний одяг.
Довге волосся має бути сховане під головним убором чи забране в зачіску.
Перш ніж приступати до виконання практикуму студент має бути обізнаний з принципом методу та покроковим алгоритмом методики, призначеної до виконання.
Необхідні попередні нотатки мають бути внесені у протокольний зошит завчасно і є необхідною умовою отримання студентом дозволу викладача приступати до виконання роботи.
Звіряючись з нотатками в протокольному зошиті, студент має пересвідчитись у наявності всіх необхідних для роботи реагентів, лабораторного посуду та приладів. У разі нестачі чи відсутності будь – якого з них – повідомити викладача або звернутись до чергового лаборанта.
Студент має бути обізнаний щодо основних шкідливих факторів та небезпечних ситуацій, які можуть виникнути під час проведення практичних робіт:
-отруєння токсичними реактивами або газами, що утворились в результаті хімічної реакції;
-ураження очей, хімічні опіки шкіри обличчя і рук лугами чи кислотами;
-термічні опіки при роботі з легкозаймистими та вогненебезпечними речовинами чи внаслідок контакту з парою і нагрітими предметами;
-ураження електричним струмом при вмиканні (вимиканні) приладів;
-травми при роботі зі скляним посудом.
Кожний працюючий повинен знати, де знаходяться в лабораторії засоби протипожежного захисту та аптечка.
ІІ. Вимоги безпеки підчас роботи
Під час виконання лабораторного практикуму на кафедрі біологічної та загальної хімії необхідно дотримуватись чистоти, тиші, порядку та правил техніки безпеки.
Студент виконує практичну роботу ретельно дотримуючись інструкції в присутності викладача або чергового лаборанта та повідомляє їх про результати дослідження.
На практичних заняттях всі біохімічні показники визначаються студентами не в біологічному матеріалі, а в модельних розчинах.
Під час перерви студентам забороняється транспортування робочих матеріалів з навчальної кімнати в приміщення лабораторії і навпаки.
Робочі матеріали транспортуються з навчальної кімнати в приміщення лабораторії і навпаки тільки в штативах або контейнерах.
На всіх контейнерах та іншому посуді, де зберігаються реактиви, повинні бути назви реактивів. Не можна користуватись реактивами з не підписаних склянок.
3
Досліди потрібно проводити тільки в чистому посуді. Після закінчення роботи посуд відразу вимити.
В процесі роботи необхідно слідкувати, щоб речовини не потрапляли на шкіру обличчя та рук, особливо в очі.
Ніяких речовин в лабораторії не коштувати на смак, нюхати речовини можна лише обережно, направляючи на себе пари або гази, легкими рухами руки.
Під час нагрівання рідких та твердих речовин в пробірках та колбах забороняється направляти їх отвір на себе або оточуючих.
Досліди з легко запальними речовинами проводити якомога далі від полум’я та електроприладів.
ІІІ. Вимоги безпеки після закінчення роботи
По завершенні роботи студент повертає на місце задіяні матеріали і посуд, наводить лад на робочому місті.
Забороняється виливати в раковину концентровані розчини кислот та лугів.
Результати досліду студент занотовує у протокольному зошиті, при необхідності виконуючи обчислення отриманих результатів, під керівництвом викладача формулює висновки і надає зошит на підпис.
IV. Вимоги безпеки в аварійних ситуаціях
При виникненні пожежі негайно повідомити викладача або чергового лаборанта і під їх керівництвом покинути приміщення кафедри згідно плану евакуації, виконуючи їхні вказівки швидко і без обговорень.
При термічних опіках добре промити уражене місце проточною водою та терміново зробити примочки зі спиртовим розчином таніну, які знаходяться на лабораторному столі в кожній аудиторії.
При опіках їдкими лугами добре промити уражене місце проточною водою, потім 3% розчином борної кислоти, який знаходиться на лабораторному столі в кожній аудиторії.
При попаданні кислоти на шкіру потрібно зразу ж добре промити водою протягом 3-5 хвилин, потім промити розчином натрій гідрокарбонату який знаходиться на лабораторному столі в кожній аудиторії.
При попаданні їдких речовин в очі, необхідно швидко промити очі великою кількістю води або іншого нейтрального розчинника, потім потерпілого доставити в медпункт.
4

|
5. ТЕМИ ЛЕКЦІЙ |
|
№ |
Назва теми |
Кількість |
з/п |
|
годин |
1. |
Біохімія як наука: біомолекули, метаболічні шляхи. Ферменти: |
2 |
|
будова, властивості, класифікація, механізм дії, регуляція |
|
2. |
Кофактори такоферменти. Коферментні функції вітамінів |
2 |
3. |
Основні закономірності обміну речовин. Біоенергетика |
2 |
4. |
Обмін вуглеводів - 1. Травлення вуглеводів в ШКТ. Гліколіз, |
2 |
|
аеробне окиснення глюкози, пентозофосфатний шлях обмiну |
|
|
вуглеводiв: значення, регуляція, патологія. |
|
5. |
Обмін вуглеводів - 2. Глюконеогенез, обмін глікогену, |
2 |
|
метаболічні шляхи перетворення фруктози і галактози. Регуляці та |
|
|
патологія вуглеводного обміну. Цукровий діабет |
|
6. |
Метаболізм ліпідів – 1. Травлення ліпідів в ШКТ. Транспортні |
2 |
|
форми ліпідів. Катаболізм триацилгліцеролів, окиснення жирних |
|
|
кислот тагліцерину. |
|
7. |
Метаболізм ліпідів – 2. Ліпогенез. Обмін холестеролу. |
2 |
|
Метаболізм кетонових тіл. Регуляція та патологія ліпідного обміну: |
|
|
ожиріння, атеросклероз |
|
8. |
Обмін простих білків та амінокислот. Загальні шляхи обміну |
2 |
|
амінокислот. Обмін аміаку: біосинтез сечовини та його порушення. |
|
|
Спеціалізовані шляхи обміну амінокислот, спадкові ензимопатії |
|
9. |
Обмін нуклеопротеїнів: біосинтез та катаболізм пуринових та |
2 |
|
піримідинових нуклеотидів. Біосинтез дезоксирибонуклеотидів. |
|
|
Патологія обміну нуклеотидів |
|
10. |
Молекулярна біологія: Напрямки передачі генетичної |
2 |
|
інформації. Реплікація. Транскрипція. Трансляція. |
|
11. |
Молекулярна генетика: регуляція експресії генів. Молекулярні |
2 |
|
механізми мутації. Репарація ДНК. Принципи генної інженерії |
|
12. |
Гормони. Біохімічні тамолекулярно-біологічні механізми дії |
2 |
13. |
Біохімія харчування. Основні поняття вітамінології. |
2 |
|
Водорозчинні та жиророзчинні вітаміни. Вітаміни як |
|
|
біоантиоксиданти |
|
14. |
Біохімія крові. Особливості обміну речовин в еритроцитах |
2 |
15. |
Біохімія печінки. Біохімія жовтяниць |
2 |
16. |
Метаболізм ксенобіотиків |
2 |
17. |
Водно-мінеральний обмін. Біологічні рідини |
2 |
18. |
Біохімія м’язової, сполучної, нервової тканин |
2 |
19. |
Разом |
38 |
5

|
|
7. САМОСТІЙНА РОБОТА |
|
|
|
|||
№ |
|
|
Назватеми |
|
|
|
Кількість |
|
з/п |
|
|
|
|
|
|
|
годин |
1. |
Місце біохімії серед медико-біологічних дисциплін. Історія |
2 |
||||||
|
біохімії Розвиток біохімічних досліджень в Україні, науково- |
|
||||||
|
біохімічні школи |
|
|
|
|
|
|
|
2. |
Ізоферменти: використання в ензимодіагностиці |
|
|
2 |
||||
3. |
Історія |
відкриття |
та |
біологічне |
значення |
циклу |
2 |
|
|
трикарбонових кислот |
|
|
|
|
|
|
|
4. |
О.М.Бах – видатний український біохімік, автор теоріїї |
2 |
||||||
|
біологічного окиснення |
|
|
|
|
|
|
|
5. |
Життя |
та діяльність |
видатного українського |
|
біохіміка |
2 |
||
|
В.І.Палладіна |
|
|
|
|
|
|
|
6. |
Історія відкриття гліколізу та внесок вчених в його вивчення |
2 |
||||||
|
Гліколіз і канцерогенез. Роботи О.Варбурга |
|
|
|
|
|||
7. |
Бродіння: види, механізм, біологічнезначення |
|
|
2 |
||||
8. |
Спадкові порушення вуглеводного обміну: фруктоземія, |
2 |
||||||
|
галактоземія, |
порушення |
активності |
глюкозо-6- |
|
|||
|
фосфатдегідрогенази, глікогенози, аглікогенози |
|
|
|
|
|||
9. |
Транспортування тадепонування ліпідів |
|
|
|
2 |
|||
10. |
Біологічне значення поліненасичених жирних кислот та їх |
2 |
||||||
|
синтез в організмі |
|
|
|
|
|
|
|
11. |
Спадкові порушення орнітинового циклу сечовиноутворення |
2 |
||||||
12. |
Ензимопатії амінокислотного обміну |
|
|
|
2 |
|||
13. |
Обмін гомоцистеїну |
|
|
|
|
|
2 |
|
14. |
Історія молекулярної біології. І-ий і ІІ-ий постулати Кріка |
2 |
||||||
15. |
Сучасні аспекти генної інженерії. Клонування генів. ДНК – |
2 |
||||||
|
діагностика |
|
|
|
|
|
|
|
16. |
Регуляція експресії генів у людини |
|
|
|
2 |
|||
17. |
Історія відкриття тазначення дифузної ендокринної системи |
2 |
||||||
18. |
Фізіологічно активні ейкозаноїди |
|
|
|
2 |
|||
19. |
Раціональнехарчування – складовадовголіття |
|
|
2 |
||||
20. |
Вітаміни як біоантиоксиданти |
|
|
|
2 |
|||
21. |
Біологічна роль та прояви недостатності деяких |
2 |
||||||
|
мікроелементів – Zn, Mn, Mg |
|
|
|
|
|
||
22. |
Історія відкриття тіаміну тайого біологічнезначення |
2 |
||||||
23. |
Біохімія системи зсідання крові тафібринолізу |
|
|
2 |
||||
24. |
Імунохімія. Імунодепресанти і імуностимулятори |
|
|
2 |
||||
25. |
Особливості синтезу і деградації колагену |
|
|
|
2 |
|||
26. |
Біохімія тренування і втоми м’язів |
|
|
|
2 |
|||
27. |
Основи молекулярної психобіології |
|
|
|
2 |
|||
|
Разом |
|
|
|
|
|
|
54 |
6
|
ТЕМАТИЧНИЙ ПЛАН ПРАКТИЧНИХ ЗАНЯТЬ |
|
||||
№ з/п |
|
Назва теми |
|
|
Кіль- |
|
|
|
|
|
|
|
кість |
|
|
|
|
|
|
годин |
1. |
Предмет, задачі, основні етапи та сучасні напрямки |
2 |
||||
|
розвитку біохімії. Мета і методи проведення біохімічних |
|
||||
|
досліджень. Кольорові реакції набілки таамінокислоти |
|
||||
2. |
Біомолекули. Прості та складні білки: класифікація, |
2 |
||||
|
властивості, функції. Реакції осадження білків |
|
|
|
||
3. |
Ферменти: номенклатура та класифікація, хімічна природа, |
2 |
||||
|
будова та механізм дії. Відкриття дії ферментів: пепсину та |
|
||||
|
ліпази |
|
|
|
|
|
4. |
Властивості |
ферментів. |
Кінетика |
та |
енергетика |
2 |
|
ферментативних реакцій. Принципи визначення та одиниці |
|
||||
|
ферментативної активності. Специфічність дії ферментів, |
|
||||
|
залежність активності ферментів від рН татемператури |
|
||||
5. |
Регуляція ферментативної активності. Активатори та |
2 |
||||
|
інгібітори ферментів, їх біомедичне значення. Вплив активаторів |
|
||||
|
таінгібіторів наактивність ферментів |
|
|
|
||
6. |
Клітинна організація ферментативної активності. |
2 |
||||
|
Ізоферменти, мультиферментні комплекси. Основи медичної |
|
||||
|
ензимології. Кількісне визначення активності амілази слини |
|
||||
|
заметодом Вольгемута |
|
|
|
|
|
7. |
Кофактори: визначення, класифікація за механізмом дії |
2 |
||||
|
та хімічною природою. Невітамінні, вітаміноподібні та |
|
||||
|
вітамінні кофактори І групи. Визначення активності каталази |
|
||||
|
крові. Якісні реакції навітамін С |
|
|
|
|
|
8. |
Кофактори II групи. Коферментні функції водота |
2 |
||||
|
жиророзчинних вітамінів. Якісні реакції навітаміни В1, В2, В6, |
|
||||
|
А таЕ як попередники кофакторів |
|
|
|
|
|
9. |
Загальні шляхи метаболізму. Окисне декарбоксилування |
2 |
||||
|
пірувату. Цикл трикарбонових кислот Кребса. Визначення |
|
||||
|
активності сукцинатдегідрогенази |
|
|
|
|
|
10. |
Біологічне окиснення. Тканинне дихання. Спiвставлення |
2 |
||||
|
редокс-потенцiалів рибофлавiну та метиленової синi. |
|
||||
|
Визначення активностi пероксидази кровi |
|
|
|
||
11. |
Окисне фосфорилування. Хеміоосмотична теорія Мітчелла. |
2 |
||||
|
Кількісневизначення АТФ в біологічних рідинах |
|
|
|||
12. |
Підсумкове заняття зі змістових модулів 5, 6, 7, 8 (ПМК |
2 |
||||
|
2) |
|
|
|
|
|
13. |
Вуглеводи: визначення, класифікація, біологічне значення. |
2 |
||||
|
Травлення харчових вуглеводів в ШКТ. Харчові волокна. Якісні |
|
||||
|
реакції намоносахариди |
|
|
|
|
|
7
14. |
Проміжний обмін вуглеводів. Анаеробний гліколіз. |
2 |
||||||
|
Спиртовебродіння. Визначення пірувату талактату |
|
|
|||||
15. |
Аеробне |
окиснення |
вуглеводів. |
Ефект |
Пастера. |
2 |
||
|
Пентозофосфатний шлях окиснення глюкози. Кількісне |
|
||||||
|
визначення глюкози в сечі по Альтгаузену |
|
|
|
||||
16. |
Глюконеогенез. Метаболізм фруктози і галактози. Кількісне |
2 |
||||||
|
визначення фруктозо-1,6-дифосфату |
|
|
|
|
|||
17. |
Глікогенез та глікогеноліз. Глікогенози, аглікогенози. |
2 |
||||||
|
Глікокон’югати. |
Глікозидози |
|
(мукополісахаридози). |
|
|||
|
Поляриметрія. Експрес-метод визначення вмісту глюкози в сечі |
|
||||||
18. |
Регуляція та патологія вуглеводного обміну. Кількісне |
2 |
||||||
|
визначення глюкози в крові |
|
|
|
|
|
||
19. |
Ліпіди: визначення: класифікація, будова, біологічне |
2 |
||||||
|
значення. Біомембрани. Перекисне окиснення ліпідів, каскад |
|
||||||
|
арахідонової кислоти. Визначення вмісту малонового |
|
||||||
|
диальдегіду в крові |
|
|
|
|
|
||
20. |
Травлення ліпідів в ШКТ та всмоктування продуктів |
2 |
||||||
|
гідролізу. Жовчні кислоти. Транспортні форми ліпідів. Вплив |
|
||||||
21. |
жовчі наактивність ліпази |
|
|
|
|
2 |
||
Проміжний обмін ліпідів. Ліполіз: -окиснення жирних |
||||||||
|
кислот та окиснення гліцеролу. Гормональна регуляція |
|
||||||
|
ліполізу. Демонстрація кислих властивостей жирних кислот. |
|
||||||
|
Визначення суми тригліцеридів тафосфогліцеридів |
|
|
|||||
22. |
Ліпогенез: біосинтез жирних кислот, тригліцеридів та |
2 |
||||||
|
фосфогліцеридів. Визначення йодного числажиру |
|
|
|||||
23. |
Метаболізм кетонових тіл. Кетогенні та антикетогенні |
2 |
||||||
|
фактори. |
Метаболізм |
сфінголіпідів. |
Сфінголіпідози. |
|
|||
|
Визначення вмісту кетонових тіл у сечі. |
|
|
|
||||
24. |
Холестерол: будова, обмін, норма вмісту в крові. |
2 |
||||||
|
Регуляція та патологія ліпідного обміну. Якісне та кількісне |
|
||||||
|
визначення холестеролу |
|
|
|
|
|
||
25. |
Підсумкове заняття зі змістових модулів 9, 10 |
|
2 |
|||||
26. |
Прості білки. Харчове значення білків: норма білків в |
2 |
||||||
|
харчуванні, азотистий баланс. Білки повноцінні та |
|
||||||
|
неповноцінні. Травлення білків в ШКТ та всмоктування |
|
||||||
|
продуктів гідролізу. Гниття білків (гіппурова кислота, |
|
||||||
|
тваринний індикан). Визначення кислотності шлункового |
|
||||||
|
соку |
|
|
|
|
|
|
|
27. |
Проміжний обмін простих білків. Загальні шляхи |
2 |
||||||
|
катаболізму |
|
амінокислот: |
трансамінування |
та |
|
||
|
декарбоксилування. Біогенні аміни. Визначення активності |
|
||||||
|
АлАТ у сироватці крові |
|
|
|
|
|
||
28. |
Дезамінування амінокислот. Шляхи знешкодження |
2 |
||||||
|
аміаку. Кількісневизначення сечовини в біологічних рідинах |
|
||||||
8

29. |
Спеціалізовані шляхи обміну ациклічних амінокислот. |
2 |
|||
|
Ензимопатії: хвороба “кленового сиропу”, цистинурія, |
|
|||
|
гіпероксалатурія, гомоцистинурія та ін. Визначення суми |
|
|||
|
відновленого глутатіону тацистеїну |
|
|
|
|
30. |
Індивідуальні шляхи обміну циклічних амінокислот. |
2 |
|||
|
Молекулярні хвороби на прикладі порушень обміну |
|
|||
|
фенілаланіну та тирозину. Хроматографія амінокислот на |
|
|||
|
папері |
|
|
|
|
31. |
Нуклеопротеїни: визначення, будова, травлення в ШКТ. |
2 |
|||
|
Нуклеїнові кислоти: визначення, класифікація, будова, |
|
|||
|
характеристика, біологічне значення. Якісний аналіз |
|
|||
|
гідролізату нуклеопротеїнів |
|
|
|
|
32. |
Метаболізм |
нуклеотидів. |
Патологія |
обміну: |
2 |
|
гіперурикемія, подагра, оротатацидурія. Якісне та кількісне |
|
|||
|
визначення сечової кислоти в біологічних рідинах |
|
|
||
33. |
Молекулярна біологія. Генетичний код. Реплікація. |
2 |
|||
|
Визначення вмісту ДНК в біологічних рідинах |
|
|
||
34. |
Транскрипція. Процесінг. Інгібітори транскрипції. |
2 |
|||
|
Визначення вмісту РНК в біоматеріалі |
|
|
|
|
35. |
Трансляція. Інгібітори трансляції. Посттрансляційна |
2 |
|||
|
модифікація білків. Виділення казеїну з молока та якісні |
|
|||
|
реакції набілковий компонент |
|
|
|
|
36. |
Регуляція експресії генів у прокаріт та еукаріот. |
2 |
|||
|
Вирішення ситуаційних задач |
|
|
|
|
37. |
Молекулярні механізми мутацій. Генна інженерія. |
2 |
|||
|
Визначення гомогентизинової та |
фенілпіровиноградної |
|
||
|
кислот в сечі |
|
|
|
|
38. |
Підсумкове |
заняття зі |
змістових модулів 11, 12, 13 |
2 |
|
|
(ПМК-3) |
|
|
|
|
39. |
Гормони: визначення, класифікація, регуляція синтезу та |
2 |
|||
|
секреції, загальна характеристика гормонів та гормоноподібних |
|
|||
|
речовин. Біохімія міжклітинних комунікацій. Якісні реакції на |
|
|||
|
інсулін, адреналін, тироксин |
|
|
|
|
40. |
Молекулярні |
механізми |
трансдукції |
гормонального |
2 |
|
сигналу. Апоптоз: поняття, сигнальні системи. Визначення |
|
|||
|
метаболітів нітроген монооксиду (NO) в слині |
|
|
||
41. |
Регуляція метаболізму гормонами центральних та |
2 |
|||
|
периферійних ендокринних залоз. Якісна реакція на тироксин. |
|
|||
|
Визначення 17-кетостероїдів в сечі |
|
|
||
42. |
Характеристика гормонів залоз змішаної секреції. |
2 |
|||
|
Гормональна регуляція гомеостазу кальцію і фосфатів. Вплив |
|
|||
|
інсуліну таадреналіну нарівень глюкози крові |
|
|
||
43. |
Вітаміни: визначення, історія відкриття, основні поняття |
2 |
|||
|
вітамінологіі. Номенклатура та класифікація вітамінів. |
|
|||
|
Вітаміноподібні речовини. Характеристика вітамінів С та Р. |
|
|||
9

|
Кількісневизначення вітаміну С в молоці тавітаміну Р в чаї |
|
|||||
44. |
Характеристика водорозчинних вітамінів групи В: назви, |
2 |
|||||
|
коферментні та некоферментні функції, харчові джерела, добова |
|
|||||
|
потреба, ознаки авітамінозу, біомедичне застосування. Якісні |
|
|||||
|
реакції наводорозчинні вітаміни |
|
|
|
|
||
45. |
Жиророзчинні вітаміни: коферментні, некоферментні та |
2 |
|||||
|
гормональні функції. Ознаки та причини авітамінозів та |
|
|||||
|
гіпервітамінозів. Біомедичне застосування жиророзчинних |
|
|||||
|
вітамінів. Якісні реакції нажиророзчинні вітаміни |
|
|||||
46. |
Кров як біологічна рідина: функції, фізико-хімічні |
2 |
|||||
|
константи. Хімічний склад крові в нормі і при патології. |
|
|||||
|
Небілкові азотвмісні та безазотисті компоненти крові. |
|
|||||
|
Залишковий азот. Азотемії. Кількісне визначення хлоридів крові |
|
|||||
|
заметодом Рушняка |
|
|
|
|
|
|
47. |
Білки плазми крові. Білки гострої фази запалення. |
2 |
|||||
|
Ферменти крові, індикаторні ферменти. Кінінова сискрові. |
|
|||||
|
Виділення фібриногену в плазмі крові |
|
|
|
|||
48. |
Особливості обміну речовин в еритроцитах. Гемоглобін: |
2 |
|||||
|
будова, види, |
сполуки, |
біосинтез, |
патологія. Гемоглобінози |
|
||
|
(гемоглобінопатії, талассемії), порфірії. Якісна реакція на гем |
|
|||||
|
гемоглобіну. Визначення наявності крові на медичному |
|
|||||
|
інструментарії |
|
|
|
|
|
|
49. |
Біохімічні функції печінки. Роль печінки у вуглеводному, |
2 |
|||||
|
ліпідному та білковому обміні. Кількісне визначення загального |
|
|||||
|
білкав плазмі крові біуретовим методом |
|
|
||||
50. |
Пігментний обмін. Катаболізм гемоглобіну в тканинах. |
2 |
|||||
|
Жовтяниці. Кількісне визначення загального білірубіну в крові. |
|
|||||
|
ПробаФлорансанауробілін |
|
|
|
|
||
51. |
Детоксикаційна функція печінки. Загальні шляхи |
2 |
|||||
|
метаболізму |
ксенобіотиків. |
І |
фаза |
біотрансформації |
|
|
|
ксенобіотиків: реакції гідроксилювання і деалкілування. |
|
|||||
|
Амідопіриновий тест |
|
|
|
|
|
|
52. |
Метаболізм ксенобіотиків: ІІ та ІІІ фази біотрансформації. |
2 |
|||||
|
Реакції кон’югації. Визначення метаболітів аніліну в сечі |
|
|||||
53. |
Водно-мінеральний обмін. Класифікація та біологічне |
2 |
|||||
|
значення мінеральних речовин. Вода: будова, біологічне |
|
|||||
|
значення, обмін. Гормональна регуляція водно-мінерального |
|
|||||
|
обміну. Якісні реакції наіони кальцію, магнію, фосфати |
|
|||||
54. |
Біохімія нирок та сечі. Нормальні та патологічні |
2 |
|||||
|
компоненти сечі. Титраційна кислотність сечі. Фізико-хімічні |
|
|||||
|
властивості сечі |
|
|
|
|
|
|
55. |
Підсумкове заняття зі змістових модулів 15, 16, 17, 18 |
2 |
|||||
56. |
Біохімія |
м’язової |
тканини. |
Енергопостачаючі процеси |
2 |
||
м’язового скорочення. Визначення креатиніну в сечі
10
57. |
Біохімія сполучної тканини. Особливості будови колагену |
2 |
|
та еластину. Ферменти деградації сполучної тканини. Якісна |
|
|
реакція наглікозаміноглікани |
|
58. |
Біохімія нервової тканини. Типи рецепторів. Обмін |
2 |
|
медіаторів. Спинномозкова рідина. Якісна реакція на |
|
|
ацетилхолін |
|
59. |
Підготовкадо іспиту |
2 |
|
І- етап. Практичні навички тавирішення ситуаційних задач |
|
60. |
ІІетап. Комп’ютернетестування (база тестів до іспиту) |
2 |
|
Разом |
120 |
Тема 1 «Вступне заняття. Предмет, задачі біохімії. Методи біохімічних досліджень. Амінокислоти (перевірка вихідного рівня знань). Правила техніки безпеки»
1.Актуальність теми: Біохімія – це наука, яка вивчає хімічний склад, обмін речовин та енергії, а також молекулярні основи функціонування живих організмів. Біохімія розкриває молекулярні механізми розвитку патологічних станів, дає можливість патогенетично обґрунтувати вибір методів діагностики та лікування захворювань, тому є теоретичною базою для патологічної фізіології та клінічних дисциплін. Біохімічні методи дослідження широко використовуються для діагностики захворювань, контролю ефективності лікування.
2.Загальна мета заняття: пояснити загальні вимоги кафедри, щодо організації навчального процесу, показати місце біохімії серед інших медико-біологічних дисциплін та її значення в системі вищої медичної освіти
3.Конкретні цілі: уміти
аналізувати етапи становлення біохімії як фундаментальної медико-біологічної науки та навчальної дисципліни
трактувати завдання основних розділів біохімії (статичної, динамічної, функціональної, медичної та клінічної біохімії)
пояснювати методологію біохімічних досліджень
пояснювати класифікацію, структуру, фізико-хімічні властивості амінокислот
4.Література:
Основна:
4.1. Ю.І. Губський «Біологічна хімія», Київ-Терн., 2000, с. 7-11
4.2.Я.І. Гонський і співав., «Біохімія людини», Терн., 2002, с.7-14
4.3.Л.М. Вороніна і співав., «Біолог. хімія», Хар., 2000, с. 4-6
4.4.Т.Т. Березов, Б.Ф.Коровкин «Биолог. химия», 1998, с.15-18
4.5Лекції, що читаються на кафедрі
Додаткова:
4.6.А. Ленинджер «Основы биохимии», М.,Мир, 1985, в 3-х томах
4.7.А.М. Горячковский “Справочное пособие по клинической биохимии, Одесса, 1994, 415 c.
4.8.І.Ф. Міщишен, А.П. Піщак “Біохімічний довідник для медика”, Чернівці, 2004, 78 с.
5. Основні питання заняття:
1. Організація навчального процесу на кафедрі: штати, підручники, студентський гурток, види самостійної та наукової роботи тощо.
11
2.Поведінка в навчальній біохімічній лабораторії та правила техніки безпеки
3.Визначення біохімії як науки, об’єкти та завдання біохімії
4.Розділи біохімії, досягнення та перспективи
5.Роль біохімії у дослідженні молекулярно-генетичних механізмів виникнення хвороб
6.Амінокислоти - класифікація, будова, фізико-хімічні властивості
6.Питання для самостійної позааудиторної роботи:
1.Досягнення біохімії в ХХІ сторіччі
2.Місце біохімії в системі фундаментальних медико-біологічних дисциплін
7.Завдання для закріплення матеріалу та самоконтролю:
7.1. Тести для перевірки вихідного рівня знань ( 10 тестів)
1. Якісною реакцією на пептидний зв’язок є: |
Вірна відповідь Е – біуретова: в |
А. реакція Фоля |
лужному середовищі іони міді |
В. ксантопротеїнова |
утворюють комплексну сполуку з |
С. діазореакція |
пептидним зв’язком бузково- |
D. нінгідринова |
фіолетового кольору. |
Е. біуретова |
|
7.2. Завдання для перевірки кінцевого рівня знань:
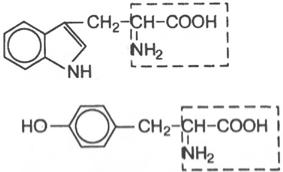
а) написати формули названих амінокислот: Триптофан
б) вкажіть назви представлених амінокислот
Тирозин
8. Лабораторна робота: Якісні реакції на білки та амінокислоти (див. практикум з біохімії
2008р.)
Тема 2. «Біомолекули. Прості та складні білки: будова, класифікація, фізико-хімічні властивості, біологічне значення. Рівні структурної організації білків»
1.Актуальність теми: склад живих організмів суттєво відрізняється від хімічного складу компонентів неживої природи на Землі, оскільки виникнення життя було пов’язане з відбором певних хімічних елементів. Біомолекули – сполуки, що входять до складу живих організмів та становлять сутність обміну речовин та фізіологічних функцій живих клітин, серед них головними молекулами є білки.
2.Загальна мета заняття: трактувати будову та значення простих та складних білків живого організму. Знати фізико-хімічні властивості та рівні структурної організації білків
12
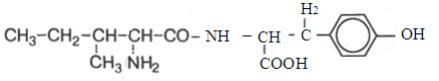
3.Конкретні цілі: уміти
пояснювати походження основних класів біомолекул
трактувати будову, фізико-хімічні властивості та біологічне значення простих та складних білків
пояснювати рівні структурної організації білків
користуватись формулами амінокислот для побудови пептидів
4.Література:
Основна:
4.1.Ю.І. Губський «Біологічна хімія», Київ-Терн., 2000, с. 12-72
4.2.Я.І. Гонський і співав., «Біохімія людини», Терн., 2002, с.15-62
4.3.Л.М. Вороніна і співав., «Біолог. хімія», Хар., 2000, с. 7-53, 81-106, 282-284, 348-350, 435-444
4.4.Т.Т. Березов, Б.Ф. Коровкин «Биолог. химия», 1998, с.19-111, 169-186
4.5 Лекції, що читаються на кафедрі
Додаткова:
4.5.А. Ленинджер «Основы биохимии», М., Мир, 1985, в 3-х томах
4.6.А.М. Горячковский “Справочное пособие по клинической биохимии, Одесса, 1994
4.7.І.Ф. Міщишен, А.П. Піщак “Біохімічний довідник для медика”, Чернівці, 2004, 78с.
5.Основні питання заняття:
1.Особливості хімічного складу живих організмів
2.Прості та складні білки: будова, класифікація, біологічне значення
3.Фізико-хімічні властивості білків. Денатурація білків
4.Рівні структурної організації білкової молекули
6.Питання для самостійної позааудиторної роботи:
1.Сучасні теорії походження біомолекул
2.Нуклеота хромопротеїни: будова, біологічне значення
7.Завдання для закріплення матеріалу
7.1. Завдання для перевірки вихідного рівня знань (10 тестів) |
D |
– |
||
1. Структурними мономерами простих білків є: |
Вірна |
відповідь: |
||
А. моносахариди |
амінокислоти. Білки - це |
|||
В. нуклеотиди |
біополімери, мономерами яких |
|||
С. гліцерин |
є α-амінокислоти, що сполучені |
|||
D. амінокислоти |
між собою пептиднимзв’язком. |
|||
Е. нуклеозиди |
|
|
|
|
7.2. Завдання для перевірки кінцевого рівня знань
а) побудувати трипептид:
аспарагіл-аланіл-лізин
б) назвіть пептид і вкажіть тип зв’язку між мономерами:
_______ізолейцилтирозин_____________________________________________________
8. Лабораторна робота: «Реакції осадження білків» (див. практикум з біохімії 2008р.)
13
Тема 3: “Основні поняття ензимології. Ферменти: номенклатура та класифікація, хімічна природа, будова та механізмдії ”
1.Актуальність теми: ферменти (ензими) - це високоспеціалізований клас речовин білкової природи чи фрагменти РНК (рибозими), які використовуються організмами для прискорення практично всіх реакцій синтезу, розпаду і взаємоперетворення хімічних сполук. У 1961 р. Міжнародним союзом біохімії та молекулярної біології всі ферменти були поділені на 6 класів за типом хімічних реакцій, що полегшило розуміння механізму дії різних ферментів. За хімічною природою ферменти є переважно білками і тому мають високу молекулярну масу, нездатні до діалізу, виявляють амфотерні властивості, електрофоретичну рухливість, підлягають денатурації під дією фізичних та хімічних чинників. Важливим доказом білкової природи ферментів є виділення їх в кристалічній формі. За будовою ферменти поділяються на прості (складаються лише з амінокислот) та складні (містять білкову частину – апофермент та небілкову частину – кофактор). Фермент взаємодіє з хімічними сполуками (субстратами) певною ділянкою – активним центром, в якому виділяють каталітичну ділянку (де відбувається акт каталізу) і контактну (де фермент зв’язується із субстратом). У окремих (алостеричних = регуляторних) ферментів можуть бути алостеричні (регуляторні) центри, на які діють різні регулятори (алостеричні ефектори) і змінюють активність ферментів. Механізм дії ферментів полягає у специфічній взаємодії активного центру ферменту з субстратом, утворенням фермент-субстратних комплексів та подальшим вивільненням продуктів реакції.
2.Загальна мета заняття: вміти використовувати знання про класифікацію ферментів, їх хімічну природу та будову для обґрунтування механізму дії та розуміння ролі ферментів
взабезпеченні життєдіяльності організму.
3.Конкретні цілі: знати
основні поняття ензимології (фермент, субстрат, продукт реакції)
роль ферментів в процесах життєдіяльності
принципи номенклатури та класифікації ферментів за типом хімічної реакції
хімічну природу та будову ферментів
механізм дії ферментів
4.Література:
Основна:
4.1.Ю.І. Губський “Біологічна хімія”, 2000, Київ-Тернопіль, с.86-87, 88-89, 99-103, 109.
4.2.Л.М. Вороніна та ін. “Біологічна хімія”, 2000, Харків, с.109-121, 122-129.
4.3.Я.І. Гонський та ін. “Біохімія людини”, 2002, Тернопіль, с. 66-67, 70-71, 81-83, 93-97.
4.4.Лекції, що читаються на кафедрі.
Додаткова:
4.5.Е.С. Северин «Биохимия», Москва, 2006, 747 с.
4.6.А. Ленинджер “Основы биохимии”, М., Мир, 1985, в 3-х томах.
4.7.А.М. Горячковский “Cправочное пособие по клинической биохимии”, Одесса, 1994, 415 с.
4.8.І.Ф. Міщишен, А.П.Піщак “Біохімічний довідник для медика”, Чернівці, 2004, 78 с.
4.9.Ж. Крю “Биохимия”, М., Мир, 1979.
5.0. Д. Мецлер « Биохимия», М., Мир, 1980, в 3-х томах
14
5.Основні питання теми:
1.Поняття про ферменти, субстрати, продукти реакції. Біологічне значення ферментів
2.Номенклатура та класифікація ферментів
3.Хімічна природа ферментів та її докази
4.Будова ферментів (простих і складних)
5.Активний центр ферментів: визначення, будова, структурні ділянки та їх функції
6.Алостеричні центри: визначення, будова, просторове розташування та функції Поняття про алостеричний ефект та регуляторні ферменти
7.Механізм дії ферментів: основні етапи
6.Питання для самостійної позааудиторної роботи:
1.Історія розвитку ферментології.
2.Механізм дії ферментів трипсину та холінестерази.
7.Завдання для закріплення матеріалу та самоконтролю:
7.1.Тести для перевірки вихідного рівня знань ( 10 тестів )
1. Які реакції каталізують оксидоредуктази? |
Вірна відповідь: С. Окисно- |
||
А. Перенос окремих хімічних груп |
відновні. Це ферменти, які беруть |
||
В. Синтезу |
участь |
в |
окисно-відновних |
С. Окисно-відновні |
реакціях |
|
|
D. Ізомеризації |
|
|
|
Е. Гідролізу |
|
|
|
7.2.Тести для перевірки кінцевого рівня знань збанку даних «Крок-1»
1.Фермент зумовлює перенос структурного фрагменту одного субстрата на інший з утворенням двох продуктів. Назвіть клас цього ферменту:
A. Ізомераза
B. Оксидоредуктаза C. Лігаза
D. Трансфераза E. Гідролаза
2.Фермент L-глутамат: аміак-лігаза, що каталізує утворення глутаміну, відноситься до класу:
A. Трансфераз B. Синтетаз C. Ізомераз
D. Оксидоредуктаз E. Гідролаз
3.Ферменти, що беруть участь в синтезі речовин з використанням енергії, відносяться до класу:
A. Оксидоредуктаз B. Трасфераз
C. Гідролаз D. Лігаз E. Ліаз
4.Фермент гістидиндекарбоксилаза, що каталізує перетворення гістидину до вазоактивного медіатора гістаміну, відноситься до класу:
A. Ліаз
B. Оксидоредуктаз C. Трансфераз
15
D.Гідролаз
E.Ізомераз
Примітка: Перевірка відповіді – див. база «КРОК-1» Біохімія
(http:// biochem.vsmu.edu.ua/)
7.3.Ситуаційні задачі
1.У хворого з гіпоацидним гастритом виявлено зменшення активності пепсину в шлунковому соці.
До якого класу ферментів відноситься пепсин? Який тип реакцій каталізує цей фермент?
За структурою цей фермент є простим чи складним? Відповіді:
Пепсин відноситься до 3-го класу ферментів-гідролаз, які розщеплюють субстрат в присутності води. За структурою фермент є простим.
Лабораторна робота: Відкриття дії ферментів пепсину та ліпази (див. практикум з біохімії 2008р.)
Тема 4: «Властивості ферментів. Кінетика та енергетика ферментативних реакцій. Принципи визначення та одиниці ферментативної активності»
1.Актуальність теми: на відміну від неорганічних каталізаторів ферменти виявляють високу каталітичну активність при температурі 38-40оС (в діпазоні температури тіла) і в межах нейтральних значень рН середовища (в діапазоні внутрішньоклітинних значень рН). Ферменти відрізняються високою специфічністю (вибірковістю) дії у відношенні до хімічної природи субстрату. Окремі з них здатні каталізувати перетворення лише однієї хімічної речовини (абсолютна специфічність) та певних стереоізомерів (стереоструктурна специфічність), тоді як більшість ферментів каталізують перетворення певних груп речовин з однаковим типом хімічних зв’язків (відносна специфічність). Відмінністю ферментів від неорганічних каталізаторів є залежність їх активності від низки чинників, які вивчає ферментативна кінетика. Активність ферментативної реакції залежить від хімічної природи речовин, що реагують (ферменту, субстратів), і умов їх взаємодії (концентрації, рН середовища, температури, наявності активаторів та інгібіторів). Активність ферментів можна визначити за принципом зникнення субстратів або накопичення продуктів в ході каталізованої реакції (за оптимальних умов їх дії).
2.Загальна мета заняття: вміти пояснювати основні властивості ферментів, кінетику та енергетику ферментативних реакцій, застосовувати ці знання для пояснення ролі ферментів
узабезпеченні життєдіяльності організму та біомедичній практиці.
3.Конкретні цілі: знати
відмінності ферментів від небіологічних каталізаторів
властивості ферментів як біокаталізаторів, умови їх дії
особливості кінетики та енергетики ферментативних реакцій
принципи та одиниці визначення ферментаивної активності
4.Література:
Основна
1. Ю.І. Губський «Біологічна хімія», 2000, Київ-Тернопіль, с. 87, 98-99, 103-105, 106
16
2.Я.І. Гонський та ін. «Біохімія людини», 2002, Тернопіль, с. 74-78, 81, 83-86, 100
3.Л.М. Вороніна та ін. «Біологічна хімія», 2000, Харків, с. 129-137
4.Лекції, що читаються на кафедрі.
Додаткова
1.А. Ленинджер «Основы биохимии», М., Мир, 1985, в 3-х томах.
2.А.М. Горячковский «Справочное пособие по клинической биохимии», Одесса, 1994, 415 с.
3.І.Ф. Міщишен, А.П. Піщак «Біохімічний довідник для медика», Чернівці, 2004, 78 с.
4.Ж. Крю «Біохімія», М.Мир, 1979.
5.Д. Мецлер «Биохимия», М., Мир, 1980, в 3-х томах.
6.Е.С. Северин «Биохимия», Москва, 2006, 747 с.
5. Основні питання теми:
1.Властивості ферментів як біокаталізаторів: специфічність дії, її види; термолабільність, залежність активності від рН середовища.
2.Поняття про кінетику ферментативних реакцій (залежність швидкості ферментативних реакцій від концентрації субстрату, ферменту, значення константи Міхаеліса).
3.Поняття про енергетику ферментативних реакцій (енергетичний бар’єр та енергія активації).
4.Принципи визначення та одиниці ферментативної активності.
6. |
Питання для самостійної позааудиторної роботи: |
|
|
|
1. |
Властивості ферментів спільні з небіологічними каталізаторами |
|
|
|
2. |
Методи визначення константи Міхаеліса. Графік залежності швидкості ферментативної |
|||
реакції від концентрації субстрату в обернених координатах Лайнуівера-Берка. |
||||
7. |
Завдання для закріплення матеріалу та самоконтролю: |
|
|
|
|
7.1. Тести для перевірки вихідного рівня знань: ( 10 тестів) |
|
|
|
|
1. Який оптимум рН мають більшість |
Вірна відовідь: С. 6,0 – 8,0 |
||
|
ферментів? |
Більшість клітинних ферментів |
||
|
А. 1,5 – 3,5 |
проявляють |
сво |
максимальну |
|
В. 3,5 – 6,5 |
активність |
при |
фізіологічих |
|
С. 6,0 – 8,0 |
заченнях рН (від слабко кислого |
||
|
D. 8,5 – 9,0 |
до слабко лужного середовища) |
||
|
Е. 9,0 – 10,0 |
|
|
|
7.2.Тести для перевірки кінцевого рівня знань збанку даних «Крок-1».
1.Оптимум рН для дії пепсину:
A.2-3
B.3-4
C.1-2
D.4-5
E.6-8
2.Абсолютна специфічність властива ферменту:
A.амілазі
B.пепсину
C.уреазі
D.алкогольдегідрогеназі
E.фосфатазі
3.З наведених тверджень вірним є:
A.Кm не залежить від рН, температури та іонної сили ферментативної реакції
B.Vmax не залежить від концентрації ферменту
C.Кm залежить від концентрації ферменту
17
D.Кm дорівнює концентрації субстрату, при якій швидкість ферментативної реакції становить половину від Vmax
E.Кm дорівнює концентрації субстрату, при якій швидкість ферментативної реакції є максимальною
Примітка: Перевірка відповіді – див. база «КРОК-1» Біохімія
(http:// biochem.vsmu.edu.ua/)
7.3.Ситуаційні задачі
1.У хворого з хронічним гастритом відмічається зменшення активності пепсину, рН шлункового соку становить 5,0.
Поясність причину зниження активності пепсину.
Зякою метою таким хворим раніше призначали вживати перед їжею слабкий розчин соляної кислоти?
Який тип специфічності характерний для цього ферменту?
Відповіді: Максимальну активність фермент пепсин проявляє в кислому середовищі (оптимум рН 1,5-2,0). При хронічному гастриті кислотність шлунку зменшується, фермент стає менш активним і тому доцільним було вживання слабкого розчину соляної кислоти. Пепсин є простим ферментом
8. Лабораторна робота: Властивості ферментів (специфічність дії, залежність ферментативної активності від рН середовища та температури – термолабільність) (див. практикум з біохімії 2008р.)
Тема 5: «Регуляція ферментативної активності. Активатори та інгібітори ферментів»
1.Актуальність теми: на активність ферментів значно впливає наявність в середовищі активаторів (речовин, що збільшують швидкість реакції) та інгібіторів (речовин, що гальмують швидкість реакції). За механізмом дії інгібітори ферментів подялються на неконкурентні та конкурентні. Останні широко використовуються в якості лікарських препаратів (сульфаніламіди, прозерин, непрямі антикоагулянти та ін.). Ферментативна активність регулюється також концентрацією субстрату та ферменту, за допомогою хімічних модифікацій молекул ферментів, а також на генетичному рівні (за рахунок зміни кількості молекул ферментів).
2.Загальна мета заняття: засвоїти закономірності впливу активаторів, інгібіторів та інших факторів на швидкість ферментативних реакцій
3.Конкретні цілі: знати
класифікацію та принципи дії активаторів ферментів
типи гальмування ферментативних реакцій
класифікацію та принципи дії інгібіторів ферментів
використання інгібіторів ферментів в медичній практиці
види регуляції ферментативної активності
4.Література:
Основна:
1.Ю.І. Губський «Біологічна хімія», 2000 р., Київ-Тернопіль. С. 106-108, 108-114
2.Я.І. Гонський та ін. «Біохімія людини», 2002 р., Тернопіль. С. 86-93, 98-100
3.Л.М. Вороніна та ін. «Біологічна хімія», 2000 р., Харків. С. 137-147
4.Лекції, що читаються на кафедрі.
18
Додаткова:
1.А.Ленинджер «Основы биохимии», М., Мир, 1985 г., в 3-х томах.
2.А.М.Горячковский «Справочное пособие по клинической биохимии», Одесса, 1994 г., 415с.
3.І.Ф.Міщишен, А.П.Піщак «Біохімічний довідник для медика», Чернівці, 2004 р., 78 с.
4.Е.С.Северин «Биохимия», Москва, 2006 г., 747с
5.Основні питання теми
1.Активатори ферментів: визначення, представники, механізм дії.
2.Типи гальмування ферментативних реакцій. Інгібітори ферментів: визначення, представники, механізм дії.
3.Використання інгібіторів ферментів в медичній практиці.
4.Принципи та види регуляції активності ферментів.
6. Питання для самостійної позааудиторної роботи:
1. Вплив конкурентних та неконкрентних інгібіторів на кінетику ферментативних реакцій.
7.Завдання для закріплення матеріалу та самоконтролю:
7.1.Тести для перевірки вихідного рівня знань ( 10 тестів)
1. Як діють інгібітори під час конкурентного |
Вірна |
відповідь: |
А. |
Інгібітор |
гальмування? |
з’єднується з контактною ділянкою |
|||
А. Інгібітор з’єднується з контактною |
активного центру ферменту – заважає |
|||
ділянкою активного центру ферменту |
приєднаннюдо ферменту субстрату. |
|||
В. Інгібітор приєднується до ферментсубстратного комплексу С. Інгібітор зв’язується з коферментом
D. Інгібітор з’єднується з ферментом в алостеричному центрі Е. Інгібітор з’єднується з субстратом
7.2.Тести для перевірки кінцевого рівня знань збанку даних «Крок-1».
1.Ціаніди блокують дію цитохромоксидази, сполучаючись з іонами заліза, які входять до активного центру ферменту. Який вид гальмування (інгібування) має місце?
A. конкурентне B. алостеричне C. неконкурентне D. зворотнє
E. безконкурентне
2.В середовище, що містить сукцинат та фермент сукцинатдегідрогеназу (СДГ), додали інгібітор малонат. При збільшенні концентрації субстрату активність ферменту відновилась. Назвіть тип інгібування:
A. алостеричне B. необоротне
C. оборотне неконкурентне D. зворотнє
E. оборотне конкурентне
3.Одним із шляхів регуляції активності ферментів в організмі людини є їх ковалентна модифікація. Який варіант ковалентної модифікації має місце при регуляції активності ферментів глікогенфосфорилази та глікогенсинтетази?
A. АДФ-рибозилювання B. метилювання
C. фосфорилювання-дефосфорилювання D. гідроліз
19
E.сульфування
4.Препарати ртуті, миш’яку, вісмуту є інгібіторами ферментів, що мають тіолові групи (SHгрупи) в активних центрах. Яку амінокислоту використовують для реактивації цих ферментів?
A.гліцин
B.валін
C.цистеїн
D.глутамат
E.серін
5.Пацієнту для зниження артеріального тиску призначено каптоприл - інгібітор ангіотензинперетворюючого ферменту, який перетворює ангітензин І в ангіотензин ІІ
(профермент у фермент) шляхом:
A.метилюваня
B.фосфорилювання
C.дезамінування
D.обмеженого протеолізу
E.декарбоксилювання
Примітка: Перевірка відповіді – див. база «КРОК-1» Біохімія
(http:// biochem.vsmu.edu.ua/)
7.3.Ситуаційні задачі
1.Хворому після інсульта для відновлення м’язової рухливості призначили серед інших препаратів прозерин.
Активність якого ферменту гальмує прозерин? До якого типу інгібіторів він відноситься?
Концентрація якого метаболіту (нейромедіатору) буде зростати в м’язах при дії прозерину?
Відповідь: Прозерин є конкурентним інгібітором ферменту ацетилхолінестерази (АХЕ), який розщеплює нейромедіатор ацетилхолін на оцтову кислоту і холін. В крові зростає концентрація ацетилхоліну.
8. Лабораторна робота: Вплив активаторів та інгібіторів на активність амілази слини (див. практикум з біохімії 2008р.)
Тема 6: «Клітинна організація ферментативної активності. Ізоферменти, мультиферментні комплекси. Основи медичної ензимології»
1.Актуальність теми: головною ознакою живих організмів є постійний обмін речовин, що відбувається за участю ферментів. Спадкові вади обміну речовин є результатом дефектів генів, які відповідають за синтез певних білків-ферментів. Порушення метаболізму в деяких випадках проявляється виникненням важких ензимопатій. Визначення активності ферментів в біорідинах організму дозволяє провести діагностику різних хвороб. Ферменти широко використовуються в якості лікарських засобів. Це підкреслює необхідність знань медичної ензимології для лікаря.
2.Загальна мета заняття: вміти використовувати відомості про ферменти для діагностики захворювань, ензимотерапії та розкриття механізмів розвитку ензимопатій.
3.Конкретні цілі: знати
клітинну організацію ферментативної активності у відповідності до функцій органел
20
будову ізоферментів та мультиферментів, приклади, їх роль в обміні речовин
діагностичну цінність визначення спектру ізоферментів в диференціюванні захворювань
причини виникнення молекулярних (спадкових) хвороб - ензимопатій
нормальні показники активності деяких ферментів та їх зміни при захворюваннях (ензимодіагностика)
принципи використання ферментів, коферментів та інгібіторів в якості лікарських препаратів (ензимотерапія)
4.Література:
Основна
1.Ю.І. Губський «Біологічна хімія», 2000 р., Київ-Тернопіль. С. 114
2.Я.І. Гонський та ін. «Біохімія людини», 2002 р., Тернопіль. С. 71-74, 101-102
3.Л.М. Вороніна та ін. «Біологічна хімія», 2000 р., Харків. С. 148-160
4.Лекції, що читаються на кафедрі.
Додаткова
1.А. Ленинджер «Основы биохимии», М., Мир, 1985 г., в 3-х томах.
2.А.М. Горячковский «Справочное пособие по клинической биохимии», Одесса, 1994 г., 415с.
3.І.Ф. Міщишен, А.П. Піщак «Біохімічний довідник для медика», Чернівці, 2004 р., 78 с.
4.Е.С. Северин «Биохимия», Москва, 2006 р., 747с
5.Основні питання теми:
1.Клітинна організація ферментів в залежності від функцій органел, мембранозалежні ферменти
2.Ізоферменти, визначення, будова, приклади. Клінічне значення визначення ізоферментів в крові
3.Мультиферменти, визначення, будова, приклади, значення. Поліферментні системи
4.Медична ензимологія, визначення, напрямки: ензимопатологія, ензимодіагностика, ензимотерапія
6. Питання для самостійної позааудиторної роботи:
1. Підготувати реферат з теми: «Основні напрямки медичної ензимології».
7. Завдання для закріплення матеріалу та самоконтролю:
7.1.Тести для перевірки вихідного рівня знань: ( 10 тестів )
1.У крові хворого знайдено підвищену Вірна відповідь: А. Серцевого м’язу
активність МВ-форми креатинкінази, ЛДГ та |
При інфаркті міокарду внаслідок |
||
АСТ. Про ураження якого органу свідчать ці |
некрозу кардіоміоцитів в крові зростає |
||
зміни? |
активність |
3-х |
діагностичних |
А. Серцевого м’язу |
ферментівКФК МВ, ЛДГ1,2 і АСТ. |
||
В. Печінки |
|
|
|
С. Поперечно-смугастих м’язів |
|
|
|
D.Нирок |
|
|
|
Е.Головного мозку |
|
|
|
7.2. Тести для перевірки кінцевого рівня знань збанку даних «Крок-1».
1.У чоловіка 50-ти років, який довгий час зловживав алкоголем, виник сильний біль в животі. Лікар запідозрив гострий пакреатит. Збільшення активності якого ферменту в крові підтвердить цей діагноз?
21
A.трансамінази
B.амілази
C.ліпази
D.лактатдегідрогенази
E.креатинфосфкінази
2.Під час харчування новонародженої дитини молоком матері з’явилися блювання, метеоризм, пронос. Про спадкову недостатність якого ферменту слід думати?
A.лактази
B.мальтази
C.ізомерази
D.оліго-1,6-глюкозидази
E.пепсину
3.Ізоферменти широко використовують в діагностиці захворювань. Так, при інфаркті міокарду аналізують ізоферментний склад:
A.аланінамінотрансферази
B.аспартатамінотрансферази
C.лактатдегідрогенази
D.малатдегідрогенази
E.протеїнкінази
4.З гомогенатів тканин виділені ферментні білки, що каталізують взаємне перетворення лактату та пірувату. Білки відрізняються за елетрофоретичною рухливістю і молекулярною масою. Такі ферменти називають:
A.кофактори
B.холоферменти
C.коферменти
D.ізоферменти
E.проферменти
5.Назвіть фермент з перерахованих, що відноситься до мультиферментних комплексів:
A.малатдегідрогеназа
B.піруватдекарбоксилаза
C.лактатдегідрогеназа
D.піруватдегідрогеназа
E.алкогольдегідрогеназа
Примітка: Перевірка відповіді – див. база «КРОК-1» Біохімія
(http:// biochem.vsmu.edu.ua/)
7.3.Ситуаційні задачі
1.В ургентну клініку привезли хворого з підозрою на гострий панкреатит.
Зростання активності яких ферментів в крові та сечі дозволить підтвердити діагноз? Активність якого з ферментів підшлункової залози в сечі визначають за методом Вольгемута?
Вкажіть нормальні значення активності цього ферменту в сечі в од. Вольгемута.
Відповіді: При гострому панкреатиті в крові зростає активність травних ферментів, які виробляються в підшлунковій залозі, а саме трипсину, амілази, ліпази. За методом Вольгемута в сечі визначають активність амілази (діастази). Нормальні значення активності ферменту – 16-64 од.
8. Лабораторна робота: Визначення активності амілази в сечі за методом Вольгемута (див. практикум з біохімії 2008р.)
22
Тема 7: “Кофактори: визначення, класифікація за механізмомдії та хімічною природою. Невітамінні, вітаміноподібні та вітамінні кофактори Ігрупи”
1.Актуальність теми: Більшість ферментів є двокомпонентними, тобто складаються з білкової частини (апоферменту) і небілкової частини - кофактора. Апофермент відповідає за специфічність дії ферменту, а кофактори входять до складу каталітичної ділянки активного центру і безпосередньо беруть участь у перетворенні субстратів (каталізі). В залежності від виду зв’язку з апоферментом кофактори поділяються на коферменти (нековалентно зв’язані з білковою частиною) та простетичні групи (міцно, ковалентно зв’язані з білковою частиною). За хімічною природою кофактори класифікують на вітамінні, вітаміноподібні та невітамінні. За механізмом дії кофактори поділяються на 2 групи: І) переносники електронів, протонів та атомів водню; ІІ) переносники окремих хімічних групп атомів. Кофактори І групи забезпечують діяльність оксидоредуктаз (КФ1) і широко застосовуються в практичній медицині як лікарські препарати для покращення тканинного дихання та інших окисновідновних процесів.
2.Загальна мета заняття: знати будову складних ферментів та роль кофакторів у їх функціонуванні; засвоїти структуру кофакторів І групи, їх участь в окисно-відновних процесах в організмі та напрямки біомедичного застосування.
3.Конкретні цілі: знати:
структуру складних ферментів, роль апофермента та кофактора у їх функціонуванні
класифікації кофакторів за хімічною природою та механізом дії
будову та механізм дії представників кофакторів І групи – переносників електронів, протонів і атомів водню.
4.Література:
Основна:
1.Ю.І. Губський “Біологічна хімія”, 2000 р., Київ-Тернопіль, С. 89, 91-97.
2.Я.І. Гонський та ін. “Біохімія людини”, 2002 р., Тернопіль, С. 67-69.
3.Л.М. Вороніна та ін. “Біологічна хімія”, 2000 р., Харків, С. 117-118, 121-122, 442, 445, 448449, 454-455.
4.Лекції, що читаються на кафедрі
Додаткова:
5.А. Ленинджер “Основы биохимии”, М., Мир, 1985 г., в 3-х томах.
6.А.М. Горячковский “Cправочное пособие по клинической биохимии”, Одесса, 1994 г.
7.І.Ф. Міщишен, А.П.Піщак “Біохімічний довідник для медика”, Чернівці, 2004 р.
8.Ж. Крю “Биохимия”, М., Мир, 1979 г.
9.Д. Мецлер «Биохимия», М., Мир, 1980 г., в 3-х томах
5. Основні питання теми:
1.Структура складних ферментів. Роль апофермента та кофактора в біологічному каталізі
2.Класифікація кофакторів: за механізмом дії; за хімічною природою
3.Структура та біологічне значення невітамінних кофакторів І групи: гему, глутатіону
4.Структура та біологічне значення вітаміноподібних кофакторів І групи: убіхінону, ліпоєвої кислоти, тетрагідробіоптерину (ТГБП), хінонових коферментів
5.Структура та біологічне значення вітамінних кофакторів І групи: нікотинамідних (НАД, НАДФ), флавінових (ФМН, ФАД), 5-дезоксиаденозилкобаламіну, аскорбінової кислоти і токоферолу
23
6.Питання для самостійної позааудиторної роботи:
Застосування коферментів І групи в практичній медицині
7.Завдання для закріплення матеріалу та самоконтролю:
7.1.Тести для перевірки вихідного рівня знань ( 10 тестів)
1. Коферментні форми вітаміну В2 : |
Вірна відповідь: В ФАД, ФМН |
|
А. ТДФ, ТТФ |
Коферментними |
формами |
В. ФАД, ФМН |
вітаміну В2 (рибофлавіну) є |
|
С. НАД+, НАДФ+ |
ФМН(флавінмононуклеотид) і |
|
D. АТФ, АДФ |
ФАД |
|
Е. КоА-SH, ацетил КоА |
(флавінаденіндинуклеотид). |
|
7.2.Тести для перевірки кінцевого рівня знань збанку даних «Крок-1»
1.Гіповітаміноз С призводить до зменшення утворення органічного матриксу, затримці процесів ремінералізації, порушення синтезу колагену, тому що цей вітамін як кофактор бере участь у процесах:
А. Трансамінування аланіну і аспартату В. Карбоксилування проліну і лізину С. Дезамінування глутамату і аспартату D. Гідроксилування проліну і лізину Е. Амінування лізину і проліну
2.У експериментальних тварин з харчування виключили ліпоєву кислоту, при цьому у них спостерігалось гальмування піруватдегідрогеназного мультиферментного комплексу. Ліпоєва кислота для цього ферменту є:
A. Продуктом B. Субстратом C. Інгібітором
D. Алостеричним регулятором E. Коферментом
3.При малярії призначають препарати – структурні аналоги вітаміну В2 (рибофлавіну). Порушення синтезу яких ферментів в плазмодії викликають ці препарати?
A. Пептидаз
В. Цитохромоксидази С. ФАД-залежних дегідрогеназ
D. НАД-залежних дегідрогеназ Е. Амінотрансфераз
Примітка: Перевірка відповіді – див. база «КРОК-1» Біохімія
(http:// biochem.vsmu.edu.ua/)
7.3.Ситуаційні задачі
1.При патологічних станах, що супроводжуються гіпоксією, в тканинах накопичується
токсичний продукт – гідроген пероксиду (Н2О2), який викликає окисне пошкодження клітинних мембран.
Які ферменти знешкоджують Н2О2 в клітинах?
Назвіть кофактори, які беруть участь в знешкоженні Н2О2 Напишіть механізм дії одного з цих кофакторів
Відповіді: Знешкоджують пероксид водню в клітинах гемвмісні ферменти каталаза і пероксидаза та глутатіонвмісний фермент глутатіонпероксидаза.
Fe2+-e=Fe3+ Fe3+ +e= Fe2+
8.Лабораторна робота: Якісні реакції на вітамін С. (див. практикум з біохімії 2008р.)
24
Тема 8 “Кофактори II групи. Коферментні функції водота жиророзчинних вітамінів”
1.Актуальність теми: Кофактори ІІ групи є переносниками окремих хімічних груп. Вони класифікуються за хімічною природою на невітамінні, вітаміноподібні та вітамінні (останніх серед коферментів найбільше). Необхідність знань коферментних функцій вітамінів має значення для медицини, оскільки практично всі вони використовуються в якості лікарських засобів.
2.Загальна мета: вміти застосувати знання про структуру та функції кофакторів II групи для розкриття механізмів дії ферментів і лікарських засобів на основі цих кофакторів.
3.Конкретні цілі: знати
структуру та механізм дії основних представників кофакторів II групи
участь у метаболізмі кофакторів ІІ групи
4.Література:
Основна:
1.Ю.І. Губський “Біологічна хімія”,2000 р., Київ-Тернопіль, С. 91-95,400-408, 414-415.
2.Я.І. Гонський та ін. “Біохімія людини”, 2002 р.,Тернопіль, С. 67, 69, 120, 122, 124-5, 129, 133, 135, 137, 143, 147.
3.Л.М. Вороніна та ін. “Біологічна хімія”, 2000 р., Харків, С. 432, 440, 447, 450-452, 457.
4.Лекції, що читаються на кафедрі
Додаткова:
5.А. Ленинджер “Основы биохимии”, М., Мир, 1985г., в 3-х томах.
6.А.М. Горячковский “Cправочное пособие по клинической биохимии”, Одесса, 1994 г.
7.І.Ф. Міщишен, А.П. Піщак “Біохімічний довідник для медика”, Чернівці, 2004 р.
8.Ж. Крю “Биохимия”, М., Мир, 1979 г.
9.Д. Мецлер «Биохимия», М., Мир, 1980 г., в 3-х томах
5. Основні питання теми:
1.Структура, механізм дії, біологічне значення невітамінних кофакторів ІІ групи: фосфатів вуглеводів і фосфатів нуклеозидів.
2.Структура, механізм дії та біологічне значення вітаміноподібних й вітамінних кофакторів ІІ групи: карнітину, тіаміндифосфату (ТДФ), коензиму ацилування (КоА), піридоксальфосфату (ПАЛФ), біоцитину, тетрагідрофолієвої кислоти (ТГФК), метилкобаламіну, вітамінів А, К.
6. Питання для самостійної позааудиторної роботи:
1. Роль коферментів ПАЛФ, ТГФК та метилкобаламіну в процесах кровотворення 2. Застосування карнітину в клінічній практиці та спортивній медицині
7. Завдання для закріплення матеріалу та самоконтролю:
7.1. Тести для перевірки вихідного рівня знань ( 10 тестів) |
|
|
|
1.До вітамінних коферментів ІІ групи належать: |
Вірна відповідь: С ТДФ, ПАЛФ |
||
А. Убіхінон, гем |
Водорозчинні вітаміни |
В1(тіамін) і |
|
В. АТФ, ГТФ |
В6(піридоксин) |
в |
організмі |
С. ТДФ, ПАЛФ |
перетворюються |
на |
коферментні |
D. Фосфати вуглеводів і нуклеозидів |
форми – ТДФ(тіаміндифосфат) і |
||
Е. Глутатіон, карнітин |
ПАЛФ(піридоксальфосфат) |
||
7.2.Тести для перевірки кінцевого рівня знань збанку даних «Крок-1»
1.В клініку потрапила 1-річна дитина з ознаками ураження м’язів кінцівок і тулуба. Після обстеження виявлений дефіцит карнітину в м’язах. Біохімічною основою цієї патології є порушення процесу:
25
