
Казимирский А.Н. - Биоокисление
.pdf
Атомы железа в FexSx-центрах могут принимать или отдавать электроны переходя в ферро(Fe2+)- или ферри(Fe3+)- состояния. Железо-серные центры функционируют совместно с флавиновыми ферментами, принимая электроны от сукцинатдегидрогеназы (комплекс II) и дегидрогеназ, участвующих в окислении липидов.
Еще одним типом переносчиков электронов является ФМНсодержащий белок. ФМН (флавин-мононуклеотид) переносит электроны от НАДН на железо-серные центры (включен в состав комплекса I).
Cys |
S |
S |
Cys |
|
S |
|
Fe |
S Cys |
|
|
S |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
Fe |
Fe |
|
Cys S |
Fe |
S |
|
|
|
|
|
|
|
|
|
||
|
|
S |
|
|
|
|
|
|
Cys |
S |
S |
Cys |
|
|
|
|
|
|
|
|
|
|
Fe |
|
S |
|
|
|
|
|
Cys S |
|
|
||
|
|
|
|
|
S |
Fe |
S Cys |
|
|
|
|
|
|
|
|
||
Рис. 16 Строение Fe2S2 и Fe4S4 центров железо-серных белков.
В Fe2S2 центре каждый из двух атомов железа связан координационными связями с двумя атомами неорганической серы и двумя остатками цистеина в белке. В Fe4S4 четыре атома железа связаны с четырьмя атомами серы и четырьмя остатками цистеина в белке. Атомы железа в FexSx-центрах могут находиться в окисленном (Fe3+) или восстановленном (Fe2+) состоянии.
Единственный небелковый переносчик электронов – убихинон (коэнзим Q), названный так, потому, что с одной стороны он хинон, а с другой встречается повсюду (ubiquitous - вездесущий). Железо-серные центры отдают электроны убихинону, который включен в состав комплекса III.
O |
|
|
|
║ |
|
|
|
H3CO— |
—CH3 |
Рис. 17. Убихинон (Коэнзим Q, |
|
Q10) Очень длинный гидрофоб- |
|||
|
СН3 |
||
|
ный ―хвост‖ из 40 углеродных |
||
|
| |
||
|
атомов в 10 остатках изопрена |
||
H3CO— |
—(CH2–CH=C–CH2)10–Н |
||
дает возможность убихинону |
|||
|
|
легко перемещаться в неполяр- |
|
║ |
|
ном слое внутренней митохон- |
|
О |
|
дриальной мембраны. |
31
O |
|
|
|
|
O• |
|
OH |
|
║ |
|
|
|
|
│ |
|
│ |
|
R3 — |
— R2 |
|
R3— |
|
|
—R2 |
R3— |
—R2 |
|
|
|||||||
|
e- + H+ |
|
|
|
e- + H+ |
|
|
|
R4 — |
—R1 |
|
R4— |
|
|
—R1 |
R4— |
—R1 |
|
|
|||||||
║ |
|
|
|
|
│ |
|
│ |
|
О |
|
|
|
|
OH |
|
OH |
|
Коэнзим Q |
|
|
Семихинон |
|
Гидрохинон |
|
||
Окисленная форма |
Форма свободного радикала |
Восстановленная |
|
|||||
|
|
|
|
|
|
|
форма |
|
Q |
|
|
|
|
HQ∙ |
|
QH2 |
|
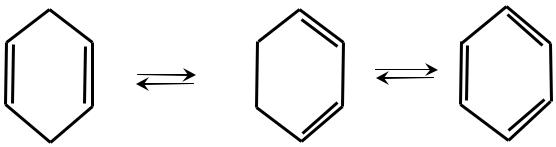
Рис. 18 Убихинон (КоQ) при восстановлении приобретает не только электроны, но и протоны. При одноэлектронном восстановлении он превращается в семихинон (органический свободный радикал), а при двухэлектронном в гидрохинон (убихинол, QH2). Промежуточное образование свободного радикала позволяет служить переносчиком не двух, а одного электрона.
Один из цитохромов — цитохром С не закреплен жестко в митохондриальной мембране, а свободно перемещается между III и IV комплексами по внешней стороне мембраны и переносит электрон. Цитохром С гемсодержащий водорастворимый белок, массой 12,5 кДа, содержит 104 аминокислотных остатка.
Коэнзим Q и цитохром С — мобильные переносчики электронов дыхательной цепи. Все другие белковые переносчики — интегральные белки, занимают в мембране строго фиксированное положение и ориентированы определенным образом.
НАД-зависимые и Флавиновые дегидрогеназы, НАДН-дегидрогеназа. Коэнзим Q-редуктаза митохондриальной цепи
НАД-зависимые и Флавиновые дегидрогеназы – ферменты, катализирующие реакции дегидрирования субстратов (I класс, оксидоредуктазы), катализируют реакции переноса электронов и протонов с субстрата на кофермент.
НАД-зависимые дегидрогеназы содержат НАД+ в активном центре и при взаимодействии с субстратом отбирают от него два электрона и протон, которые присоединяются к молекуле НАД+ образуя НАДН (Рис. 18). Поскольку НАД+ или НАДН находятся в активном центре дегидрогеназ не постоянно – их рассматривают в качестве вторых субстратов реакции и переносчиков электронов.
32

НН
+δ |
|
|
|
CO–NH2 |
CO–NH2 |
|
2e- + 2H+ |
|
+ |
|
+ H+ |
N |
2e- + 2H+ |
N |
│ |
|
│ |
R |
|
R |
НАД+ |
|
НАДН |
Рис. 19. В прямой реакции НАД+ присоединяет 2 электрона и протон от окисляемого субстрата. Второй протон остается в среде. В обратной реакции НАДН является донором электронов и протона.
Флавиновые дегидрогеназы содержат ФАД или ФМН (флавинадениндинуклеотид или флавинмононуклеотид) в активном центре. Флавиновые дегидрогеназы катализируют реакции переноса электронов в составе атомов водорода от субстрата на ФАД или ФМН (Рис. 20).
|
R |
|
|
R |
H |
|
|
|
|
||
|
│ |
N O 2H+ + 2e- |
|
│ |
│ |
Н3С |
N |
Н3С |
N |
N О |
|
Н3С |
|
NH 2H+ + 2e- |
Н3С |
|
NH |
|
N |
║ |
|
N |
║ |
|
|
O |
|
│ |
O |
|
|
|
|
H |
|
Рис. 20 Функциональная группа ФАД или ФМН присоединяет 2 электрона и 2 протона от субстрата.
НАДН-дегидрогеназа (НАДН-Q-редуктаза, комплекс I) состоит из нескольких полипептидных цепей. Роль небелковой (простетической) группы выполняет ФМН. Субстратом фермента является НАДН, с которого 2 электрона переносятся на ФМН с образованием ФМН-Н2. При этом второй протон поглощается из матрикса. С ФМН-Н2 электроны переносятся на ряд FeSбелков, играющих роль второй простетической группы этого фермента. От FexSx-центров (FeS, Fe2S2, Fe4S4) электроны переносятся на коэнзим Q. В процесс переноса электронов с НАДН-дегидрогеназы через FeS-белки на ко-
33
энзим Q (убихинон) он обратимо превращается в гидрохинон (QH2). Возможно также превращение коэнзима Q в форму семихинона при присоединении одного протона и одного электрона. Убихинон выполняет коллекторную функцию, присоединяя электроны от НАДН-дегидрогеназы и других флавиновых дегидрогеназ, таких как сукцинат-дегидрогеназа (комплекс II).
Система цитохромов дыхательной цепи, убихинол-дегидрогеназа (цитохром с-редуктаза). Цитохром с-оксидаза.
Гем-содержащие белки-переносчики электоронов в дыхательной цепи называются цитохромами. В зависимости от спектральных характеристик выделяют три группы цитохромов a, b и c. Их структурные особенности определяют различия в электрохимических потенциалах этих белков. Все цитохромы, кроме цитохрома С, включены в состав ферментативных комплексов дыхательной цепи.
QH2-Дегидрогеназа (Коэнзим Q-цитохром с-редуктаза, комплекс III) состоит из 2 типов цитохромов (b1 и b2) и цитохрома с1. QH2-Дегидрогеназа переносит электроны от убихинола (QH2) на цитохром C. В комплексе III электроны передаются от цитохромов b на FeS-центры, затем на цитохром с1 и затем на цитохром С.
Цитохром С выполняет роль переносчика электронов от комплекса III к комплексу IV. Это водорастворимый белок массой 12,5 кДа, содержит 104 аминокислотных остатка, который перемещается по внешней стороне внутренней митохондриальной мембраны.
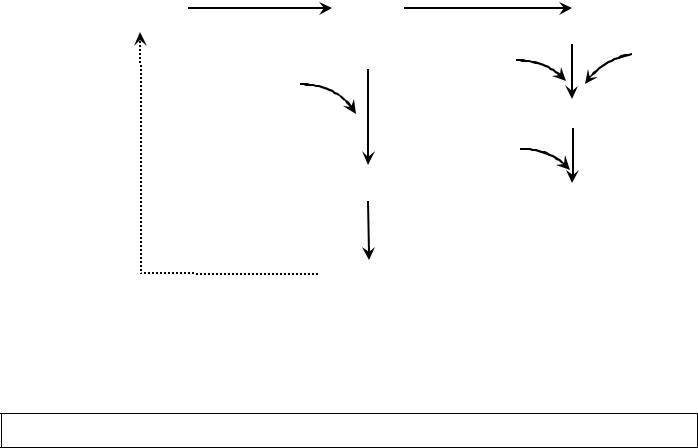
Цитохром с-оксидаза (комплекс IV) состоит из двух цитохромов типа аа3, каждый из которых имеет центр связывания с кислородом. Гем цитохромов типа а-а3 называют гем А. Он содержит вместо метильной (-СН3) и винильной (-СН=СН2) групп формильную (-СОН) группу и углеводородную цепь соответственно. Вторая особенность – наличие ионов меди в специальных белковых центрах (CuA-центры). Перенос электронов комплексом IV связан с изменением степени окисления ионов меди и железа в составе этого комплекса: Cu+ ↔ Cu2+ + e- и Fe2+ ↔ Fe3+ + e-. Этот ферментативный комплекс непосредственно переносит электроны на молекулярный кислород. При переносе электронов на О2 образуется, супероксид анион-радикал (супероксид радикал), далее гидропероксид-анион НО2‾, который связывая протон из митохондриального матрикса, превращается в пероксид водорода и далее восстанавливается до воды.
34
|
е‾ |
Н+ + е‾ |
|
|
•О2• |
‾О2• |
|
|
НО2‾ |
|
Супероксид |
Гидропероксид анион |
||
|
анион-радикал |
Н+ |
2е‾ |
|
|
2Н+ |
|
|
|
|
Супер- |
|
|
|
|
оксид- |
|
|
2ОН‾ |
|
дисмутаза |
2Н+ |
|
|
|
Н2О2 |
|
|
|
2 Н2О
Каталаза
О2 + Н2О
Рис. 21 Вода в V ферментативном комплексе образуется в результате переноса четырех электронов на молекулу кислорода. При переносе одного электрона образуется супероксид радикал кислорода, что ведет далее к образованию пероксида водорода. Два фермента – супероксиддисмутаза и каталаза защищают компоненты клетки от окисления супероксидным радикалом кислорода.
Дисмутация – процесс образования двух различных продуктов из одного субстрата
Табл. 4 Компоненты митохондриальной цепи переноса электронов
Название |
Простетическая |
Донор е- |
Акцептор е- |
|
компонента |
группа |
|
|
|
НАДН- |
ФМН, |
|
|
|
дегидрогеназа, |
НАДН |
Коэнзим Q |
||
2Fe2S2, 4Fe4S4 |
||||
комплекс I |
|
|
||
|
|
|
||
Коэнзим Q, |
- |
НАДН |
Комплекс III, |
|
убихинон |
(bc1) |
|||
|
|
|||
QH2- |
2Fe2S2, |
|
|
|
дегидрогеназа, |
QH2 |
Цитохром С |
||
гем b1, гем b2 |
||||
комплекс III |
|
|
||
|
|
|
||
Цитохром С |
Гем С |
Комплекс III |
Комплекс IV |
|
Цитохром С |
|
|
|
|
оксидаза, |
Гем А, Cu2+ |
Цитохром С |
O2 |
|
комплекс IV |
|
|
|
|
Сукцинат- |
ФАД, |
|
|
|
дегидрогеназа, |
Fe2S2, Fe3S4, |
Сукцинат |
Коэнзим Q |
|
комплекс II |
Fe4S4 |
|
|
35
Окислительное фосфорилирование — синтез АТФ за счет энергии электронов мигрирующих по дыхательной цепи. Также окислительным фосфорилированием называют синтез АТФ за счет энергии трансмембранного электрохимического потенциала. Электрохимический потенциал является результатом переноса протонов из митохондриального матрикса в межмембранное пространство. Перенос протонов обусловлен движением электронов по дыхательной цепи. Окислительное фосфорилирование состоит из двух независимых, но функционально тесно связанных процессов:
перенос электронов по дыхательной цепи, который катализируют фер-
ментативные комплексы (от НАДН или QН2 к молекулярному кислороду), из-за высокой разности в электрохимических потенциалов доноров электро-
нов (НАДН и QН2) и акцептора (О2) этот процесс является высоко экзергоническим и большая часть выделяющейся энергии используется для создания протонного градиента;
синтез АТФ с помощью ферментативного комплекса (комплекс V), называемого протон-транспортирующая АТФ-синтаза, фосфорилирование АДФ с образованием АТФ процесс эндергонический, при этом используется энергия уже созданного протонного градиента.
Коэффициент Р/О (коэффициент окислительного фосфорилирова-
ния) является мерой эффективности дыхания как поставщика энергии для синтеза АТФ. Коэффициент Р/О (или Р/2е-) численно равен отношению количества синтезированного АТФ к количеству атомов потребленного кислорода. Чем выше коэффициент, тем больше синтезируется АТФ в расчете на каждые 2 моль перенесенных электронов. В случае полной дыхательной цепи Р/О близок к 2,5 и в случае укороченной к 1,5.
Структурная организация дыхательной цепи
Все комплексы дыхательной цепи интегрированы во внутренней мембране митохондрий (рис. 21). Протон генерирующими являются комплексы I, III и IV.
Электроны поступают в дыхательную цепь различными путями. При окислении НАДН в комплекс I происходит перенос 2-х электронов от ФМН и FeS-центров на убихинон (Q). При этом через комплекс I переносятся 4 Н+.
Образующиеся при окислении сукцината, ацил-КоА, глицеролфосфата, дигидропиримидинов, дигидрооротовой кислоты и других субстратов электроны переносятся на убихинон (Q) комплексом II (при окислении сукцината) через связанный с ферментом ФАДН2 или через электрон переносящий флавопротеин (EFT). Прохождение пары электронов через комплекс II и убихинон сопровождается переносом 4-х протонов из матрикса.
36

|
Комплекс I |
Комплекс III |
Комплекс IV |
Комплекс V |
|||
|
4Н+ |
|
4Н+ |
|
с |
2Н+ |
9Н+ |
|
|
2e- |
Q |
c1 |
|
|
|
|
FeS |
2e- |
|
b2 |
FeS |
aa3 |
|
|
ФМН |
|
|
|
|
|
|
|
2е- |
комплекс |
|
b1 |
|
|
|
|
|
II |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2е- |
|
|
|
O2 |
|
|
4Н+ |
|
4Н+ |
|
|
2Н+ |
|
НАДН |
НАД+ ФАДН2 ФАД |
|
3 АДФ + 3 Pi |
|
АТФ- |
||
|
+ Н+ |
|
|
|
|
|
синтаза |
3 АТФ
Рис. 22 Компоненты дыхательной цепи – ферментативные комплексы (I-IV)
Последний протонгенерирующий комплекс (комплекс IV) — фермент цитохром С-оксидаза обеспечивает образование воды из электронов поступающих в него по дыхательной цепи, кислорода и протонов митохондриального матрикса. При этом через комплекс IV переносятся 2 Н+.
Таким образом, миграция пары электронов по полной дыхательной цепи сопровождается выбросом 10 протонов из матрикса. Создается трансмембранный электрохимический градиент, обусловленный различной концентрацией протонов в матриксе и межмембранном пространстве. Энергия этого электрохимического градиента расходуется на синтез АТФ в V комплексе дыхательной цепи (фермент – протон транслоцирующая АТФ-синтаза). Синтез АТФ сопряжен с обратным потоком протонов в матрикс (рис. 22).
Трансмембранный электрохимический потенциал как промежуточная форма энергии при окислительном фосфорилировании
Преобразование энергии электронов в энергию АТФ происходит в два этапа.
На первом энергия электронов преобразуется в энергию протонного градиента. Концентрация протонов в межмембранном пространстве больше чем в матриксе митохондрии. Поскольку каждый протон несет положительный заряд, вследствие этого появляется разность потенциалов по обе стороны мембраны. В совокупности электрический и концентрационный градиенты составляют электрохимический потенциал (ΔμН+). ΔμН+ - Источник энергии для синтеза АТФ. Активный транспорт протонов происходит в трех участках дыхательной цепи, в ферментативных комплексах I, III и IV (рис. 21). Эти участки часто называют пунктами сопряжения дыхания и фосфори-
37
лирования, хотя правильнее считать пунктом сопряжения окисления (дыхания) и фосфорилирования комплекс V, в котором синтезируется АТФ.
На втором этапе синтезируется АТФ.
Синтез АТФ. Фермент Н+-транслоцирующая АТФ синтаза (комплекс V) состоит из двух крупных белковых комплексов, каждый из которых построен из многих субъединиц. В структуре этого фермента выделяют протонный канал (Fо) и каталитическую часть фермента (F1) содержащую три активных центра. В каждый из активных центров поступают молекулы АДФ и неорганического фосфата (Ф). Протонный канал пронизывает внутреннюю митохондриальную мембрану, а каталитическая часть фермента представляет собой крупное грибовидное образование, обращенное в сторону матрикса. Ультразвуковая обработка интактных (неповрежденных) митохондрий вызывает остановку синтеза АТФ, поскольку каталитическая часть фермента F1 отделяется от протонного канала. При этом поступление потока протонов из межмембранного пространства в митохондриальный матрикс не нарушается.
Под действием потока протонов по каналу каталитическая часть АТФ синтазы (F1) вращается вокруг устья канала. Синтез АТФ проходит три стадии:
1)поступление АДФ и неорганического фосфата (Pi) в каталитический
центр,
2)поворот на 120о и сжимающая деформация каталитического центра, сближающая отталкивающиеся группы остатков фосфорной кислоты; на этой стадии происходит образование АТФ и молекулы воды,
3)поворот на 120о и освобождение из активного центра молекулы
АТФ.
Затем следует поворот на 120о АТФ синтазы и в освободившийся каталитический центр поступают новые молекулы АДФ и Pi (неорганического фосфата)
Структурная организация цепи переноса электронов
Электроны, мигрирующие по дыхательной цепи, движутся по сложным траекториям. Особенность их движения состоит в петлеобразных движениях в пределах каждого из ферментативных комплексов дыхательной цепи. В каждый комплекс поступают 4 протона на одну пару электронов.
Комплекс I (F-цикл). Суммарно можно представить, что молекула НАДН вносит 2 электрона в митохондриальную мембрану, еще 2 электрона поступают от FeS-белков и вместе с 4 протонами из матрикса совместно с 2 молекулами ФМН образуют комплекс ФМН-Н2, который перемещается к внешней поверхности мембраны.
38
Комплекс I |
Комплекс III |
|
|
Комплекс IV |
|||
F-цикл |
Q-цикл |
|
|
|
О-цикл |
||
2H+ |
2H+ |
4H+ |
|
c |
c |
|
2H+ |
|
|
|
|
|
|
||
(2)e- |
2e- |
FeS |
2e- FeS |
c1 |
2e- |
2e- Н2О2 О2 |
|
(2)ФМН-Н2 |
2QН2 |
2Q•‾ |
|
|
|
||
FeS |
(2)ФМН |
|
2e- |
|
а |
|
|
(2e-) |
|
2QН2 |
2Q |
|
4e- |
|
|
|
|
|
b1b2 |
|
|
|
Н2О2 |
|
|
|
|
|
|
|
|
(2)ФМН |
2e- |
|
|
а3 |
О2 |
||
2e- + 2H+ |
2Q |
|
|
|
|
|
|
2H+ |
2e- |
2e- +4H+ |
|
|
2e- |
2e- |
2e- + 2H+ |
|
|
|
|
1/2О2 +2H+ |
|
|
|
2H+ |
2H+ |
4H+ |
|
|
2H+ |
|
2H+ |
НАДН |
НАД+ ФАДН2 ФАД |
|
Н2О |
2ОН- |
|
2ОН- |
|
(Н+) |
2ОН- |
4ОН- |
Эндогенная вода |
|
|
||
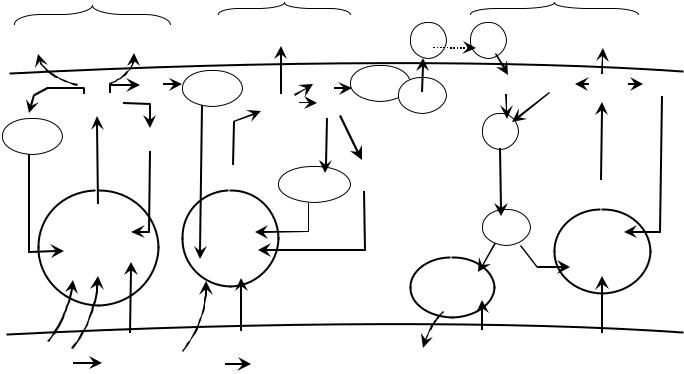
Рис. 22 Схема цепи переноса электронов во внутренней митохондриальной мембране через I, III и IV ферментативные комплексы. Приведена для демонстрации принципа трансформации энергии электронов в энергию протонного градиента. Ферменты не показаны.
Вблизи от поверхности мембраны комплекс распадается на 2 пары электронов, 4 протона и 2 ФМН.
Следует учитывать, что в комплексе I присутствует одна молекула ФМН, которая успевает 2 раза переместиться поперек мембраны, чтобы перенести 4H+.
Две пары электронов связываются двумя FeS-белками, имеющими более высокий редокс потенциал и переносятся к внутренней стороне мембраны к ФМН (одна пара электронов) и коэнзиму Q (вторая пара электронов). ФМН возвращается обратно, а протоны не имеют центров связывания и поэтому покидают мембрану. Участки выброса протонов из мембраны представляют собой 10-14 параллельных α-спиральных участков полипептидный цепей, поднимающихся от ферментативных комплексов перпендикулярно внешней стороне мембраны. Протоны передаются в межмембранное пространство по системе водородных связей, стабилизирующих α-спиральные участки.
39
Комплекс III(Q-цикл). Через систему FeS-белков 2е- (от комплекса I) переносятся к внутренней поверхности мембраны и с 2 протонами из матрикса взаимодействуют с коэнзимом Q (убихиноном), формируя комплекс QH2,, который представляет собой восстановленный убихинон. Еще одна молекула QH2 формируется в результате взаимодействия 2е- (их переносят в комплекс III цитохромы b1 и b2), с двумя протонами из матрикса и коэнзимом Q. Убихинон, являясь подвижным переносчиком электронов и протонов, переносит их к внешней митохондриальной мембране. В области внешней стороны мембраны 2 молекулы QH2, распадаются на 2 е-, 4 протона и 2 молекулы Q•‾ (семихинона). Электроны перехватывают FeS-белки (они содержат два Fe2S2 центра). Протоны покидают мембрану, а 2 молекулы Q• ‾ передают 2 электрона цитохромам b1 и b2 которые, в свою очередь, переносят их к коэнзиму Q. 2 Молекулы семихинона (Q• ‾), передав свои неспаренные электроны цитохромам b1 и b2, превращаются в форму коэнзима Q и возвращаются к внутренней стороне мембраны.
Два электрона через FeS-белки мигрируют к цитохрому с1. Цитохром с1, в свою очередь, передает электроны цитохрому С, который перемещается по внешней поверхности мембраны и является подвижным переносчиком электронов между III и IV комплексами.
Комплекс IV (O-цикл). В IV комплекс электроны вносит цитохром С. Через цитохромы а и а3 электроны поступают к внутренней поверхности мембраны, где совместно с протонами и молекулой кислорода превращаются в пероксид водорода (Н2О2). Он мигрирует к внешней поверхности мембраны и вновь распадается на кислород, электроны и протоны. Протоны выталкиваются из мембраны, а электроны с помощью цитохромов а и а3 вновь доставляются к внутренней поверхности мембраны, где взаимодействуют с кислородом и протонами из матрикса и образуют эндогенную воду. Особенность функционирования IV комплекса состоит в переносе через мембрану только 2-х протонов из матрикса. Это объясняется тем, что два другие протона из 4-х поступающих в IV комплекс расходуются на образование воды.
Регуляция цепи переноса электронов (дыхательный контроль).
Механизм регуляции образования и потребления АТФ называют дыхательным контролем. Повышение расхода АТФ ведет к увеличению концентрации АДФ и ускоряет интенсивность движения электронов по дыхательной цепи. Если АТФ в клетке не используется, то увеличивается еѐ внутриклеточная концентрация и интенсивность движения электронов по дыхательной цепи замедляется, при этом концентрация молекул АДФ в митохондриях низкая, энергия электронов преобразуется в основном в электрохимический мембранный потенциал, митохондрия в таком случае напоминает заряженный конденсатор. Происходит замедление работы Н+-АТФ-синтазы. Торможение этого фермента вызывает замедление электронного переноса в дыхательной цепи, поскольку НАДН не может быть окислен в НАД+. Возникающее высокое соотношение НАДН/НАД+ тормозит цикл трикарбоновых кис-
40
