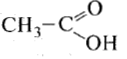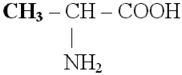- •Российский национальный исследовательский медицинский университет имени н.И. Пирогова
- •Содержание
- •Строение атома
- •Заряд атома нейтральный!
- •Заполнение орбиталей
- •Виды атомных орбиталей
- •Главные характеристики атома
- •Периодический закон и периодическая система химических элементов д.И. Менделеева
- •Физический смысл Периодического закона (на примере )
- •Закономерности изменения свойств элементов
- •Семейства химических элементов
- •Характер оксидов и гидроксидов I-VII групп
- •Химическая связь
- •Механизмы образования ковалентной связи
- •Способы перекрывания электронных облаков
- •Свойства ковалентной связи
- •Типы гибридизации
- •Кристаллические решетки
- •Сравнительная характеристика кристаллических решеток
- •Валентность и степень окисления
- •Правила определения степени окисления элемента в соединении
- •Химические реакции и закономерности их протекания Классификация химических реакций
- •Методы расстановки коэффициентов в уравнениях овр
- •Обратимые химические реакции. Химическое равновесие
- •Растворы. Электролитическая диссоциация
- •Способы выражения состава раствора
- •Теория электролитической диссоциации (1887 г., Сванте Аррениус)
- •Реакции ионного обмена
- •Гидролиз
- •Случаи гидролиза солей
- •Важнейшие классы неорганических соединений
- •Металлы
- •Неметаллы
- •Основные положения теории химического строения органических веществ а.М. Бутлерова
- •Классификация органических соединений
- •I. Классификация по наличию функциональных групп
- •II. Типы изомерии
- •Углеводороды
Основные положения теории химического строения органических веществ а.М. Бутлерова
1) Атомы в молекулах соединены между собой в определенном порядке химическими связями согласно их валентности; углерод во всех органических соединениях четырехвалентен.
2) Свойства вещества определяются не только качественным составом, но и его строением, взаимным влиянием атомов, как связанных между собой химическими связями, так и непосредственно не связанных.
3) Строение молекул может быть установлено на основе изучения их химических свойств.
Классификация органических соединений
I. Классификация по наличию функциональных групп
|
Функциональная группа |
Название класса соединений |
Примеры | |||
|
Формула |
Название | ||||
|
-OH |
Гидроксильная группа |
Спирты |
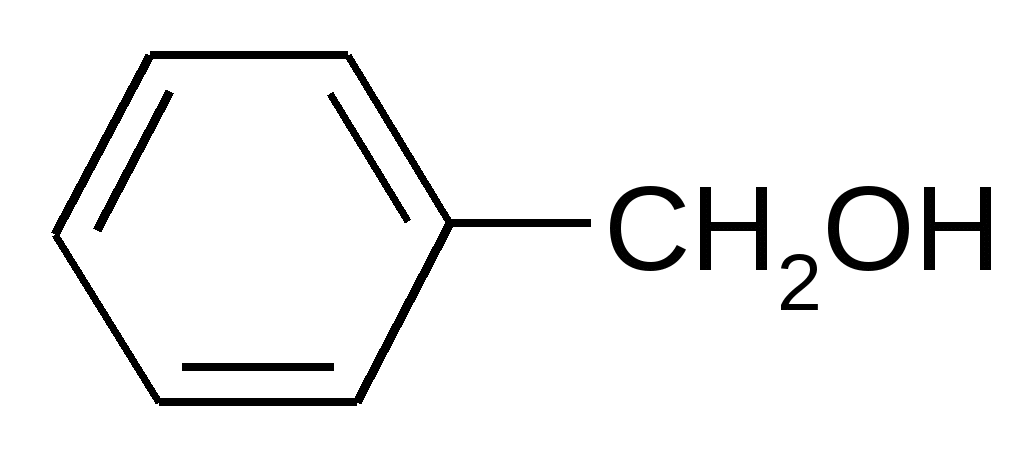
Предельные CH3-CH2OH Непредельные CH2=CH-CH2OH Многоатомные CH2OH-CHOH-CH2OH Ароматические
| ||
|
Фенолы |
| ||||
|
-С=ОН |
Карбонильная группа |
Кетоны |
| ||
|
|
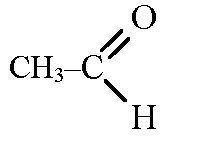
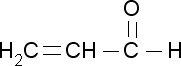
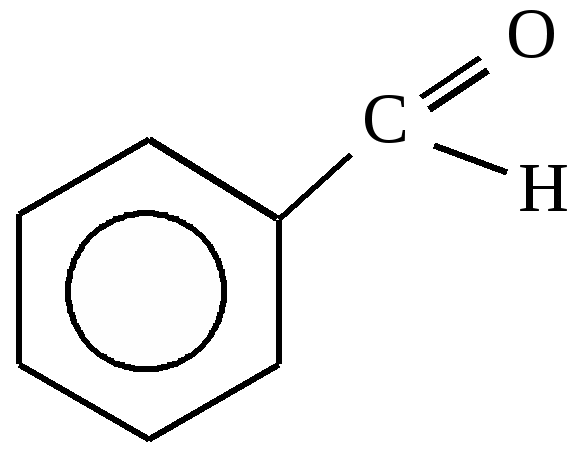
Альдегидная группа |
Альдегиды |
Предельные
Непредельные
Ароматические
| ||
|
|
Карбоксильная группа |
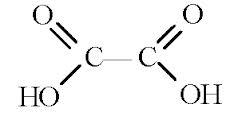
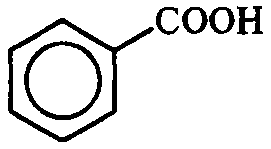
Карбоновые кислоты |
Одноосновные предельные
Двухосновные предельные
Ароматические
| ||
|
-NO2 |
Нитрогруппа |
Нитросоединения |
CH3-NO2 | ||
|
-NH2 |
Аминогруппа |
Амины |
CH3-NH2 | ||
|
-NH2, -COOH |
Аминогруппа и карбоксильная группа |
Аминокислоты |
| ||
|
CnH2n+2 |
- |
Алканы |
CH3-CH3 | ||
|
CnH2n |
- |
Алкены |
CH2=CH2 | ||
|
CnH2n-2 |
- |
Алкины |
HC=CH | ||
|
CnH2n-2 |
- |
Алкадиены |
CH2=CH-CH=CH2 | ||
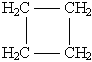
|
CnH2n |
- |
Циклоалканы |
| ||
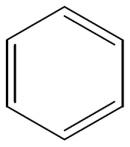
|
CnH2n-6 |
- |
Арены (ароматические соединения) |
| ||
II. Типы изомерии
1) Структурная изомерия
а)
Изомерия
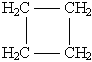
углеродной цепи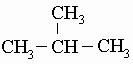
CH3-CH2-CH2-CH3 и
б) Изомерия положения кратной связи
CH2=CH-CH2-CH3 и CH3-CH=CH=CH3
в) Изомерия положения функциональной группы
CH3-CH2-CH2OH и CH3-CHOH-CH3
2) Межклассовая изомерия
а)
CH2=CH-CH2-CH3
и
б)
![]() иCH2=C=CH2
(обратите
внимание на формулу пропина!)
иCH2=C=CH2
(обратите
внимание на формулу пропина!)
в) CH3-CH2OH и CH3-O-CH3
г)
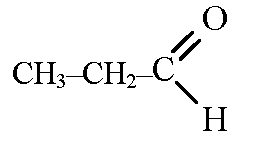 и
и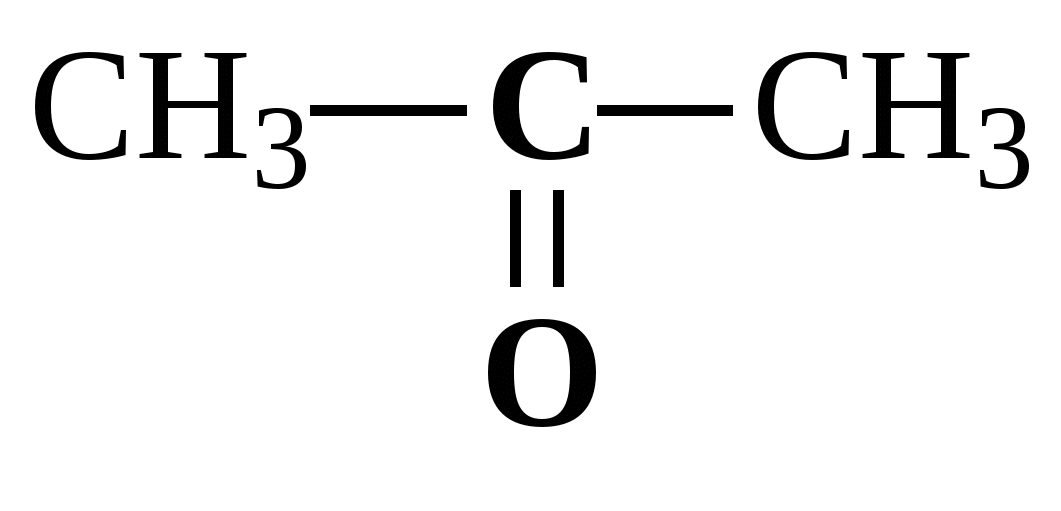
д) СH3-CH2-CO(OH) и CH3-CO(O-CH3)
3) Пространственная изомерия (цис-, транс-изомерия)
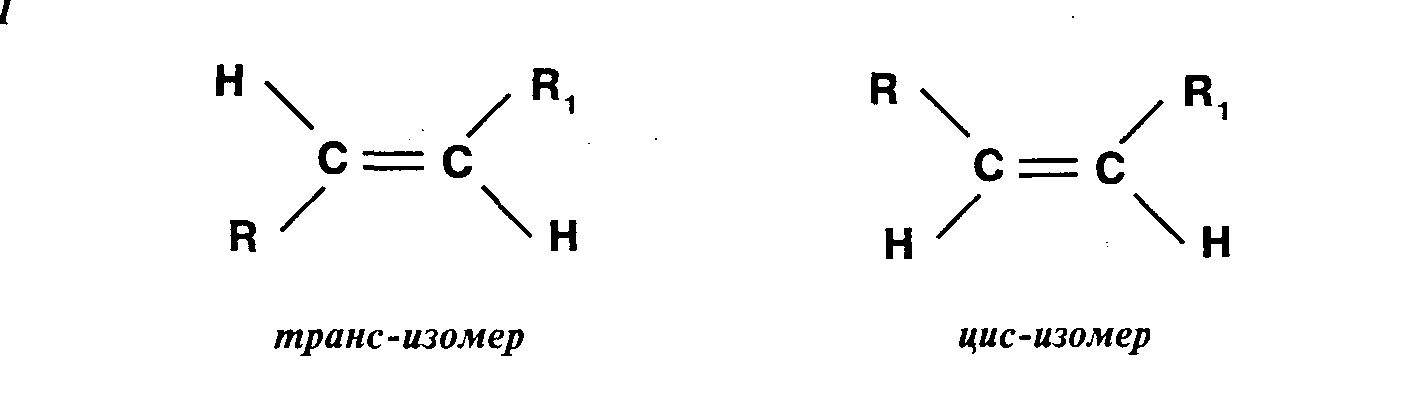
III. Типы химических реакций в органической химии
Реакции органических веществ можно формально разделить на четыре основных типа: замещения, присоединения, отщепления (элиминирования) и перегруппировки (изомеризации).
Как правило, основное органическое соединение, участвующее в реакции, называют субстратом, а другой компонент реакции условно рассматривают как реагент.
1) Реакции замещения.
Реакции, в результате которых осуществляется замена одного атома или группы атомов в исходной молекуле (субстрате) на другие атомы или группы атомов, называются реакциями замещения. В реакции замещения вступают предельные и ароматические соединения, такие, как, например, алканы, циклоалканы или арены.
СН4
+ Сl2
→ СН3Сl
+ НСl
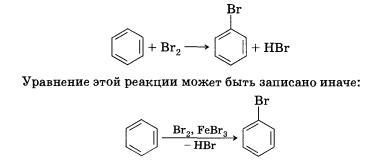
2) Реакции присоединения.
Реакции, в результате которых две или более молекул реагирующих веществ соединяются в одну, называют реакциями присоединения. В реакции присоединения вступают ненасыщенные соединения, такие, как, например, алкены или алкины.
СН3—СН=СН2 + Н2 → СН3—СН2—СН3
СН2=СН2 + НСl → СН3—СН2—Сl СН2=СН2 + Сl2 → СН2Сl—СН2Сl
![]()
3) Реакции отщепления (элиминирования).
Реакции, в результате которых из молекулы исходного соединения образуются молекулы нескольких новых веществ, называют реакциями отщепления или элиминирования.
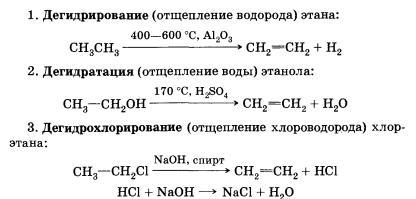
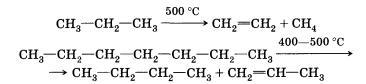
4) Реакции изомеризации.
Реакции, в результате которых из молекул одного вещества образуются молекулы, других веществ того же качественного и количественного состава, т. е. с той же молекулярной формулой, называют реакциями изомеризации.
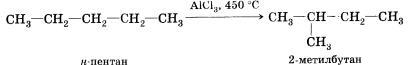
В общем, рассматривая основные принципы реагирования органических соединений, можно выделить следующие конкретные типы химических реакций:
1) Реакции замещения: галогенирование, нитрование.
2) Реакции присоединения: гидрирование, галогенирование, гидратация, гидрогалогенирование.
3) Реакции отщепления: дегидрирование, дегалогенирование, дегидратация, дегидрогалогенирование.
4) Реакции изомеризации.
Также выделяют:
5) Реакции разложения: крекинг, гидролиз, брожение.
6) Реакции полимеризации.
7) Реакции поликонденсации.
8) Реакции окисления: полное окисление (горение), неполное окисление (на катализаторе).