- •Ферменты как биокатализаторы. Механизмы действия ферментов.
- •Изоферменты
- •Мультиферментные комплексы
- •Строение мультиферментного комплекса
- •2 Теории, объясняющие суть действия ферментов.
- •Стереоспецифичность аспартазы к транс-изомеру субстрата
- •Механизмы катализа
- •Типы ферментативных реакций
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •3. Зависимость от концентрации фермента
- •4. Зависимость скорости реакции от концентрации субстрата
- •Vmах и Km - кинетические характеристики эффективности фермента.
- •Классификация и номенклатура ферментов
- •Оксидоредуктазы
- •Систематическое название образуется:
- •Трансферазы
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
Изоферменты
Это разновидности одного и того же фермента, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка. Различные изоферменты определяют скорость и направление реакции благодаря разному сродству к субстрату.
Например, димерный фермент креатинкиназа (КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 – по одной М и В субъединице, активна в миокарде, креатинкиназа-3 содержит две М-субъединицы, специфична для скелетной мышцы. Креатинкиназа (цитозольный и митохондриальный фермент) обратимо катализирует в клетках многих тканей реакцию переноса фосфатного остатка между АТФ и креатином:
Креатин + АТФ --------- Креатинфосфат + АДФ.
|
Изоферменты креатинкиназы |
|
Изоферменты лактатдегидрогеназы |
Также существует пять изоферментов лактатдегидрогеназы – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2).
Пируват + НАДН --------------------Лактат + НАД+ + Н+
Мультиферментные комплексы
В мультиферментном комплексе несколько разных ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных разных реакций, но обеспечивающих единый процесс. В этом случае, продукт первой реакции непосредственно передается на следующий фермент и является исходным веществом, т.е. субстратом для второй реакции и так далее до завершения процесса окончательно. Благодаря таким комплексам значительно ускоряется скорость превращения молекул.

Строение мультиферментного комплекса
пируватдегидрогеназный комплекс (пируватдегидрогеназа), превращающий пируват в ацетил-SКоА,
α-кетоглутаратдегидрогеназный комплекс (в цикле трикарбоновых кислот) превращающий α-кетоглутарат в сукцинил-SКоА,
комплекс под названием "синтаза жирных кислот" (или пальмитатсинтаза), синтезирующий пальмитиновую кислоту.
Конец формы
2 Теории, объясняющие суть действия ферментов.
Адсорбционная: считалось, что фермент, как магнит притягивает (адсорбирует) на себя молекулы субстрата, их концентрация у активного центра повышается и реакция идет быстрее. Это устаревшая теория, и имеет только исторический интерес.
Теория промежуточных фермент-субстратных комплексов объясняет механизм действия ферментов тем, что фермент: связывается с субстратом и образует комплекс фермент-субстрат, этот комплекс превращается в другой, третий, где происходит напряжение, деформация субстрата, формируются и отделяются от фермента уже конечные продукты реакции. Вместо одной реакции с высоким энергетическим барьером, идут несколько новых с низким.
А + В (субстраты) Е (фермент)--------------- С (продукт)
А + Е -------- АЕ1 (комплекс 1)------ АЕ2(комплекс 2)
АЕ2 + В ------ С (продукт) + Е (исходный неизмененный фермент)
2.E + S -------- ES -------- EZ ------- EP ------- E + P
S – субстрат, P - продукт, Z - переходное состояние
Т.е. при фермент-субстратном взаимодействии происходят:
1. сближение и необходимая ориентация субстратов,
2.удаление гидратной оболочки субстрата (внутри активного центра создаются другие условия, чем в растворе),
3.ослабляется разрываемая связь между атомами субстрата (при связывании происходит индуцированное субстратом конформационное изменение фермента и его активного центра, образуется фермент-субстратный комплекс; индуцированное соответствие обеспечивает эффективный ферментативный процесс, но не вносит решающий вклад в увеличение скорости реакции; каталитическая активность ферментов связана с их непосредственным участием в самих процессах разрыва и образования новых связей),
4.стабилизация переходного состояния, образующегося в результате взаимодействия между субстратом и аминокислотными остатками активного центра фермента или кофактором, достижение которого требует значительно меньшей энергии активации.
В общем виде все сводится к комплементарному взаимодействию фермента и субстрата. При этом функциональные группы субстрата взаимодействуют с соответствующими им функциональными группами фермента. Наличие субстратной специфичности объясняют две теории: Фишера и Кошланда.
1. Теория Фишера (модель "жесткой матрицы", "ключ-замок") – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую.

2. Теория Кошланда (модель "индуцированного соответствия", "рука-перчатка") – подразумевает гибкость активного центра (т.е. сначала активный центр не соответствует – не комплементарен субстрату). Присоединение субстрата к якорному участку фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата (индуцированное, наведенное соответствие).

В тот момент, когда субстрат(S) полностью заполняет собой активный центр, максимально возрастает степень разрыхления его химических связей, и он преобразуется в промежуточное вещество, которое в последствие получает дополнительные порции (кванты) тепловой энергии и образует продукт реакции (Р). Продукт реакции связан с активным центром менее прочно и покидает активный центр.
Активный центр фермента лучше согласован со структурой субстрата в переходном состоянии, чем со структурой субстрата в свободной форме, и следующая запись ферментативного процесса показывает, что субстрат в активном центре приобретает возбужденное состояние последовательно, в несколько этапов:
E + S ------ ES ------ ES* ------ ES** ------ ES*** ------ EP ---- E + P
Специфичность
Специфичность - высокая избирательность действия ферментов:
- реакционная/каталитическая специфичность (по отношению к катализируемой реакции) - фермент катализирует определенный тип каталитических превращений одного или нескольких субстратов по одному из возможных путей,
- субстратная специфичность (по отношению к соответствующим субстратам) - способность каждого фермента взаимодействовать только с одним или несколькими определенными субстратами; выделяют абсолютную,
групповую (относительную),
стереоспецифичность,
редко двойственную специфичность.
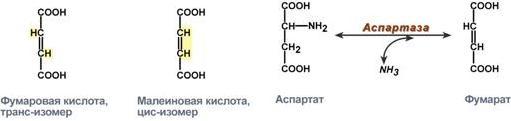
Стереоспецифичность – катализ только одного из стереоизомеров, например:
специфичность к L- или D-аминокислотам – например, почти все ферменты человека взаимодействуют с L-аминокислотами,
ферменты метаболизма углеводов имеют специфичность к D-, а не к L-моносахаридам,
специфичность к цис- и транс-изомерам. Например, аспартаза реагирует только с транс-изомером – фумаровой кислотой, но не с малеатом (цис-изомер).