
- •Ферменты как биокатализаторы. Механизмы действия ферментов.
- •Изоферменты
- •Мультиферментные комплексы
- •Строение мультиферментного комплекса
- •2 Теории, объясняющие суть действия ферментов.
- •Стереоспецифичность аспартазы к транс-изомеру субстрата
- •Механизмы катализа
- •Типы ферментативных реакций
- •1. Зависимость скорости реакции от температуры
- •2. Зависимость скорости реакции от рН
- •3. Зависимость от концентрации фермента
- •4. Зависимость скорости реакции от концентрации субстрата
- •Vmах и Km - кинетические характеристики эффективности фермента.
- •Классификация и номенклатура ферментов
- •Оксидоредуктазы
- •Систематическое название образуется:
- •Трансферазы
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
- •Систематическое название образуется:
Ферменты как биокатализаторы. Механизмы действия ферментов.
Биологическое значение ферментов.
Структура ферментов, кофакторы, понятие об активном центре фермента.
Изоферменты.
Свойства ферментов: обратимость действия, специфичность.
Основу жизнедеятельности любого организма составляют химические процессы. Практически все реакции в живом организме протекают с участием природных биокатализаторов, называемых ферментами, или энзимами. Среди множества энергетически возможных реакций ферменты избирательно преобразуют реагенты, называемые субстратами, по физиологически полезному пути. Наука о ферментах называется энзимология. Слово "фермент" происходит от лат. fermentium - закваска, а "энзим" - от греч. еп - в, внутри и zуте - дрожжи. Данная терминология возникла исторически при изучении ферментативных процессов спиртового брожения. Становление энзимологии как науки произошло в начале XIX века и продолжается до настоящего времени. В 1922 г. было установлено, что ферменты являются белками. Их роль уникальна: они увеличивают скорость протекания химической реакции, однако при этом не расходуются. В 1926 г. был впервые очищен и выделен в виде белковых кристаллов фермент уреаза, катализирующий реакции расщепления мочевины до аммиака и диоксида углерода. К настоящему времени в кристаллическом виде получены около 2000 ферментов. В задачи этой науки входят определение роли отдельных ферментов в ускорении химических реакций, протекающих в организме, выделение и очистка ферментов, установление их структуры, исследование механизма действия, изучение кинетических характеристик и особенностей регуляции активности in vivo.
Для практической медицины – 1)инструмент направленного изменения метаболизма клетки путём воздействия определёнными химическими веществами на активность ферментов (существуют фармацевтические препараты - ингибиторы ферментов); 2)использование методов определения активности ферментов в биологических жидкостях для диагностики заболеваний; 3)выделенные и очищенные ферменты могут использоваться в качестве терапевтических средств.
В роли биокатализаторов могут выступать и небелковые соединения. Например, некоторые типы РНК вызывают гидролиз фосфодиэфирных связей нуклеиновых кислот. Такие молекулы РНК с каталитической активностью называют рибозимами.
Основные свойства ферментов как биологических катализаторов
Известно, что для осуществления химической реакции необходимо, чтобы реагирующие вещества имели суммарную энергию выше, чем величина, называемая энергетическим барьером реакции. Для характеристики величины энергетического барьера введено понятие энергии активации. Преодоление энергии активации в химической реакции достигается либо увеличением энергии взаимодействующих молекул, например нагреванием, облучением, повышением давления, либо снижением требуемых для реакции затрат энергии (т.е. энергии активации) при помощи катализаторов.
Суть работы ферментов в том, что они снижают энергетический барьер реакции, т.е. вовлекают в реакцию даже те молекулы, которые без ферментов не могут вступить в реакцию, а при снижении энергетического барьера реакция становится возможной. Вместо одной реакции с высоким энергетическим барьером, начинает протекать несколько новых реакций с низким барьером (по обходному пути).
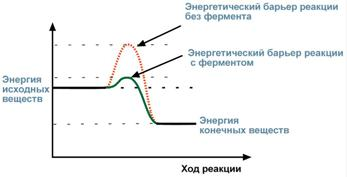
Величина энергии активации с ферментом и без него
Фермент, выполняя функцию катализатора химической реакции, подчиняется общим законам катализа и обладает всеми свойствами, характерными для небиологических катализаторов, однако имеет и отличительные свойства, связанные с особенностями строения ферментов.
Сходство ферментов с небиологическими катализаторами:
ферменты катализируют энергетически возможные реакции;
энергия химической системы остаётся постоянной;
в ходе катализа направление реакции не изменяется;
ферменты не расходуются в процессе реакции.
Отличия ферментов от небиологических катализаторов:
- скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами;
- ферменты обладают высокой специфичностью;
- ферментативная реакция проходит в клетке, т.е. при температуре 37°С, постоянном атмосферном давлении и физиологическом значении рН;
- скорость ферментативной реакции может регулироваться;
- кооперативность действия, т.е. образуют ансамбли, катализирующие целые процессы (например, цикл Кребса);
- ферменты - белковые молекулы, следовательно, они обладают всеми свойствами, характерными для белков.
Простые белки – ферменты (например: пепсин, трипсин, лизоцим) имеют в активном центре только определенные группы аминокислот, которые и формируют этот самый активный центр.
В активном центре фермента обычно следующие группы:
-СООН, -NH2, -OH, -SH, -CH3, -фенил - группы.
Сложные белки-ферменты называются холоферментами.
Структурно-функциональная организация ферментов.
Холофермент:
1.Апофермент 2. Кофактор
(белковая часть) (небелковая часть)
1).Кофермент 2).Ион металла
(органический (неорганический
кофактор). кофактор):
А).Витаминные коферменты: Б).Невитаминные железо,
коферменты: медь,
НАД+ и НАДФ+, ТГФК динуклеотиды цинк,
ФМН и ФАД, пиридоксаль- (АДФ,ГДФ,УДФ,ЦДФ) кобальт,
ТДФ, фосфат, ГЕМ и его производные марганец,
липоевая к-та, дезоксиаденозил- убихинон, никель,
коэнзим А кобаламин, коэнзим Q, хром,
биоцитин аскорбиновая к-та, глутатион ванадий,
ретинолпирофосфат, молибден,
филлохинон селен,
кальций.
Кофактор может образовывать с апоферментом прочные ковалентные связи, в этом случае кофермент называют простетической группой: сукцинатдегидрогеназа (содержит ФАД) (в цикле трикарбоновых кислот), аминотрансферазы (содержат пиридоксальфосфат), пероксидаза (содержит гем).
Основные коферменты – «рабочие части» ферментов: НАД+ (образуется из витамина РР), ФАД (ФМН) ( - из В2 – рибофлавин), ТДФ – тиаминдифосфат ( - из В1 – тиамин), пиридоксальфосфат ( - из В6 – пиридоксаль), коэнзим А ( - из В5 – пантотеновая кислота), биоцитин ( - из витамина Н – биотин), липоевая кислота (биохимические функции - см. лекцию по «витаминам»), а так же АДФ - входит в фосфотрансферазы, УДФ - гликозилтрансферазы, ЦДФ - входит в ферменты, транспортирующие компоненты синтеза липидов (холина, этаноламина), глутатион - кофермент глутамилтрансферазы, катализирует транспорт аминокислот через мембраны,реабсорбируя аминокислоты из первичной мочи, биологическая роль фермента также связана с регуляцией уровня глутатиона в тканях (ГГТ содержится в основном в мембране клеток, обладающих высокой секреторной или адсорбционной способностью: эпителии желчных путей, печеночных канальцев и т.д.)
Без кофермента функционируют гидролитические ферменты – это исключение – протеазы, липазы, рибонуклеаза.
Как многие белки, ферменты могут быть мономерами, т.е. состоят из одной субъединицы, и полимерами, состоящими из нескольких субъединиц.
Для осуществления катализа необходим полноценный комплекс апофермента (апобелка) и кофактора, по отдельности катализ они осуществить не могут.
Апофермент:
- формирует активный центр,
- отвечает за специфичность действия фермента,
- фиксирует и ориентирует субстрат в активном центре,
- создает условия для преобразования субстрата в продукт.
1. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи.
У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора.
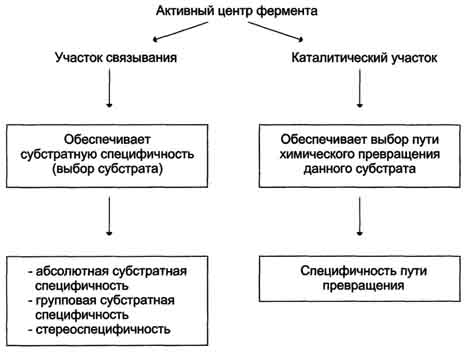
В свою очередь в активном центре выделяют два участка:
якорный (участок связывания, контактный) – отвечает за связывание и ориентацию субстрата в активном центре,
каталитический – непосредственно отвечает за осуществление реакции.
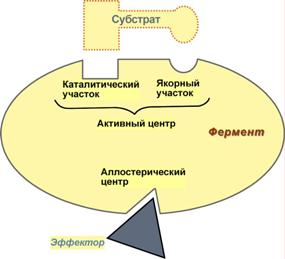
Аллостерический центр (allos – другой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Именно через аллостерический центр осуществляется «руководство» ферментом. Связывание с аллостерическим центром регулятора (активатора или ингибитора, а также эффектора или модулятора) вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции. В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество. Иногда на молекуле фермента могут быть несколько аллостерических центров, обладающих специфичностью связывания разных эффекторов: одни – активаторов, другие – ингибиторов. Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.
Проявлением эволюции белковых молекул является регуляция активности ряда ферментов.
Эволюционно древние ферменты регулируют свою активность на уровне транскрипции (обусловлено экспрессией участка генома, кодирующего структуру фермента). Например, орнитиндекарбоксилаза катализирует декарбоксилирование орнитина с образованием путресцина.
Эволюционно молодые ферменты обладают аллостерической регуляцией, что позволяет точно регулировать ферментативную активность с целью контроля за скоростью превращения субстрата в продукт в зависимости от клеточных потребностей. Например, фосфофруктокиназа катализирует превращение фруктозо-6-фосфата во фруктозо-1,6-дифосфат и кроме активного центра обладает еще 3 центрами с АТФ, НАДН и цитратом.
