
- •Неорганическая химия способы выражения состава растворов
- •Задачи для самостоятельного решения
- •1 Следствие
- •2 Следствие
- •Задачи для самостоятельного решения
- •Растворы сильных электролитов
- •Задачи для самостоятельного решения
- •Растворы слабых электролитов
- •Задачи для самостоятельного решения
- •Буферные растворы
- •Кривые титрования
- •Произведение растворимости
- •Задачи для самостоятельного решения
- •Окислительно-восстановительные реакции
- •Окислители и восстановители
- •Окислители.
- •Окислительно-восстановительные свойства сложныхвеществ
- •Влияние среды реакции.
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Водород в реакциях с азотной кислотой практически не выделяется! Реакции серной кислоты
- •Реакции самоокисления-самовосстановления
- •Химическая связь.
- •Ковалентная связь
- •Метод валентных связей
- •Валентность
- •Гибридизация атомных орбиталей и геометрия молекул
- •Метод молекулярных орбиталей
- •Ионная связь
- •Кислоты н2со3 и h2so3 менее стабильны, чем их соли. Причины:
- •Энергия связи
- •При переходе от одинарной связи двойной и тройной (между одними и теми же атомами) энергия связи возрастает, однако связь укрепляется непропорцианально увеличению её кратности.
- •Б)что длина связи уменьшается с возрастанием порядка или кратности связи, а прочность увеличивается с уменьшением длины связи.
- •Окислительно-восстановительные процессы.
- •Комплексные соединения
- •Задачи для самостоятельного решения
- •17. Напишите уравнения окислительно- восстановительных реакций между комплексами:
Окислительно-восстановительные процессы.
Протекание окислительно-восстановительных реакций связано со сдвигом или полным переходом электронов от одних веществ к другим – от восстановителя к окислителю.
Типичными окислителями являются
1. Определите степень окисления хрома в следующих соединениях:
Сг2О3 ,К2Сг2О7 ,Сг2(SO4)3,Fe(CrO2)2 .
2. Укажите, какие из приведенных процессов представляют собой окисление и какие-восстановление: S——> SO42- ,Br2 ——> 2Br -, V2+——> V03- ,CL-——> CLO3- .
3. Какие из следующих реакций относятся к окислительно-восстановительным: NH4CL= NH3 + HCL; 2K2CrO4+ H2SO4 = К2Сг2O7+ К2S04+ Н2О;
Fe + S = FeS ; H2 + CL2 = 2 HCL.?
4. В каких из следующих реакций азот является окислителем, в каких – восстановителем: N2+O2= …; N2 + Li =… ; N2+Mg = … ?
5. Составьте уравнения полуреакций:
MпО4 -——> Mnz+ (рН<7); Cr02- ——> СгО4 2- (рН>7); SO3 z-——> SO4 2- (рН=7).
6. Закончите уравнения .реакций:
HCLO3 ——>CLO2 + HCLO4 + Н20 ; NH4NO3 —>N2О + H20:
KI+ K2Cr207+ H2.SO4 ——>.I2 + . . . ; AL + HNO3 ——>NH4NO3 + ...
.7. Напишите следующие окислительно-восстановительные реакции:
Na2S + К2 Сг2 О7 + Н2S04 ——>… ; Н202 + KI ——>… ;
РН3.+ KMnO4 + HCL —> …. ; NaCLO + CrCL3 + NaOH ——>. . .
8. По приведенным ниже полуреакциям составьте уравнения окислительно-восстановительных реакций в молекулярном виде:
a)lOFe2+ ——> lOFe3+ + 10e
2МпО4- + 16Н+ + 10е ——> 2Mn2+ + 8Н2О
b)3Mg° —-> ЗMg2+ +6e
SO4 2- + 8Н+ + 6е —> S0 + 4Н2О
9. В 1 л раствора содержится 10г HCL04 .Вычислите нормальную концентрацию
HCLO4 , исходя из реакции:
SO2 + HCLO4 + Н20 ——> HCL + Н2SO4
10. Какой обьём 0.1Н К2Сг207 потребуется для окисления 20мл 0,2М Na2S в кислой среде?
Комплексные соединения
Комплексными или координационными соединениями принято называть соединения, в узлах кристаллической решётки которых находятся комплексы, способные к самостоятельному существованию в растворе.
Комплексное соединение состоит из внутренней сферы и внешней сферы.Во внутреннюю сферу входятцентральный атом (комплексообразователь)в некоторой степени окисления илиганды –противоположно заряженные ионы или нейтральные молекулы. Общее число σ–связей, образуемых центральным атомом –комплексообразователем характеризуеткоординационное число (КЧ) данного центрального атома. Например, в комплексном соединенииK2[PtCl6] ионы К+ -внешняя сфера ион [PtCl6]2- -внутренняя сфера с центральным атомомPtIVи лигандамиCl-. В комплексном соединении
[Fe(H2O)6]Cl3 ионы Cl- - внешняя сфера, ион [Fe(H2O)6]3+ - внутренняя сфера с центральным атомом FeIII и лигандами Н2О. В комплексе [Co(NH3)3Cl3] внешней сферы нет совсем, а во внутренней сфере центральный атом CoIII координирует лиганды NH3 и Cl- В соединении.
[Ni(NH3)6][Fe(CN)6] содержатся комплексный катион [Ni(NH3)6]2+ и комплексный анион
[Fe(CN)6]2-.
При вычислении заряда комплексного иона заряд комплексообразователя принимается равным его степени окисления; тогда этот заряд равен алгебраической сумме зарядов комплексообразователя и лигандов.
Например, заряды следующих комплексных ионов, образованных хромом(III):
а)[Cr(H2O)5Cl]; б) [Cr(H2O)4Cl2]; в) [Cr(H2O)2(C2O4)2].
Равны: а) (3+) + (1-) = 2+; б) (3+) + 2(1-)= 1+; в) (3+) + 2(2-) = 1-.
Строение комплексных соединений
По числу σ–связей, образуемых лигандом с комплексообразователем различают монодентатные, бидентатные, тридентатные,….полидендатные лиганды. Например,
в комплексном катионе [Cu(NH3)4]2+ каждый лиганд NH3 монодентатный, а в комплексном катионе [Cu(NH2CH2CH2NH2)2]2+ каждый лиганд NH2CH2CH2NH2 бидентатный.
Координационные соединения, в которых центральный атом (или ион) связан одновременно с двумя или более донорными атомами лиганда, в результате чего замыкается один или несколько гетероциклов, называются хелатами. Лиганды, образующие хелатные циклы, называются хелатирующими (хелатообразующими) реагентами. Замыкание хелатного цикла такими лигандами называется хелатированием (хелатообразованием). Наиболее обширный и важный класс хелатов – хелатные комплексы металлов.
Последний комплекс представляет собой хелат.

Для объяснения строения простых и комплексных частиц с центральными атомами d–элементов, имеющими незавершённый внутренний (n-1)d–подуровень, используют метод ВС, дополненныйтеорией кристаллического поля.В свободном атомеd–элемента подуровень (n-1)dпятикратно вырожден, т.е. все пять (n-1)d-АО имеют одинаковую энергию. Под воздействием электростатического поля лигандов энергия пяти (n-1)d-АО комплексообразователя дифференцируется и пятикратное вырождение снимается.
При октаэдрическом расположении лигандов вокруг центрального атома наибольшее отталкивание испытывают электроны, находящиеся на орбиталях dz2 и dx2-y2 , направленных к лигандам, поэтому их энергия будет более высокой, чем у электронов, находящихся на орбиталях dxy,dxz,dyz, расположенных между лигандами. В октаэдрическом поле лигандов происходит расщепление d –уровня на два энергетических уровня: более высокий eg(соответствует орбиталям dz2,dx2-y2 ) и более низкий уровень t2g( соответствует орбиталям dxy,dxz,dyz).Таким образом, вырождение пяти d –орбиталей иона снимается частично, что приводит к образованию двукратно вырожденного уровня egи трёхкратно вырожденного уровня t2g.
Разница в энергиях уровней egи t2gназывается энергией расщепления.
Величина расщепления зависит от природы лиганда, что определяется положением лиганда в спектрохимическом ряду, определяемым экспериментально:
I < Br < SCN- < Cl <NO3- < F < OH < ONO- < C2O42 < H2O < NCS < CH3CN < NH3 < глицин < пиридин < этилендиамин< дипиридил < о-фенантролин < NC- < NO2 < CN < CO.
Принято считать, что левее аммиака в спектрохимическом ряду располагаются лиганды “слабого поля”, а правее – лиганды “сильного поля”, дающие при прочих равных условиях большую величину расщепления.
Окраска комплексных соединений
Поглощение света комплексными соединениями d- элементов теория кристаллического поля объясняет переходом электронов с t2g-подуровня на eg-подуровень в октаэдрических комплексах и с eg-подуровня на t2g-подуровень в тетраэдрических комплексах. При этом поглощается квант света, энергия которого равна энергии расщепления: h=, где h- постоянная Планка,- частота
колебаний. Энергия расщепления, таким образом, оказывается математически связана с частотой колебания света в максимуме поглощения и, следовательно, с длиной волны максимума поглощения: =/h и=с/, где с- скорость света.
Окраска комплекса зависит от его состава и строения, и определяется длиной волны max , отвечающей максимуму полосы поглощения и интенсивностью полосы. В спектрах поглощения комплексных соединений d- элементов имеются полосы поглощения низкой интенсивности, которые проявляются в видимой области, а иногда несколько сдвинуты в фиолетовую область. Их появление связано с электронными переходами в незаполненных d- орбиталях.
Положение полосы поглощения определяется величиной расщепления в кристаллическом поле. Изъятие из потока света, падающего на поглощающее свет вещество, части энергии, отвечающей поглощённой длине волны, приводит к тому, что возникает окрашивание, соответствующее действию на глаз человека непоглощённых длин волн. Например, из солнечного спектра раствором [Ti(H2O)6]3+ поглощаются зелёные волны, поэтому мы воспринимаем растворы комплексов Ti3+ как имеющие красно-фиолетовое окрашивание. Невозможностью d- электронных переходов объясняется отсутствие или её низкая интенсивность у следующих комплексных соединений: [Au(CN)4], [Co(CN)6]3, [Zn(NH3)4]2+.
Магнитные свойства комплексных соединений
Молекулы с целиком заполненными электронными оболочками не обладают магнитными свойствами, так как не имеют вырожденных состояний, способных расщепляться под действием магнитного поля. Но, поскольку магнитное поле индуцирует в заполненных оболочках небольшой магнитный момент, противоположный внешнему полю, такие молекулы выталкиваются из магнитного поля. Такие молекулы называются диамагнитными.Молекулы, имеющие неспаренные электроны, втягиваются в магнитное поле и называютсяпарамагнитными.
Наиболее существенной с химической точки зрения величиной является молярная магнитная восприимчивость м. Магнитную восприимчивость измеряют экспериментально. Используя найденное значение, в соответствии с теорией магнитной и электрической поляризации можно вычислить величину магнитного момента:
![]()
Значение магнитного момента(теор) для числа «n» неспаренных электронов, равного 1,2,3,4,5 равно соответственно:1,73; 2,83; 3,87; 4,90; 5,92 магнетонов Бора(B). Например, высокоспиновый комплекс Mn(II) - [Mn(H2O)6]2+ должен иметь 5 неспаренных электронов (d5 - конфигурация), т.к. магнитный момент равен 5,92 магнетонов Бора
Устойчивость комплексных соединений
Все реакции образования комплексов в водном растворе обратимые. Состояние равновесия образования комплекса при T=constпо закону действующих масс количественно характеризуется общей константой устойчивости(β). Константа устойчивости определяет меру общей устойчивости комплекса по отношению к устойчивости аквакомплекса.Для реакций образования аквакомплексов в водном растворе общие константы устойчивости приняты равными нулю.
Константы Кn и (или Ку) являются термодинамическими характеристиками устойчивости комплекса в растворе. Величина, обратная константе образования, называется константой нестойкости комплекса Kн = 1/.
Величина константы образования является мерой устойчивости комплекса. Так, комплекс [Co(NH3)6]3+ более устойчив, чем [Cu(NH3)4]2+, поскольку константы устойчивости у них соответственно равны:1,991035 и 1,071022.
Поскольку образование комплексного иона происходит в результате обмена воды гидратированного иона на соответствующие лиганды, более точно процесс комплексообразования называется обменом лигандов.
. Константа равновесия, соответствующая суммарной реакции
[Cu(H2O)4]2+ + 4NH3= [Cu(NH3)4]2+ +4H2O ,
является суммарной константой образования или константой устойчивости данного комплекса
β4(или Ку): Ку(β)=1/Кн; рКу=рКн,где Кн-константа нестойкости (диссоциации).
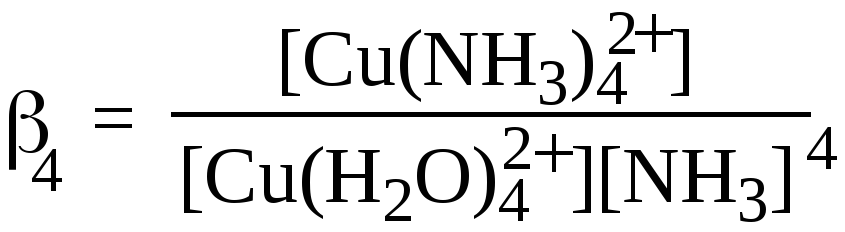
Кислотно-основные свойства комплексных соединений
При координации молекул воды ионами металла диссоциация воды усиливается, при этом протоны выталкиваются из внутренней сферы аквакомплексов и образуются гидроксокомплексы, а раствор приобретает кислые свойства. Например, в растворах солей алюминия протекают реакции:
[Al(H2O)6]3++H2O= [Al(H2O)5OH]2+ +H3O+ .
По таким схемам происходит гидролиз солей металлов, дающих слабые основания.
Аммиак в водном растворе обладает основными свойствами:
NH3 .H2O + H2O = NH4+ + OH + H2O .
В случае координации аммиака ионами металла в небольшой степени происходит диссоциация его молекулы по кислотному типу:
[Pt(NH3)6]4+ +H2O = [Pt(NH3)5NH2]3+ +H3O+ .
Интенсивность кислотных и основных свойств комплексных соединений зависит от размера, заряда и поляризационных свойств центрального иона, от величины заряда комплексного иона, от устойчивости комплекса в растворе, от строения комплекса и характера взаимного влияния координированных групп.
Чем выше заряд центрального иона, тем сильнее выражены кислотные свойства комплекса, а основные слабее. Так, ион [Cr(H2O)6]3+ способен проявлять более сильные кислотные свойства, чем ион [Zn(H2O)6]2+. Ион [Co(NH3)6]3+, содержащий Co3+ , почти нейтрален, а ион [Pt(NH3)5Cl]3+, содержащий Pt4+, имеет сильные кислотные свойства. Чем выше заряд комплексного катиона, тем сильнее отталкивается протон и сильнее кислотные свойства. Ион [Cr(Н2О)6]3+ проявляет более сильные кислотные свойства, чем ион [Cr(H2O)4Cl2]+ , а ион [Co(NH3)5(H2O)]3+ - более сильные кислотные свойства, чем ион [Co(NH3)4(NO2)(H2O)]2+.
Основные свойства комплексного катиона при увеличении его заряда, наоборот, ослабевают.[Pt(NH3)5OH]3+ проявляет более слабые основные свойства, чем ион [Co(NH3)5OH]2+.
Пример 1. Составьте координационную формулу комплексной соли составаCo(NO3)3Cl4NH3, если в растворе этой соли не обнаружены ионы кобальта, нитрата и аммиака. Весь хлор, содержащийся в составе этой соли, образует хлорид серебра при взаимодействии с раствором нитрата серебра. Измерения электрической проводимости показывают, что молекула соли диссоциирует на два иона.
Решение
Так как ионы кобальта и NO3- , а также аммиак не обнаружены в растворе они образуют внутреннюю сферу комплексного соединения. Два иона на которые диссоциирует комплексная соль представляют собой комплексный ион [Co(NH3)4(NO3)2]+ и ионCl-. Координационная формула соли:
[Co(NH3)4(NO3)2]Cl. Координационное число кобальта равно 6. Степень окисления кобальта (x) равна:x+ 0 +(-1)2 = +1x= +3
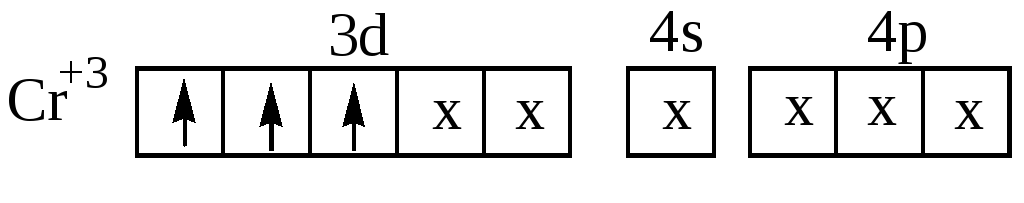
Пример 2 Определите
тип гибридизации центрального атома в
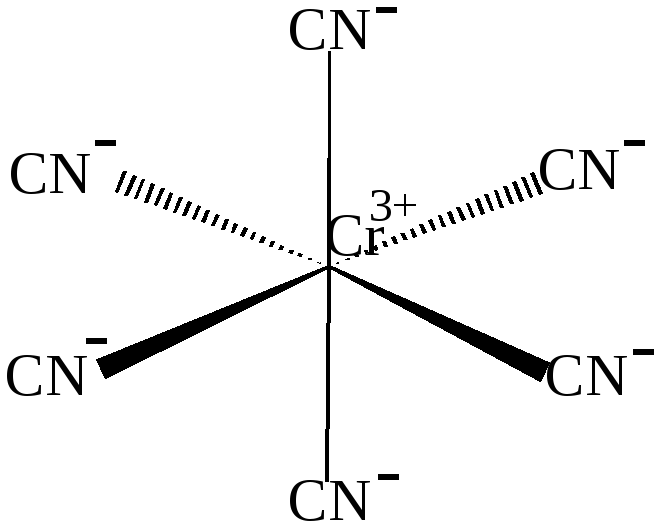
комплексном ионе [Cr(CN)6]3-
Решение
Cr3+ имеет две свободные 3d –, одну 4s –и три 4р – орбитали, которые они предоставляют для электронных пар лигандов, при этом осуществляется d2sp3- гибридизация.
Пример 3 Составьте энергетическую диаграмму образования связей в октаэдрическом комплексе [FeF6]3-,укажите тип гибридизации орбиталей центрального атома.
Решение
Fe+III =[18Ar]3d54s04p04d0 (акцептор). F- - донор. 6 σ–связей.
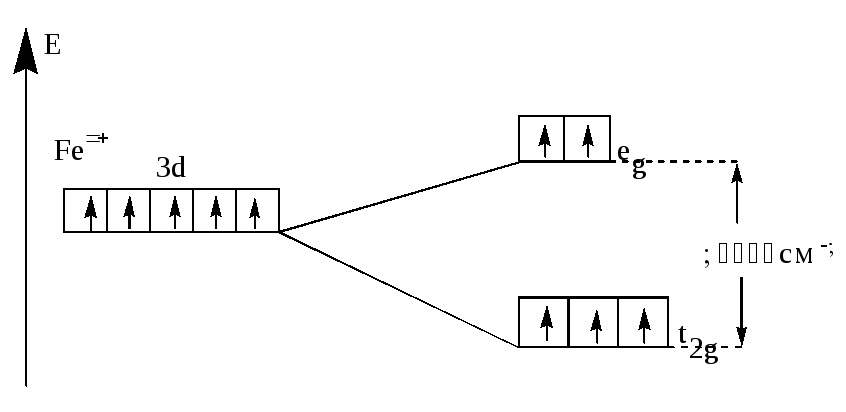
Комплекс высокоспиновый, парамагнитный, лиганд слабого поля - гибридизация sp3d2 . Комплекс бесцветный.
Пример 4 Составьте энергетическую диаграмму образования связей в октаэдрическом комплексе
[Fe(CN)6]3- . Укажите тип гибридизации орбиталей центрального атома.
Решение Fe+III =[18Ar]3d54s04p04d0 (акцептор). CN- - донор. 6 σ–связей.
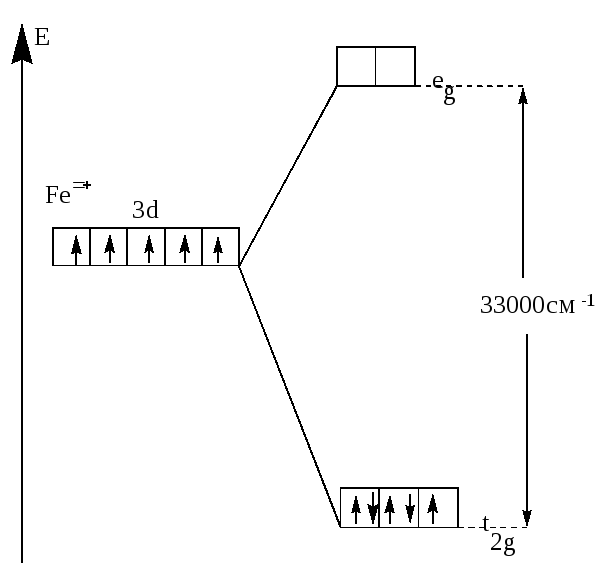
Комплекс низкоспиновый, лиганд сильного поля – гибридизация d2sp3.Комплекс окрашенный.
Пример 5. Определите окраску комплексного иона [Cr(H2O)6]3+ , если энергия расщепления
энергетических уровней равна 209,5 кДж/моль.
Решение:
При переходе электронов с t2g – подуровня на eg - подуровень в октаэдрических комплексах поглощается квант света, энергия которого равна энергии расщепления: Δ = hν,
где h- постоянная Планка, h = 6,6 ∙10-34 Дж∙ с, а ν - частота колебаний света в максимуме поглощения. ν = с/ λ, где λ – длина волны максимума поглощения, а с- скорость света
( с = 3,0 109м/с). Энергия электронного перехода Е = Δ/Na.
Тогда: λ = h∙c∙ Na/ Δ = 6,63 ∙10-34 Дж∙ с∙ 3,0∙ 108 м/с∙ 6,02∙1023 моль-1 ∙109 нм/м / 209500 Дж =571 нм.
Согласно таблице 2 книги «Комплексные соединения» этой длине волны соответствует цвет поглощаемого излучения желто-зеленый, а наблюдаемый (дополнительный) цвет-фиолетовый.
Пример 6. Определите число неспаренных электронов в низкоспиновом комплексе [Fe(CN)6]3+ по следующим экспериментальным данным: молярная магнитная восприимчивость χм = 0,0012.
Решение:
П
 о
величине молярной магнитной восприимчивости
вычисляем величину магнитного момента:
о
величине молярной магнитной восприимчивости
вычисляем величину магнитного момента:
___ _________
μ = 2,84 √ χмТ = 2,84 √ 0,0012·298 = 1,7. магнетонов Бора. Такая величина соответствует одному неспаренному электрону.
Пример 7. Рассчитайте, выпадет ли при 250С осадок сульфида серебра (I) , если смешать равные объемы 0,001 М раствора K[Ag(CN)2], содержащего KCN с концентрацией 0,124 моль/л и раствор Na2S с концентрацией 0,004 моль/л. Общая константа устойчивости комплекса равна β2 =1,6 · 107.
ПР(Ag2S) = 7,2 · 10-50.
Решение: Ag + + 2CN- = [Ag(CN)2]-
β2 = [Ag(CN)2]- / [Ag+] ∙ [CN-] , Отсюда: [Ag+] = [Ag(CN)2]- / β2 ∙ [CN-]2
Поскольку смешали равные объемы двух растворов, концентрации компонентов уменьшаются в 2 раза. Итак: [Ag+] = 5 ∙10-4 / 1,6 ∙107∙ 0,062 = 5,04 ∙ 10-10
[S2-] = 0,002 моль/л. Произведение [Ag+]2 [S2-] равно:(5,04 ∙10-10) 2 ∙ 0,002 = 5,08 ∙10-23 .
Так как 5,08 ∙10-23 > ПР(Ag2S) = 7,2 ∙10-50 осадок выпадет.
