
- •Неорганическая химия способы выражения состава растворов
- •Задачи для самостоятельного решения
- •1 Следствие
- •2 Следствие
- •Задачи для самостоятельного решения
- •Растворы сильных электролитов
- •Задачи для самостоятельного решения
- •Растворы слабых электролитов
- •Задачи для самостоятельного решения
- •Буферные растворы
- •Кривые титрования
- •Произведение растворимости
- •Задачи для самостоятельного решения
- •Окислительно-восстановительные реакции
- •Окислители и восстановители
- •Окислители.
- •Окислительно-восстановительные свойства сложныхвеществ
- •Влияние среды реакции.
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Водород в реакциях с азотной кислотой практически не выделяется! Реакции серной кислоты
- •Реакции самоокисления-самовосстановления
- •Химическая связь.
- •Ковалентная связь
- •Метод валентных связей
- •Валентность
- •Гибридизация атомных орбиталей и геометрия молекул
- •Метод молекулярных орбиталей
- •Ионная связь
- •Кислоты н2со3 и h2so3 менее стабильны, чем их соли. Причины:
- •Энергия связи
- •При переходе от одинарной связи двойной и тройной (между одними и теми же атомами) энергия связи возрастает, однако связь укрепляется непропорцианально увеличению её кратности.
- •Б)что длина связи уменьшается с возрастанием порядка или кратности связи, а прочность увеличивается с уменьшением длины связи.
- •Окислительно-восстановительные процессы.
- •Комплексные соединения
- •Задачи для самостоятельного решения
- •17. Напишите уравнения окислительно- восстановительных реакций между комплексами:
Реакции самоокисления-самовосстановления
Различают 2 основных типа окислительно-восстановительных реакций:
- межмолекулярные, в которых атомы окислителя и восстановителя находятся в со-
ставе разных частиц;
- внутримолекулярные, в которых атомы окислителя и восстановителя находятся в
одной частице.
Существует большая группа окислительно-восстановительных процессов, в которых окислителями и восстановителями являются атомы одного и того же элемента. Такие реакции называются реакциями самоокисления-самовосстановления или реакциямидиспропорционирования.
Различают два вида таких процессов. Один из них – это дисмутация, при которой элемент из одной степени окисления переходит в две новых, меньшую и большую относительно исходной. Эти процессы чаще протекают в щелочной, реже в нейтральной среде.
Примером может служить уже описанная реакция хлора с растворами щелочей. Интересный пример - это реакция диоксида азота с щелочами:
+4 +3 +5
NO2+ 2KOH=KNO2+KNO3+H2O
Реакции дисмутации могут быть и внутримолекулярыми:
+5 t -1 +7
KClO3 = KCl + KClO4
Второй вид процессов - это конмутация. В ходе этих процессов атомы одного и того же элемента из разных степеней окисления сходятся к одной, промежуточной между исходными. Реакции конмутации протекают, как правило, в кислотной, реже в нейтральной среде.
+5 -1 0
KClO3 + 6HCl = KCl +3Cl2 + 3H2O
ок-ль в-ль
Интересна реакции диоксида серы с сероводородом, используемая в промышленности:
+4 -2 0
SO2 + 2H2S = 3S +2 H2O
ок-ль в-ль
Конечная степень окисления не обязательно будет нулевой. Вот еще пример:
+7 +2 +4
2KMnO4 + 3MnSO4 +2H2O = 5MnO2 + K2SO4 + 2H2SO4
Окислительно-восстановительные реакции с участием органических веществ.
Для нахождения коэффициентов в ОВР с участием органических веществ различных классов удобно использовать метод электронно-ионного баланса. В данных реакциях органические вещества почти всегда являются восстановителями. Естественно, необходимо знать, какими будут продукты окисления органических веществ.
Рассмотрим реакцию Вагнера - окисление алкенов перманганатом калия в холодных нейтральных растворах. В качестве восстановителя возьмем пропен C3H6. Запишем схему реакции:
C3H6+KMnO4+H2O=C3H6(OH)2+MnO2+KOH
Составим уравнения полуреакций:
 MnO4-
+ 2 Н2О + 3е-→MnO2+ 4ОН-
2
MnO4-
+ 2 Н2О + 3е-→MnO2+ 4ОН-
2
C3H6+ 2 Н2О - 2e-→C3H6(OH)2 + 2H+ 3
2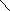 MnO4-
+ 10 Н2О + 3C3H6
→MnO2 +8
ОН- +
6 H+
+ 3C3H6(OH)2
MnO4-
+ 10 Н2О + 3C3H6
→MnO2 +8
ОН- +
6 H+
+ 3C3H6(OH)2
4 6 Н2О + 2ОН-
Сокращая воду в левой и правой частям, получаем окончательные коэффициенты:
3C3H6 +2 KMnO4 + 4H2O = 3C3H6(OH)2 + 2MnO2 + 2KOH
