
- •Неорганическая химия способы выражения состава растворов
- •Задачи для самостоятельного решения
- •1 Следствие
- •2 Следствие
- •Задачи для самостоятельного решения
- •Растворы сильных электролитов
- •Задачи для самостоятельного решения
- •Растворы слабых электролитов
- •Задачи для самостоятельного решения
- •Буферные растворы
- •Кривые титрования
- •Произведение растворимости
- •Задачи для самостоятельного решения
- •Окислительно-восстановительные реакции
- •Окислители и восстановители
- •Окислители.
- •Окислительно-восстановительные свойства сложныхвеществ
- •Влияние среды реакции.
- •Влияние среды на состав продуктов реакции
- •Влияние концентрации на состав продуктов реакции
- •Водород в реакциях с азотной кислотой практически не выделяется! Реакции серной кислоты
- •Реакции самоокисления-самовосстановления
- •Химическая связь.
- •Ковалентная связь
- •Метод валентных связей
- •Валентность
- •Гибридизация атомных орбиталей и геометрия молекул
- •Метод молекулярных орбиталей
- •Ионная связь
- •Кислоты н2со3 и h2so3 менее стабильны, чем их соли. Причины:
- •Энергия связи
- •При переходе от одинарной связи двойной и тройной (между одними и теми же атомами) энергия связи возрастает, однако связь укрепляется непропорцианально увеличению её кратности.
- •Б)что длина связи уменьшается с возрастанием порядка или кратности связи, а прочность увеличивается с уменьшением длины связи.
- •Окислительно-восстановительные процессы.
- •Комплексные соединения
- •Задачи для самостоятельного решения
- •17. Напишите уравнения окислительно- восстановительных реакций между комплексами:
Энергия связи
Важное значение имеет энергетическая характеристика химической связи. При образовании химической связи общая энергия системы (молекулы) меньше энергии составных частей (атомов), т.е. Е(AB)<Е(А)+Е(B).
Энергия связи – это энергия, которая выделяется при образовании молекулы из атомов. Энергию связи обычно выражают в кДж/моль (или ккал/моль). Это одна из важнейших характеристик химической связи. Более устойчива та система, которая содержит меньше энергии. Известно, например, что атомы водорода стремятся объединиться в молекулу. Это означает, что система, состоящая из молекул Н2содержит меньше энергии, чем система, состоящая из такого же числа атомов Н, но не объединенных в молекулы.
Для двухатомных молекул энергия связи равна энергии диссоциации. Для многоатомных молекул с одним типом связи средняя энергия связи равна 1/n части распада молекулы на атомы. Энергия распада метана на атомы равна 1649 кДж/моль. В молекуле метана имеются четыре равноценные связи С-Н поэтому средняя энергия такой связи равна Ес-н = 1649/4 = 412 кДж/моль. оль.
Таблица 3 Длина и энергия разрыва связей
|
|
d пм |
E кДж/моль |
|
d пм |
E кДж/моль |
|
C-H |
109 |
416 |
C=O |
116 |
695 |
|
C-F |
138 |
485 |
O-H |
96 |
467 |
|
C-Cl |
176 |
327 |
O-O |
148 |
146 |
|
C-Br |
194 |
285 |
S-H |
135 |
347 |
|
C-I |
214 |
213 |
N-H |
101 |
391 |
|
C-C |
154 |
356 |
As-H |
152 |
247 |
|
C=C |
134 |
528 |
|
|
|
|
C≡C |
|
813 |
|
|
|
При переходе от одинарной связи двойной и тройной (между одними и теми же атомами) энергия связи возрастает, однако связь укрепляется непропорцианально увеличению её кратности.
Таблица 3 показывает:
а)закономерное изменение энергии для однотипных связей(C-F>C-Cl>C-Br>C-I),
Б)что длина связи уменьшается с возрастанием порядка или кратности связи, а прочность увеличивается с уменьшением длины связи.
Металлическая связьвозникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Химическая связь в твердых телах.Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl tпл.= 801 °C, а для NaNO3tпл= 306,5 °C.
Пример 1.Каким типом гибридизации АО бериллия описывается образование молекулы хлорида бериллия? Какова конфигурация этой молекулы?
Решение:
Возбужденный атом бериллия имеет конфигурацию 2s12p1. Поэтому можно считать, что в образовании химических связей могут участвовать не одинаковые, а различные атомные орбитали. В молекуле BeCl2должны быть неравноценные по прочности и направлению связи, причем σ-связи из p-орбиталей должны быть более прочными, чем связи из s-орбиталей, т.к. для p-орбиталей имеются более благоприятные условия для перекрывания. Однако опыт показывает, что в молекулах, содержащих центральные атомы с различными валентными орбиталями (s, p, d), все связи равноценны – это объясняет метод гибридизации. В данном случае имеет местоsp- гибридизация
При образовании молекулы одна s- и одна р-орбиталь образуют две гибридные sp-орбитали под углом 180о.
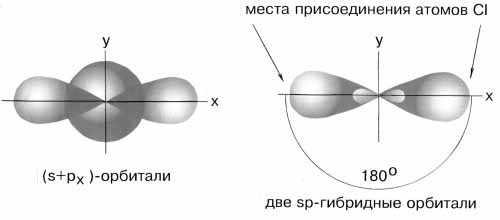
sp-гибридные орбитали
Экспериментальные данные показывают, что все галогениды Be, а также Zn, Cd и Hg (II) линейны и обе связи имеют одинаковую длину.
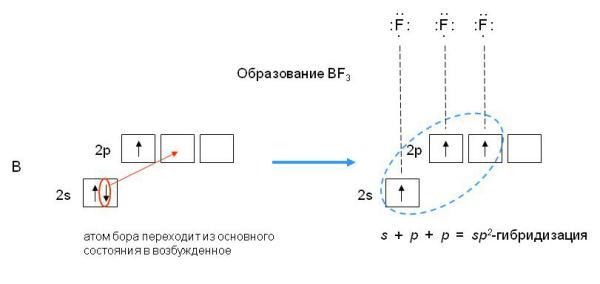
Пример 2. Определите тип гибридизации орбиталей центрального атома в молекулеBF3. Какова конфигурация этой молекулы?
Решение:
Возбуждённый атом бора имеет конфигурацию 2s12p2.
В результате гибридизации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120одруг к другу.
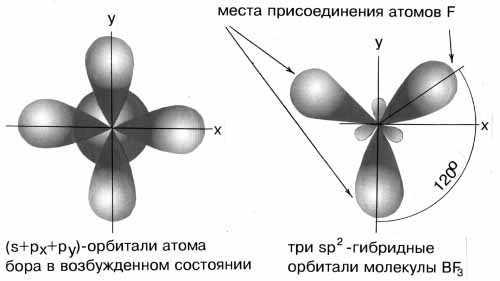
sp2-гибридизация
Пример 3. Каким типом гибридизации АО азота описывается образование молекулы аммиака?
Решение:
В результате гибридизации 2sи трёх 2pорбиталей азота образуются четыре гибридные орбиталиsp 3 . Конфигурация молекулы представляет из себя искажённый тетраэдр, в котором три гибридных орбитали участвуют в образовании химической связи, а четвёртая с парой электронов – нет. Углы между связямиN-Hне равны 90 о как в пирамиде, но и не равны 109,5 о , соответствующие тетраэдру.
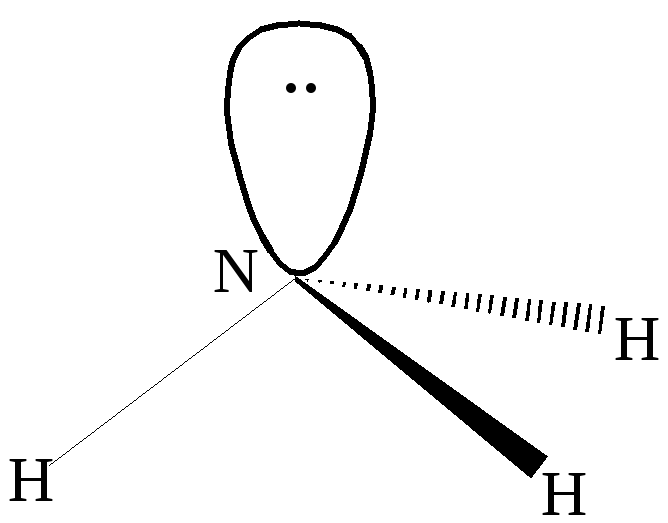
sp3- гибридизация в молекуле аммиака
При взаимодействии аммиака с ионом водорода в результате донорно-акцепторного взаимодействия образуется ион аммония, конфигурация которого представляет собой тетраэдр.
Пример 4.Объяснить с позиций метода МО возможность существования молекулярного иона Не2+
Решение:
В молекулярном ионе Не2 + имеется три электрона.На связывающей орбитали размещены два электрона,а на разрыхляющей –один. Следовательно кратность связи равна 0, и он должен быть энергетически устойчивым.
Пример 5.Определите энергию связи кислород-водород в молекуле Н2О если энергия связи Н-Н и
О-О соответственно равны -435,9 и -498,7 кДж/моль а при сгорании 2 моль кислорода выделяется 483,68 кДж теплоты.
Решение:
Процесс образования молекулы воды можно представить следующим образом: рвутся связи водород-водород и кислород-кислород а образовавшиеся атомы соединяются в молекулы Н2О каждая из которых содержит две связи кислород-водород:
4Н(г) = 2Н2(г) – 435,9∙2
2О(г) = О2(г) – 498,7
2Н2(г) + О2(г) = 2Н2О(г) - 483,68
----------------------------------------------------
4Н(г) + 2О(г) = 2Н2О(г) - 1854,18 кДж
В двух молекулах Н2О четыре связи кислород-водород; средняя энергия связи кислород – водород равна: -1854,18 / 4 = - 463,54 кДж/моль
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.Определите тип гибридизации орбиталей центрального атома в следующих молекулах и укажите геометрическую форму этих молекул:
AlBr3, BeF2, CF4, BBr3, H2O, SF6, SiCl4, NH3, CH4, AlCl3, BCl3
Полярны ли эти молекулы?
2.Определите тип гибридизации орбиталей центрального атома в следующих частицах и укажите геометрическую форму этих частиц:
NH4+, GaCl4-, H3O+,BF4-, SiF62-, AlF63-, SO42-, PO43-.
3.Составьте энергетическую диаграмму МО для следующих частиц и определите порядок связи в них:
H2,H2+,H2-,He2, HeH, He2+, Li2, Be2, B2, N2, N2+, O2, O2-, O2+, CO, CO+, NO, NO+, NO-.
4. Пользуясь таблицей относительных электроотрицательностей, определите,какая из связей является наиболее полярной:Са-Н, I-C1.C-S.
5. В каком из приведенных соединений:LiF, BeF ,BF ,CF связь Э-F будет больше всего
приближаться к ковалентной?
6. Как изменяется прочность связи в ряду:НF-НСl-НВг-Н1?
7. При переходе от NaF к Nal температура плавления кристаллов уменьшается. Объясните наблюдаемый ход изменения температур плавления.
8. BaCl2 в водных растворах -сильный электролит,a HgCl2-слабый электролит. Объясните это различие в свойствах солей.
9. Сероводород при обычной температуре - газ, а вода- жидкость. Чем можно объяснить это различие в свойствах?
