labsfiz / адиабата
.docЦель работы: изучение изопроцессов в газах; определение показателя адиабаты методом Клемана-Дезорма.
Основные понятия
Газ - агрегатное состояние
вещества, в котором составляющие его
атомы и молекулы беспорядочно движутся.
Энергия этого движения называется
внутренней энергией. Величина внутренней
энергии тела складывается из
кинетической энергии хаотического
движения молекул и потенциальной
энергии их взаимного расположения:
![]() .
К реальному газу при не слишком низких
температурах и достаточно малых давлениях
применима модель идеального газа.
Согласно этой модели молекулы можно
рассматривать как невзаимодействующие
материальные точки (ЕВЗ =
0), при столкновениях такие молекулы
ведут себя как абсолютно упругие шарики.
.
К реальному газу при не слишком низких
температурах и достаточно малых давлениях
применима модель идеального газа.
Согласно этой модели молекулы можно
рассматривать как невзаимодействующие
материальные точки (ЕВЗ =
0), при столкновениях такие молекулы
ведут себя как абсолютно упругие шарики.
Внутренняя энергия газа определяется его абсолютной температурой Т и числом степеней свободы молекул газа i . Числом степеней свободы i движения механической системы называется число независимых координат, определяющих её положение в пространстве. Применяя это понятие к идеальному одноатомному газу, получим, что его частицы имеют три степени свободы поступательного движения (i = 3). Многоатомные молекулы (сложные частицы) кроме поступательных обладают ещё вращательными и колебательными степенями свободы. Рассмотрим сложную частицу, состоящую из двух точечных частиц: между ними возможны два типа связи. Первый тип - точечные частицы жестко связаны между собой и ведут себя наподобие жесткой гантели. В этом случае сложная частица имеет пять степеней свободы - три поступательные и две вращательные. Второй тип - связь между частицами не жесткая, и они могут совершать колебательные движения вдоль соединяющей их линии. В этом случае добавляются ещё две степени свободы на кинетическую и потенциальную энергию колебаний.
В соответствии с законом равномерною
распределения энергии по степеням
свободы (закон Больцмана) на каждую из
них приходится энергия, равная
![]() .
Здесь
.
Здесь
![]() -
постоянная Больцмана.
-
постоянная Больцмана.
Один моль любого газа содержит число
молекул, равное числу Авогадро, и обладает
полной энергией![]() ,
где R = kNА
- газовая постоянная, R
= 8,3 1 Дж/(моль*К). NA
= 6,02*10-23
моль-1. Внутренняя энергия идеального
газа массой m:
,
где R = kNА
- газовая постоянная, R
= 8,3 1 Дж/(моль*К). NA
= 6,02*10-23
моль-1. Внутренняя энергия идеального
газа массой m:
![]() (1)
(1)
где
![]() -
число молей, μ
- молярная масса.
-
число молей, μ
- молярная масса.
В термодинамике состояние газа характеризуется объемом V , давлением Р и температурой Т . Параметры Р, V, Т связаны друг с другом функциональной зависимостью, называемой уравнением состояния. Для
идеального газа
![]() -
уравнение Менделеева - Клапейрона. Для
одного моля идеального газа PV=RT.
Равновесным называется состояние
газа, при котором значения параметров
Р, V и Т постоянно во
времени, причем давление и температура
имеют постоянные значения со всех частях
объема. Равновесное состояние изображают
точкой на P-V,
T-V или Р-Т
диаграммах, которые представляют собой
графическо*е изображение соотношений
между параметрами Р, V и
Т.
-
уравнение Менделеева - Клапейрона. Для
одного моля идеального газа PV=RT.
Равновесным называется состояние
газа, при котором значения параметров
Р, V и Т постоянно во
времени, причем давление и температура
имеют постоянные значения со всех частях
объема. Равновесное состояние изображают
точкой на P-V,
T-V или Р-Т
диаграммах, которые представляют собой
графическо*е изображение соотношений
между параметрами Р, V и
Т.
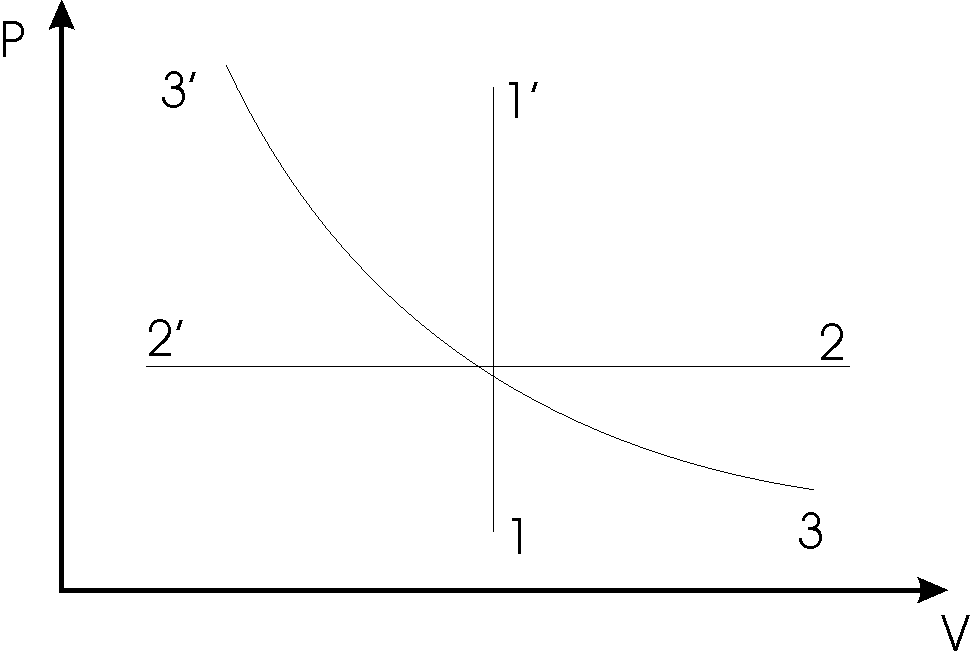
Процесс описывается изменением во времени параметров системы. Процесс, состоящий из бесконечно близких равновесных состояний, называется равновесным и может быть изображен на диаграмме в виде непрерывных кривых. Процесс, при котором один из параметров остается неизменным, называется изопроцессом.
В идеальном газе можно осуществить три изопроцесса:
|
1) при постоянном объеме
V = const -
изохорический
2) при постоянном давлении
Р = const -
изобарический
3) при постоянной
температуре Т = const
- изотермический
На рис. 1 представлены эти зависимости в координатах Р, V. Существует две формы передачи энергии от одних тел к другим: в форме работы А и в форме теплоты Q. Энергия механического движения может превращаться в энергию теплового |
рис. 1
|
движения и наоборот. При этих превращениях должен выполняться закон сохранения и превращения энергии. Применительно к термодинамическим процессам таким законом является первое начало термодинамики: теплота, сообщаемая системе, расходуется на увеличение её внутренней энергии и на совершение ею работы против внешних сил. При малом изменении состояния системы:
![]() (2)
(2)
Отличия и записи δQ,
dU и δА выражают
характерные физические различия этих
величин. Если внутренняя энергия является
однозначной функцией состояния
термодинамической системы, то понятия
теплоты и работы имеют смысл только в
связи с процессом изменения состояния
системы. При совершении произвольного
процесса, в результате которого она
возвращается в исходное состояние,
полное изменение внутренней энергии
равно нулю
![]() ,
в то время как
,
в то время как
![]() могут быть и не равны нулю (например,
в цикле Карно).
могут быть и не равны нулю (например,
в цикле Карно).
При сообщении системе теплоты
δQ её температура изменяется на dT.
Величина, равная отношению δQ
к dT, называется теплоемкостью
тела. Теплоемкость измеряется количеством
теплоты, которое надо сообщить телу
для повышения его температуры на один
Кельвин. Теплоемкость, отнесенная к
единице массы тела, называется удельной:
![]() .
Теплоемкость моля вещества называется
молярной:
.
Теплоемкость моля вещества называется
молярной:
![]() (3)
(3)
Теплоемкость в общем случае не характеризует свойства тела, поскольку она является характеристикой как тела, так и условий нагревания, поэтому она не имеет определенного значения. Она приобретает определенные значения, если фиксировать условия нагревания, тогда она является характеристикой тела. Наиболее важными являются теплоемкости для случаев, когда теплота передается газу при постоянном давлении (СP) и постоянном объеме (СV).
В изохорическом процессе объем не изменяется, газ не совершает работу против внешних сил, поэтому сообщаемое газу извне количество тепла δQ расходуется на изменение внутренней энергии: δQ = dU. Теплоемкость одного моля газа на основании (2):
![]() (4)
(4)
В
изобарическом процессе тепло δQ
расходуется на увеличение внутренней
энергии и на совершение газом работы
прочив внешних сил δА:
![]() ,
причем
,
причем
![]() .
Поэтому
.
Поэтому
![]() ,
откуда
,
откуда
![]() (5)
(5)
Соотношение
![]() называется уравнением Майера.
называется уравнением Майера.
При рассмотрении термодинамических процессов важно знать характерное для каждого газа отношение СP к СV, называемое показателем адиабаты γ. В соответствии с (1), (4), (5):
![]() (6)
(6)
Общее уравнение адиабатического процесса получают из первого начала термодинамики, полагая δQ = 0 (теплоизолированность). Соотношение (2) в случае адиабатного процесса:
![]() (7)
(7)
или
CvdT + PdV = 0 (8)
Разделив (8) на СVТ, получим
![]() (9)
(9)
Проинтегрируем, затем пропотенцируем выражение (9) и получим:
![]() (10)
(10)
Это уравнение адиабаты в переменных Т, V. Воспольззовавшись уравнением Менделеева-Клайперона для
1 моля газа PV= RT , получим уравнение адиабаты в переменных Р, V:
![]() (11)
(11)
Результаты эксперимента
|
№ |
|
|
|
|
1 2 3 4 5 6 7 |
h1= 25.5-8= 17.5 h1= 25.3-8.2= 17.1 h1= 26.1-7.2= 18.9 h1= 24-9.3= 14.7 h1= 25.1-8.3= 16.8 h1= 24.9-8.5= 16.4 h1= 28-5.3= 22.7 |
h2= 18.5-14.5= 4 h2= 18.4-14.8= 3.6 h2= 18.7-14.5= 4.2 h2= 18.1-15.1= 3 h2= 18.6-14.4= 4.2 h2= 18.2-15= 3.2 h2= 19-14.1= 4.9 |
|
|
|
|
|
|
|
1
2
3
4
|
5
6
7
|
||
Обработка результатов эксперимента
Найдем среднее значение
![]() :
:
![]()
![]()
Найдем кол-во молей газа в баллоне:
![]()
Найдем внутреннюю энергию газа в баллоне:
![]()
По данным исходного состояния и значению вычислим:
![]()
![]()
![]()
![]()
Погрешности
Погрешность вычисления показателя
адиабаты :

где h1
и h2
определяются по формулам:
![]()
![]()
Погрешность в значении γ определяем по формуле:
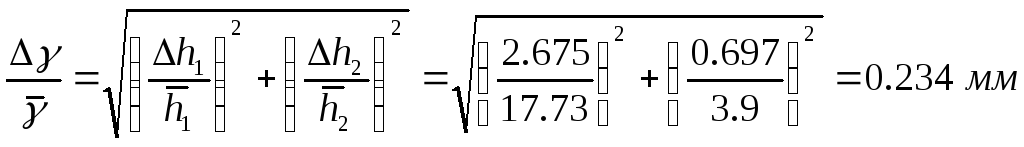
Вывод
В результате проведения лабораторной работы изучили изопрцессы в газах.
Определили значение γ = 1,28
количество молей газа в баллоне ν = 0,4 моль
внутреннюю энергию газа U0 = 2500 Дж
по данным исходного состояния P1 = 277300 Па
V1 = 0,005 м3
T1 = 418,17 К
Е = 3475 Дж.