labsfiz / Энтропия
.docЦель работы: изучение основных законов термодинамики, исследование фазовых переходов первого рода.
Основные понятия
Энтропией называется функция S состояния системы, дифференциал которой в обратимом элементарном процессе равен отношению бесконечно малого количества теплоты, сообщенного системе, к её абсолютной температуре:
![]() (1)
(1)
Энтропия сложной системы равна сумме энтропии всех её однородных частей.
Изменение энтропии в любом обратимом процессе, переводящем систему из состояния 1 в состояние 2, равно приведенному количеству теплоты, переданному системе в этом процессе:
![]() (2)
(2)
Энтропия тела может быть определена только с точностью до постоянного слагаемого (константы интегрирования):
![]()
где интегрирование; производится вдоль произвольного обратимого процесса; S0 - значение энтропии тела при T=0K.
В соответствии со вторым законом термодинамики для произвольного элементарного процесса:
![]() (3)
(3)
Для теплоизолированной системы δQ=0, поэтому dS≥0: энтропия изолированной системы не может убывать.
Все реальные процессы необратимы, поэтому в действительности энтропия изолированной системы может только возрастать, достигая максимума в состоянии термодинамического состояния системы.
Если система совершает круговой процесс, то изменение ее энтропии равно нулю и алгебраическая сумма приведенных количеств теплоты, сообщенных этой системе, равна нулю в обратимом процессе:
![]()
и больше нуля в необратимом процессе:
![]() (4)
(4)
Соотношение (4) называется неравенством Клаузиуса и является математической записью второго закона термодинамики для необратимых процессов в неизолированной системе.
Основное соотношение термодинамики, объединяющее в себе первый и второй законы термодинамики, получается из (3) при замене δQ на dU + δA : TdS ≥ dU + δА
Второе начало термодинамики (утверждение о невозможности убывания энтропии изолированной системы) получает статистическое истолкование при использовании формулы Больцмана: S == klnW + const , где S - энтропия системы, k = 1,38 • 10-23 Дж/К - постоянная Больцмана,
W - термодинамическая вероятность состояния. Термодинамической вероятностью состояния называется число микросостояний системы, соответствующих данному макросостоянию. Величина W для химически однородной системы показывает, сколькими способами может быть реализовано данное макросостояние. По определению, W ≥ 1.
Рассмотрим сначала термодинамические процессы и энтропию для идеального газа. Простейшие термодинамические процессы - политропные; при политропном процессе теплоемкость газа С постоянна.
1. Изохорический процесс V = const, δА = 0, А = 0
![]() (5)
(5)
2. Изотермический процесс Т = const, PV = const, δА = δQ
![]() (6)
(6)
3. Изобарический процесс Р = const, δА == PdV A=PΔV
![]() (7)
(7)
4. Адиабатный процесс δQ = 0 , PVγ = const
![]() (8)
(8)
Протекание любого термодинамического процесса обычно изображают в координатах P-V или T-S. При этом на диаграмме P-V площадь под кривой представляет собой элементарную работу в ходе этого процесса δА = PdV (рис. 1а), а на диаграмме T-S: δQ = TdS площадь равна элементарному количеству тепла, сообщенному или отобранному у системы (рис. 16).
Рассмотрим с точки зрения термодинамики фазовые переходы. Фазовым переходом первого рода называется переход вещества из одной фазы в другую, сопровождающийся скачкообразным изменением внутренней энергии и плотности. Фазовые переходы первого рода связаны с выделением или поглощением теплоты, называемой скрытой теплотой фазового перехода. Примерами переходов первого рода служат испарение, плавление, сублимация.
При нагревании твердого тела до определенной температуры - температуры плавления ТПЛ , осуществляется его переход из твердого состояния в жидкое; для однокомпонентного вещества этот переход происходит при постоянном давлении Рпл . Обратный процесс охлаждения приводит к кристаллизации расплава (переходу из жидкого состояния в твердое), которая протекает при определенной температуре Ткр и постоянном давлении РКР. Оба этих перехода являются одновременно изобарными (Р = const) и изотермическими (Т = const). В идеальном случае при
Рпл = Ркр температуры плавления и кристаллизации равны: ТПЛ = Ткр.
Удельной теплотой плавления называется количество теплоты, необходимое для того, чтобы расплавить единицу массы тела. Если UЖ и UТ внутренние энергии единицы массы вещества в жидком и твердом состоянии; υЖ, υt удельные объемы жидкости и твердого тела, то по первому закону термодинамики удельная теплота плавления:
![]() (9)
(9)
где Р - давление, при котором совершается фазовый переход твердого тела в жидкость.
Для того, чтобы расплавить вещество массой m , к нему необходимо подвести количество теплоты Q=mrПЛ. В процессе кристаллизации теплота выделяется.
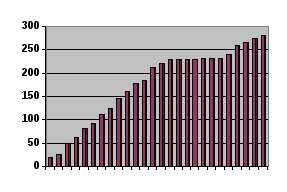
Изобразим процессы плавления и кристаллизации с помощью диаграммы. Если по оси абсцисс откладывать количество теплоты, сообщаемое телу, а по оси ординат - температуру тела, процесс нагрева изобразится прямой, образующей некоторый угол с осью абсцисс, а процесс плавления - прямой, параллельной оси абсцисс. Если нагревание происходит равномерно - тепловая мощность, передаваемая от нагревателя, постоянна, - вид зависимости T(t) будет таким же, как Т(Qполуч) Зависимость T(t) изображена на рис. 2. Участок 1 -2 соответствует нагреву тела от То до Тпл.
δQ = cmdT - элементарная
теплота, получаемая телом,
![]()
Из условия, что тепловая машина постоянна, получаем:
![]()
tф.п. - время фазового перехода.
Отсюда можно найти удельную теплоту плавления:
![]() (10)
(10)
Приращение энтропии тела на участке нагрева твердого тела выразится:
 (11)
(11)
Приращение энтропии в процессе плавления: (участок диаграммы 2-3):
![]() (12)
(12)
Полное приращение энтропии до окончания процесса плавления:
![]() (13)
(13)
Результаты эксперимента
Плавление
t |
15 |
30 |
45 |
60 |
75 |
90 |
105 |
120 |
135 |
150 |
165 |
180 |
195 |
210 |
225 |
240 |
255 |
270 |
285 |
300 |
315 |
330 |
345 |
360 |
375 |
390 |
t0 |
20 |
26 |
50 |
62 |
82 |
93 |
112 |
125 |
145 |
160 |
177 |
185 |
212 |
220 |
230 |
230 |
230 |
230 |
231 |
231 |
231 |
240 |
260 |
265 |
275 |
280 |
Кристаллизация
t |
15 |
30 |
45 |
60 |
75 |
90 |
105 |
120 |
135 |
150 |
165 |
180 |
195 |
210 |
225 |
240 |
255 |
270 |
285 |
300 |
315 |
330 |
345 |
360 |
375 |
390 |
t0 |
300 |
285 |
270 |
250 |
235 |
233 |
233 |
233 |
232 |
232 |
231 |
231 |
220 |
215 |
190 |
180 |
165 |
155 |
130 |
115 |
100 |
85 |
70 |
55 |
30 |
20 |
Обработка результатов эксперимента


Погрешности
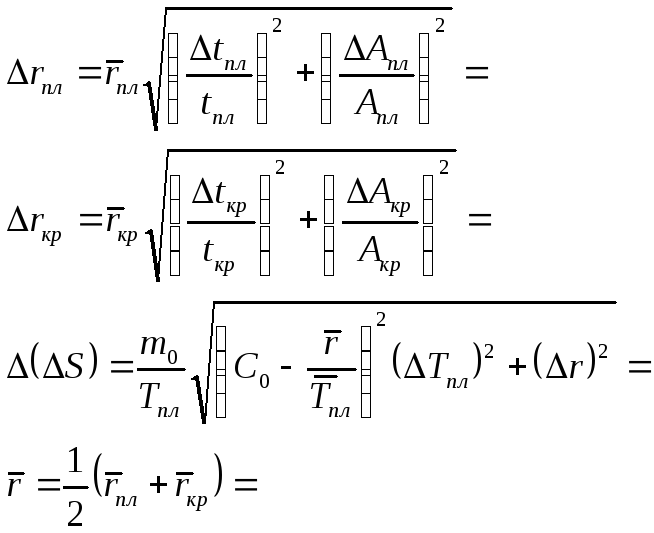


Вывод
В результате проведения лабораторной работы изучили изопрцессы в газах.
Определили значение γ = 1,28
количество молей газа в баллоне ν = 0,4 моль
внутреннюю энергию газа U0 = 2500 Дж
по данным исходного состояния P1 = 277300 Па
V1 = 0,005 м3
T1 = 418,17 К
Е = 3475 Дж.