
- •1.Формулировка задания
- •3.1. Исследование 1
- •3.1.1. Расчет изменения изобарной теплоемкости ∆Сp и теплового эффекта реакции ∆н⁰т
- •3.1.2. Расчет изменения энтропии реакции
- •3.1.3. Расчет изменения стандартной энергии Гиббса
- •3.1.4. Вывод уравнения зависимости константы равновесия от температуры
- •3.2. Исследование 2
- •3.2.1. Определение числа фаз, независимых компонентов и степеней свободы
- •3.2.2. Определение возможного направления реакции
- •3.2.3. Определение равновесного состава газовой смеси
- •3.2.5 Установление направления смещения равновесия
3.2.3. Определение равновесного состава газовой смеси
Для реакций, в которых участвуют только газы или газы и конденсированные фазы, представляющие собой чистые вещества, константу равновесия выражают обычно через равновесные парциальные давления газовых реагентов Рi и обозначают символом Кp. Равновесный состав газовой смеси рассчитывается из выражения константы равновесия рассчитываемой реакции
Кр = Р⁶НСl /Р³Н₂ , (25)
Где РНСl и РН₂ - равновесные парциальные давления хлористого водорода и водорода, выраженные в относительных единицах.
Так как константа равновесия очень велика, Кр = , то очевидно, что реакция при данных фактических концентрациях реагентов потечет вправо. При этом концентрация продуктов реакции будет увеличиваться, а исходных веществ – уменьшаться. Если число молей вещества HCl увеличится на 6х, то число реагента H₂ уменьшиться на 3х. Таким образом, при равновесии количество молей реагентов будут определяться величинами: nН₂ = 0,5 – 3х; nHCl = 0,5 + 6х. При этом их мольные доли составляют:
NН₂
=
 =
=
 ;
;
NHCl
=
 ;
;
При этом величины их равновесных парциальных давлений составят:
РН₂
=
Робщ
 ;
РHCl
=
Робщ
;
РHCl
=
Робщ
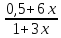 .
.
Подставив эти значения в уравнение (28), получим
Кр
=
 =
= =
= =
=
Левая часть уравнения представляет собой отношение двух конечных чисел, а правая – очень большое число. Такая ситуация возможна только в случае, если знаменатель стремится к нулю, т.е. либо (0,5-3х)³ →0 или (1+3х)³ →0. Приравнивая последние уравнения к нулю и решая их, получим два корня: х₁ = 0,166666666, х₂ = -0,333.
NН₂
=
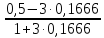 =
0;
NHCl
=
=
0;
NHCl
=
 = 0,999=1.
= 0,999=1.
Таким образом, равновесная газовая фаза будет состоять только из одного реагента НСl, причем их содержание в ней будет
Об.%НСl =100%.
3.2.5 Установление направления смещения равновесия
Исследуемая реакция идет с поглощением теплоты (∆Н⁰т > 0), следовательно, при повышении температуры равновесие должно смещаться слева направо, так как образование исходных веществ из конечных продуктов является экзотермическим процессом.
Увеличение давления смещает равновесие в сторону веществ, занимающих меньший обьем. Увеличение давления смещает равновесие справа налево, в сторону образования водорода.
Магнитогорск
2012
