
- •1.Формулировка задания
- •3.1. Исследование 1
- •3.1.1. Расчет изменения изобарной теплоемкости ∆Сp и теплового эффекта реакции ∆н⁰т
- •3.1.2. Расчет изменения энтропии реакции
- •3.1.3. Расчет изменения стандартной энергии Гиббса
- •3.1.4. Вывод уравнения зависимости константы равновесия от температуры
- •3.2. Исследование 2
- •3.2.1. Определение числа фаз, независимых компонентов и степеней свободы
- •3.2.2. Определение возможного направления реакции
- •3.2.3. Определение равновесного состава газовой смеси
- •3.2.5 Установление направления смещения равновесия
3.1.2. Расчет изменения энтропии реакции
Изменение энтропии системы в результате протекания процесса определяется по уравнению
∆S⁰т
= ∆S⁰₂₉₈
+
 .
(10)
.
(10)
В этом уравнении ∆S⁰₂₉₈ - стандартное изменение энтропии для реакции при 298 К, определяемое по мольным стандартным энтропиям веществ S⁰₂₉₈,i
∆S⁰₂₉₈ = Σ(ni S⁰₂₉₈,i )кон - Σ(ni S⁰₂₉₈,i )исх. (11)
Значения S⁰₂₉₈,i для соответствующих веществ приведены в табл. 1, после их подстановки в уравнение (11) получим
∆S⁰₂₉₈ = (6S₂₉₈ + 2S₂₉₈ )-(2S₂₉₈ + 3S₂₉₈ ) = 445,62 Дж/К.
∆S⁰т
=
∆S⁰₂₉₈
+
 -
-
 dT
-
dT
-
 =
=
445,62
+ 16,92 – 218,18·10⁻³(T-298)
+
– 218,18·10⁻³(T-298)
+
 (
( -
- ).(12)
).(12)
Рассчитаем по этому уравнению изменения энтропии для температур 300, 320, 340, 360, 380, 400, 420 и 440 К, а результат сведем в табл. 5.
Таблица 5
Величина ∆S⁰т при различных температурах для реакции
2AlCl₃ + 3H₂ = 2Al + 6HCl
|
Т, К |
298 |
300 |
320 |
340 |
360 |
380 |
400 |
420 |
420 |
|
∆S⁰т, Дж/К |
445,62 |
445,28 |
441,91 |
438,49 |
435,02 |
431,517 |
427,97 |
424,38 |
420,77 |
По данным табл. 5 построим зависимость ∆S⁰т = f(T) (рис. 3).

Рис. 3. Зависимость изменения энтропии от температуры
3.1.3. Расчет изменения стандартной энергии Гиббса
При расчете изменения стандартной энергии Гиббса для реакции воспользуемся уравнением Гиббса-Гельмгольца
∆G⁰T = ∆H⁰т - T∆S⁰т. (13)
Найденные по уравнению (13) величины изменения стандартной энергии Гиббса приведены в табл. 6, по данным которой построена зависимость ∆G⁰т = f(T), изображенная на рис. 4.
Таблица 6
Значения изменения стандартной энергии Гиббса ∆G⁰т при различных температурах
|
Т, К |
298 |
300 |
320 |
340 |
360 |
380 |
400 |
420 |
440 |
|
∆G⁰т, кДж |
683,245 |
682,357 |
673,481 |
664,677 |
655,961 |
647,276 |
638,681 |
630,158 |
621,707 |
По данным табл. 6 построим зависимость ∆G⁰т = f(T) (рис. 4).

Рис. 4. Зависимость изменения стандартной энергии Гиббса от температуры
3.1.4. Вывод уравнения зависимости константы равновесия от температуры
Константа равновесия связана с изменением стандартной энергии Гиббса соотношением
lnKp
=
-
 .
(14)
.
(14)
После подстановки выражения (13) в уравнение (14) получим
lnKp
=
-
 +
+
 .
(15)
.
(15)
Можно полагать, что в сравнительно небольшом интервале температур для исследуемой в данном примере реакции тепловой эффект реакции ∆Н⁰т и изменение энтропии ∆S⁰т практически постоянны величины. Отсюда уравнение (15) можно записать в виде
lnKp = (A/T)+B, (16)
где А и В – постоянные, которые соответственно равны:
А = -∆Н⁰т/R; (17)
B = ∆S⁰т/R. (18)
Уравнение (16) отвечает линейной зависимости lnKp = f(1/T).
В табл. 1, графа 8 предлагается определить эту зависимость для температурного интервала 300-440 К.
Для построения зависимости lnKp = f(1/T) определим lnKp из уравнения (14) и сведем полученные данные в табл. 7.
Таблица 7
Величины констант равновесия при различных температурах
|
Т |
298 |
300 |
320 |
340 |
360 |
380 |
400 |
420 |
440 |
|
1/Т·10³,К⁻ |
3,35 |
3,33 |
3,12 |
2,94 |
2,77 |
2,63 |
2,5 |
2,38 |
2,27 |
|
-lnKp |
275,90 |
273,70 |
253,26 |
235,25 |
219,26 |
204,97 |
192,14 |
180,55 |
170,03 |
|
Kp |
|
|
|
|
|
|
|
|
|
Для графического определения констант А и В в уравнении (16) по данным табл. 7 строим зависимость lnKp = f(1/T), приведенной на рис. 5.

Рис. 5. Зависимость lnKp от обратной температуры для реакции
2AlCl₃ + 3H₂ = 2Al + 6HCl
График на рис. 5 представляет собой прямую, тангенс угла которой к оси абсцисс численно равен коэффициенту А в уравнении (16). Для нахождения величины тангенса возьмем на прямой, как это показано на рис. 5, произвольно две точки а и b и определим численные значения их ординат и абсцисс. Можно записать
А
= tgα
=
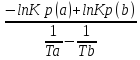 =
=
 = -97800.
= -97800.
Для определения численного значения В поступим следующим образом. Из табл. 7 возьмем значение lnKp при 1000/Т = 2,27 (lnKp = 170), подставим его вместе с численным коэффициента А, найденным ранее, в уравнение (16), которое предварительно выразим через В.
B= lnKp - А·1/Т = 170,03-(-97800·0,00227) = 51,976.
Итак, приближенное уравнение зависимости константы равновесия от температуры имеет вид
lnKp = -97800/Т + 51,976. (19)
Последнее уравнение позволяет рассчитать значение Кр при любой температуре, если последняя находится в заданном интервале (т.е. 300-440).
По значениям коэффициентов А и В рассчитаем величину среднего теплового эффекта реакции -∆Н⁰т и изменения энтропии -∆S⁰т. Согласно уравнениям (17)-(18) имеем:
∆Н⁰т= -А·R = 97800·8,31 = 812718 Дж;
∆S⁰т = B·R = 51,976·8,31 = 431,9 Дж/К.
Полученные данные неплохо согласуются с данными, приведенными в табл. 3 и 4, что указывает на правильность расчетов.
