
- •1.Формулировка задания
- •3.1. Исследование 1
- •3.1.1. Расчет изменения изобарной теплоемкости ∆Сp и теплового эффекта реакции ∆н⁰т
- •3.1.2. Расчет изменения энтропии реакции
- •3.1.3. Расчет изменения стандартной энергии Гиббса
- •3.1.4. Вывод уравнения зависимости константы равновесия от температуры
- •3.2. Исследование 2
- •3.2.1. Определение числа фаз, независимых компонентов и степеней свободы
- •3.2.2. Определение возможного направления реакции
- •3.2.3. Определение равновесного состава газовой смеси
- •3.2.5 Установление направления смещения равновесия
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
ГОУ ВПО «Магнитогорский государственный технический университет
им. Г.И.Носова»
Кафедра химической технологии неметаллических материалов
и физической химии
РАСЧЕТНО-ГРАФИЧЕСКОЕ ЗАДАНИЕ 1
По курсу «Физическая химия»
раздел «Термодинамика»
вариант 1-2
Выполнил: Студент гр. МСЭ-10 Айменов Н.К.
Проверил: Доц., канд. техн. наук Смирнов A.H.
1.Формулировка задания
Исследование 1
Дана реакции 2AlCl₃+3H₂=2Al+6HCl . Выполнить следующее:
Составить уравнение зависимости от температуры величины теплового эффекта ∆H⁰т = f(T) и изменения энтропии ∆S⁰т = f(T).
Вычислить величины ∆Ср, ∆Н⁰т, ∆S⁰т, ∆Gт и lnKр при нескольких температурах, значения которых задаются температурным интервалом (300 – 440) и шагом температур = 20. Полученные значения используются при построении графиков в координатах ∆Ср – Т; ∆Н⁰т – Т; ∆S⁰т - Т; ∆G⁰т – Т и lnKр – 1/Т.
Пользуясь графиком lnKр – 1/Т , вывести приближенное уравнение вида lnKр = А/Т + В, где А,В – постоянные.
Исследование 2
Используя правило фаз Гиббса для рассматриваемой системы, определить количество фаз независимых компонентов и число степеней свободы.
Определить возможное направление протекания исследуемой реакции и равновесный состав газовой фазы при давлении Робщ = 101,3 кПа, и температуре Т = 500К. При решении задачи использовать выведенное в исследовании 1 эмпирическое уравнение lnKр = А/Т + В и данные об исходном составе газовой фазы ( Н₂ = 50%, НСl = 50%).
Установить направление смещения состояния равновесия рассматриваемой системы при:
а) увеличении давления (постоянная температура );
б) увеличении температуры (постоянное давление).
3.1. Исследование 1
Таблица 2
Исходные данные для термодинамического исследования реакции
2AlCl₃+3H₂=2Al+6HCl
|
№ п\п |
Вещество |
∆H⁰₂₉₈, КДж/моль |
S⁰₂₉₈, Дж/моль∙К |
Коэффициенты a+bt+c’T⁻², |
в Дж/моль∙К |
уравнение |
|
a |
b*10³ |
c’∙10⁻⁵ | ||||
|
1 |
AlCl₃ |
-697400 |
167,00 |
55,44 |
117,15 |
0 |
|
2 |
H₂ |
0 |
130,60 |
27,28 |
3,26 |
0,50 |
|
3 |
Al |
0 |
25.31 |
20,67 |
2,39 |
0 |
|
4 |
HCl |
-96420 |
186,80 |
28,05 |
3,52 |
- |
3.1.1. Расчет изменения изобарной теплоемкости ∆Сp и теплового эффекта реакции ∆н⁰т
Зависимость теплового эффекта реакции от температуры определяется законом Кирхгофа
∆Н⁰т = ∆Н⁰₂₉₈ + ∆CpdT , (1)
где ∆Н⁰₂₉₈ - стандартный тепловой эффект реакции при 298 К;
∆Cp - изменение теплоемкости системы в результате протекания реакции.
Последняя величина рассчитывается по уравнению
∆Cp = Σ(niCp,i) кон –Σ(niCp,i) исх , (2)
Где Cp,i- мольная изобарная теплоемкость i-го вещества определяемая из уравнения
Сp,i = ai + biT + ci’T⁻² (3)
ni - стехиометрический коэффициент i-го вещества в уравнении реакции.
Для исследуемой реакции, после подстановки в уравнение (2) ni , оно примет вид
∆Cp=(6 Cp + 2Cp )-(2 Cp + 3 Cp ) (4)
Определим температурные зависимости Сp,i для всех реагентов, используя уравнение (2) и термодинамические данные в табл. 2:
Cp =55,44+117,15∙10⁻³T; (5a)
Cp =27,28+3,26∙10⁻³Т+0,5∙10⁵Т⁻² (5b)
Cp =20,67+2,39∙10⁻³Т (5с)
Cp =28,05+3,52∙10⁻³Т (5d)
Определим расчетные уравнения ∆Cp = f(T) для исследуемой реакции. Для чего подставим уравнения (5а, 5b, 5c и 5d) в уравнение (4). После подстановки получим
∆Cp=[6(28,05+3,52∙10⁻³Т)+2(20,67+2,39∙10⁻³Т)]-[2(55,44+117,15∙10⁻³Т)+3(27,28+3,26∙10⁻³Т+0,5∙10⁵Т⁻²)] = 16,92-218,18∙10⁻³-1,5∙10⁵T⁻².
Рассчитаем значение ∆Cp при различных температурах и сведем эти значения в табл. 3. При шаге по температуре в 20 К необходимо рассчитать ∆Cp при следующих температурах: 300, 320, 340, 360, 380, 400, 420 и 440 К.
Таблица 3
Величина ∆Cp при различных температурах для реакции
2AlCl₃ + 3H₂ = 2Al + 6HCl
|
Т, К |
298 |
300 |
320 |
340 |
360 |
380 |
400 |
420 |
440 |
|
∆Cp, Дж/К |
-4,47 |
-4,5 |
-4,8 |
-5,1 |
-5,4 |
-5,7 |
-6 |
-6,3 |
-6,6 |
По данным табл. 3. Строим зависимость ∆Cp=f(T) , как на рис.1.
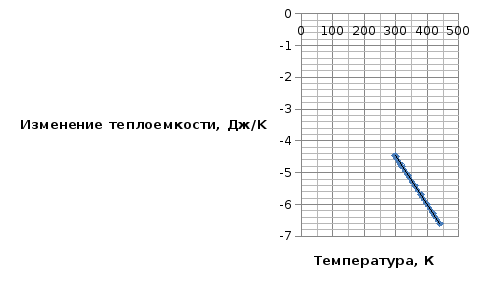
Рис. 1. Зависимость изменения изобарной теплоемкости от температуры
Значение ∆Н⁰₂₉₈ в уравнении (1) определяется по стандартным теплотам образования ∆Н⁰₂₉₈‚i
∆Н⁰₂₉₈ = Σ(niH⁰₂₉₈ i )кон – Σ(niH⁰₂₉₈,i )исх (7)
В рассматриваемом случае уравнение (7) имеет вид
∆Н⁰₂₉₈ = (6∆Н ₂₉₈ + 2∆Н ₂₉₈) – (2∆Н ₂₉₈ + 3∆Н⁰₂₉₈) (8)
или в числовом виде
∆Н⁰₂₉₈ = (-96,46∙6-2∙0)-(-697,4∙2) = -578,76+1394,8 = 816040 Дж.
Чтобы в дальнейшем избежать ошибки при расчете∆Н⁰т, необходимо теплоты образования реагентов в табл. 2 из килоджоулей перевести в джоули.
В соответствии с заданием необходимо рассчитать тепловые эффекты в интервале температур 300-440 К. То есть для исследуемой реакции, в интервале температур 300-440 К, после подстановки численных значений ∆Н⁰₂₉₈ и уравнения (6) в уравнение (1), получим уравнение зависимости теплового эффекта для первой реакции от температуры:
∆Н⁰
= ∆Н⁰₂₉₈ +
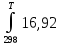 dT
-
dT
-
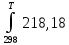 ∙10⁻³TdT-
∙10⁻³TdT-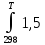 ∙10⁵T⁻²dT
=
∙10⁵T⁻²dT
=
816040+16,92(Т-298)-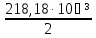 (Т²-298²)+1,5∙10⁵(
(Т²-298²)+1,5∙10⁵(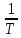 -
-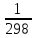 ).
(9)
).
(9)
После подстановки значений температур в уравнение (9) получим тепловые эффекты, значения которых сведем в табл. 4.
Таблица 4
Величина ∆Н⁰ при различных температурах для реакции
2AlCl₃₍тв₎ + 3H₂₍г₎ = 2Al₍тв₎+6HCl₍г₎
|
Т, К |
298 |
300 |
320 |
340 |
360 |
380 |
400 |
420 |
440 |
|
∆Н⁰Т, кДж |
816,04 |
815,94 |
814,89 |
813,76 |
812,55 |
811,25 |
809,87 |
808,40 |
806,84 |
Зависимость ∆Н⁰Т = f(T), построенная по данным табл. 3, представлена на рис. 2.
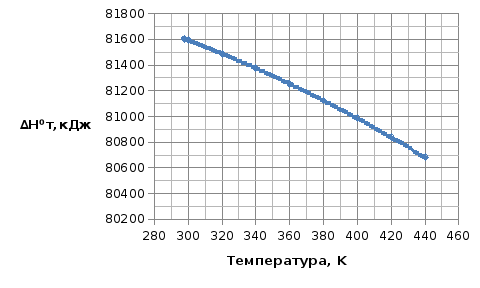
Рис. 2. Зависимость теплового эффекта реакции 2AlCl₃+3H₂=2Al+6HCl от температуры
tgα
= ∆C⁰i,₃₆₀
=
 =
=
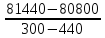 = - 4,5Дж/К.
= - 4,5Дж/К.
