
- •1. Биофизика
- •Лабораторная работа № 1 изучение энергии активации биологических процессов на примере работы na, к-атф-азы
- •Влияние температуры на ферментативную активность Na, к-атф-азы
- •Контрольные вопросы
- •Лабораторная работа № 2 определение концентрации пигментов в растениях по спектрам поглощения
- •Упражнение 1. Определение концентрации хлорофиллов a и b в экстрактах из зеленых листьев
- •Упражнение 2. Изучение зависимости поглощения от концентрации вещества
- •Контрольные вопросы
- •Лабораторная работа № 3 измерение осмотической устойчивости эритроцитов
- •Упражнение 1. Изучение гемолиза с помощью колориметра
- •Упражнение 2. Измерение осмотической устойчивости эритроцитов
- •Контрольные вопросы
- •Лабораторная работа № 4 влияние уф-облучения на светопропускание раствора эритроцитов
- •Упражнение 1. Исследование гемолиза эритроцитов под действием освещения в присутствии красителя
- •Упражнение 2. Исследование зависимости гемолиза от времени освещения
- •Контрольные вопросы
- •Лабораторная работа № 5 изучение электропроводности крови и эритроцитов
- •Упражнение 1. Изучение электропроводности цельной крови, эритроцитов и плазмы
- •Упражнение 2. Изучение влияния гемолиза на электропроводность эритроцитов
- •Контрольные вопросы
- •Лабораторная работа № 6 регистрация потенциала действия нерва лягушки при различных температурах
- •Изготовление препарата изолированного седалищного нерва лягушки
- •Упражнение 1. Наблюдение пд нерва лягушки и расчет скорости проведения возбуждения по нерву
- •Упражнение 2. Расчет энергии активации процесса проведения возбуждения в нерве
- •Контрольные вопросы
- •Лабораторная работа № 7
- •Лабораторная работа № 8
- •Лабораторная работа № 9 определение проницаемости кожи лягушки для ионов
- •Упражнение 1. Изучение динамики распределения ионов
- •Упражнение 2. Влияние ингибиторов и блокаторов на проницаемость кожи лягушки
- •Контрольные вопросы
Контрольные вопросы
1. Основы метода спектрального анализа. Применение данного метода в биологии.
2. Что такое спектр поглощения?
3. От каких факторов зависит форма спектра поглощения?
4. Закон Ламберта – Бэра.
5. Что такое молярный коэффициент экстинкции? В каких единицах он измеряется?
6. Строение фотосинтетических пигментов.
7. Каким образом связаны величины оптической плотности и коэффициента пропускания?
Лабораторная работа № 3 измерение осмотической устойчивости эритроцитов
Цель работы: изучение метода светорассеяния и определение осмотической устойчивости эритроцитов.
Приборы и принадлежности
Фотоэлектрический колориметр (ФЭК), пипетка, микропипетка, растворы NаСl различной концентрации, суспензия эритроцитов в фосфатном буфере.
Эритроциты – клетки крови, содержащие гемоглобин, представляют собой двояковогнутые дискоциты. При помещении эритроцита в гипотонический раствор поваренной соли NаСl на его мембране создается градиент осмотического давления, под действием которого вода проникает внутрь клетки. В результате этого эритроцит «разбухает», принимает форму шара. Дальнейшее увеличение объема приводит к нарушению целостности мембраны и разрушению эритроцита – лизису. При этом содержащийся в эритроцитах гемоглобин выходит в окружающую среду. Описанный процесс называется осмотическим гемолизом.
Разрушение каждого отдельного эритроцита имеет вероятностный характер, так как зависит от многих случайных факторов: состояния мембраны, возраста клетки, температуры и т. д. Поэтому для количественной характеристики процесса гемолиза вводят статистический параметр – осмотическую устойчивость эритроцитов (С0,5). Осмотической устойчивостью эритроцитов называется концентрация соли NаСl, при которой лизирует 50% клеток, содержащихся в суспензии.
Для определения осмотической устойчивости в данной работе используется турбидиметрический метод, который основан на явлении светорассеяния (рис. 3).
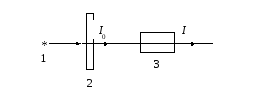
Рис. 3. Схема установки
Свет от источника 1 проходит через светофильтр 2 и попадает в кювету 3, содержащую суспензию эритроцитов, где происходит его рассеяние и поглощение.
Коэффициент пропускания Т равен выраженному в процентах отношению интенсивности I света, вышедшего из кюветы, к интенсивности I0 света, входящего в нее
T=![]() .
.
Чем больше нелизированных клеток содержится в суспензии, тем больше интенсивность рассеянного света, а следовательно, меньше интенсивность света, проходящего через кювету, и коэффициент пропускания. При увеличении количества разрушенных эритроцитов рассеяние света уменьшается, а коэффициент пропускания увеличивается. Таким образом, по степени мутности суспензии и величине коэффициента пропускания можно оценить количество лизированных эритроцитов и определить их осмотическую устойчивость.
Для определения осмотической устойчивости строят график зависимости коэффициента пропускания Т от концентрации С раствора NаСl в суспензии эритроцитов (рис. 4). Справа от графика проводят еще одну вертикальную ось, на которой откладывают величину
Р=![]() , где
т
–
число
нелизированных
эритроцитов, содержащихся
в суспензии, п
–
общее
число эритроцитов
в данной суспензии, Р
–
вероятность
того, что при
данной концентрации раствора NаСl
не
лизировало определенное
количество эритроцитов. Считая, что при
С
= 0
(дистиллированная
вода) лизируют все клетки и Р
= О,
а при С=0,9%
(изотонический раствор) все эритроциты
целы и Р
= 1, можно проградуировать ось Р
и,
отложив на ней значение
Р
= 0,5,
определить по графику соответствующую
этому значению концентрацию раствора
NаСl,
т. е. осмотическую устойчивость
эритроцитов С
0,5.
, где
т
–
число
нелизированных
эритроцитов, содержащихся
в суспензии, п
–
общее
число эритроцитов
в данной суспензии, Р
–
вероятность
того, что при
данной концентрации раствора NаСl
не
лизировало определенное
количество эритроцитов. Считая, что при
С
= 0
(дистиллированная
вода) лизируют все клетки и Р
= О,
а при С=0,9%
(изотонический раствор) все эритроциты
целы и Р
= 1, можно проградуировать ось Р
и,
отложив на ней значение
Р
= 0,5,
определить по графику соответствующую
этому значению концентрацию раствора
NаСl,
т. е. осмотическую устойчивость
эритроцитов С
0,5.
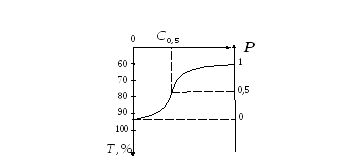
Рис. 4. Зависимость коэффициента пропускания Т от концентрации С раствора NаСl
Для уменьшения влияния поглощения света измерения производятся при красном светофильтре 670 нм, который соответствует минимуму поглощения гемоглобина.
