Бенито муссолини
.docx
|
43. Генная мутация – изменение отдельных нуклеотидов внутри гена. Может быть потеря, вставка, замена одного на другой или перенос на другое место, переворот нескольких нуклеотидов на 180º. Нуклеотид, затронутый мутацией – сайт. 5 типов (синтез белка): 1) гипоморфные – мутантный ген уменьшает синтез белка, 2) гиперморфные – увеличивает синтез белка, 3) аморфные – прекращает синтез белка, 4) неаморфные – синтезирует новый белок, 5) антиморфные – сиртезирует фермент, тормозящий синтез исходного белка. 3 вида (транскрипция): 1) миссенсмутация – замена нуклеотида в триплете заменяет аминокислоту в белке. 2) нонсенс – замена нуклеотида превращает триплет в терминатор. 3) мутация сдвига рамки чтения – вставка или выпадение нуклеотида изменяет аминокислотный состав белка. Цитоплазматическая мутация – изменение ДНК митохондрий и пластид, передаётся только по материнской линии. 30. Классификация мутагенов. Антимутагены |
37. Регуляция экспрессии генов. Оперонные системы регуляции на примере лактозного оперона. Основным св-вом как про-, так и эукариот является их способность осущ-ть дифференциальную регуляцию экспрессии генов. Осуществляя контроль за тем, каким генам экспрессироваться, а каким нет, а также регулируя уровень экспрессии различных генов, клетки приспосабливают свой фенотип к определенным условиям внешн. и внутр.среды. Часто гены экспрессируются последовательно: активация одного гена вызывает экспрессию другого или нескольких генов, приводя в к каскаду событий. Некоторые гены или родственные группы генов экспрессируются координированно, т. е. отвечают на регуляторный сигнал одновременно и, как правило, в одинаковой степени. Вероятно, наиболее совершенные регуляторные системы - те, которые позволяют плюрипотентным стволовым клеткам дифференцироваться с образованием кл-к разн.типа в процессе развития сложн.орг-ма. Фенотипические признаки кл-к разных типов, а также одной и той же клетки в различных условиях зависят от кол-ва и св-в продуцируемых ими структурных, каталитических и регуляторных белков. Регул-ся может какой-то один или несколько отдельных этапов считывания генетич.инф-ции при синтезе белка. У бактерий, например у Е. coli, образование белков регулируется г.о. сод-ем мРНК, доступной для трансляции. Дополнит.способ поддержания нужной конц-ции клеточных белков - регуляция различных этапов трансляции, а также скорости деградации белков. Эукар.кл-ки обладают более сложными механизмами регуляции белкового состава. Содержание мРНК в цитоплазме рег-ся не только на уровне инициации транскрипции в ядре, но и на уровне процессинга первичных транскриптов и транспорта зрелых РНК в цитоплазму. Подобно прокариотам, эукар.кл-ки тоже могут рег-ть как трансляцию, так и скорость транспорта и деградации белков. Согласованная регуляция групп родственных генов. У Е. coli гены, кодирующие белки одного и того же метаболического пути или определяющие близкородственные функции, часто рег-ся соглас-но. Это значит, что их экспрессия нач-ся и заканч-ся или согласованно продолжается в ответ на один и тот же регуляторный сигнал. Гены, подчиняющиеся согласованной регуляции, в геноме часто бывают сцеплены и транскрибируются с промотора, находящегося на 5'-конце такой группы генов (кластера), в виде единственной молекулы РНК, называемой полицистронным (или полигенным) транскриптом. Группа координированно экспрессирующихся генов называется опероном. Регуляция экспрессии лактозного оперона (+билет 57)Негативная регуляция. Бактерии Е. coli могут использовать в кач-ве единств.источника углерода и энергии лактозу, поскольку они способны образовывать в большом количестве -галактозидазу - фермент, расщепляющий лактозу на глюкозу и галактозу. Однако при росте на других источниках углерода в клетках Е. coli образуется очень мало -галактозидазы. Ген, ответственный за синтез -галактозидазы (lacZ), называется индуцибельным, поскольку кодируемый им фермент синтезируется только тогда, когда в клетке присутствуют сахара, имеющие -галактозильные остатки. Помимо -галактозидазы, -галактозиды индуцируют образование еще двух белков: -галактозидпермеазы (кодируемой геном lacY), необходимой для проникновения -галактозидов в клетку, и -галактозидтрансацетилазы (1ас А), фермента с невыясненной пока функцией. В этих трех генах- lacZ, lacY и lacА - содержится вся информация о белках, кодируемых lac-опероном. Они транскрибируются в единую полицистронную РНК, при трансляции которой образуются почти одинаковые количества соответствующих белков. Поэтому можно сказать, что три гена lac-оперона экспрессируются согласованно. Со структурными генами lac-оперона связаны несколько типов регуляторных элементов, ответственных за индуцибельность и координированную регуляцию этих генов. Промотор-это нуклеотидная последовательность, с которой связывается РНК-полимераза и начинается транскрипция трех структурных генов. Оператор-это сайт, с которым связывается lac-репрессор, подавляющий транскрипцию lac-оперона. Ген lac I, не входящий в состав lac-оперона, кодирует репрессор-полипептидную цепь с мол. массой 37000 Да. Репрессор прочно связывается с оператором, находясь в тетрамерной форме. Поскольку промоторная и операторная последовательности перекрываются, связывание репрессора с оператором мешает связыванию РНК-полимеразы с промотором, что приводит к блокир-ю транскрипции структурных генов. Транскрипцию оперона можно индуцировать, если блокировать связывание репрессора с оператором. Такое блокирование происходит при связывании одного из -галактозидов с той или иной субъединицей репрессора, что уменьшает сродство последнего к оператору. После отсоединения репрессора от промотора полимераза может связаться с промотором и инициировать транскрипцию оперона. Очень важно сохранение нуклеотидной последовательности домена lac-оператора, связывающего репрессор. Об этом свидетельствуют результаты исследования эффективности репрессии in vivo у мутантов с модифицированными репрессорами или операторами. Интересные данные были получены и при изучении связывания очищенных репрессорных белков с операторами дикого типа и мутантными формами in vivo. Мутации, уменьшающие сродство репрессора к оператору, приводили к конститутивному синтезу ферментов, кодируемых lac-опероном, т. е. к экспрессии lac-ферментов в отсутствие индуктора. Мутации, сопровождающиеся накоплением репрессора в клетках или увеличением сродства репрессора к оператору, делали lac-оперон неиндуцибельным. Позитивная регуляция. Для экспрессии lac-оперона, как и других индуцибельных оперонов, которые осуществляют контроль синтеза ферментов, участвующих в метаболизме сахаров, необходимо не только снять репрессию оперона, но и получить некий сигнал. Таким сигналом служит комплекс циклического AMP (cAMP) с белком-активатором катаболизма (САР-catabolite activator protein), который связывается со специфической послед-тью, находящейся в самом начале lac-промотора. сАМР, принимающий участие во многих клеточных процессах, образуется из АТР в ответ на самые разные вне-и внутрикл.события. САР представляет собой димер из идентичных полипептидных цепей с мол. массой 22 кДа. Связывание комплекса САР-сАМР со специфической последовательностью в начале промотора приводит к усилению транскрипции lac-оперона почти в 50 раз. Сам по себе САР не способен к такому связыванию и стимуляции транскрипции. Усиление транскрипции с помощью комплекса САР-сАМР можно объяснить тем, что, связываясь с ДНК в непосредственной близости от сайта присоединения РНК-полимеразы, он усиливает сродство этого фермента к промотору.
|
16.генетич. и цитологич.доказательства кросинговера. Цитологические доказательства кроссинговера А. Стертевант предположил, что частота кроссинговера показывает относительное расстояние между генами: чем чаще осуществляется кроссинговер, тем дальше отстоят гены друг от друга в хромосоме. Чем реже кроссинговер, тем они ближе. Таким образом он предложил строить линейные карты расположения генов. В России для обозначения частоты кроссинговера, равной 1%, использовали термин "морганида" в честь Т.Х. Моргана. В США долгое время использовали термин "единица карты" (map unit - m.u.). Начиная с 80-х годов почти повсеместно как в русскоязычной, так и англоязычной литературе используют термин "сантиморган" (centiMorgan или сМ). В начале 30-х годов К. Штерн получил линии дрозофилы, имеющие половые хромосомы, отличимые друг от друга на цитологическом уровне. У самки на одну из Х-хромосом был перенесен небольшой фрагмент Y-хромосомы, что придало ей специфическую Г-образную форму, легко различимую под микроскопом. (Рис.). Схема опыта по цитологическому доказательству кроссинговера на D. melanogaster Были получены самки, гетерозиготные по двум указанным морфологически различным X-хромосомам и одновременно по двум генам Ваг (В) и carnation {car). Цитологический анализ 374 препаратов самок показал, что в 369 случаях кариотип соответствовал ожидаемому. Все четыре класса самок имели по одной нормальной, т.е. палочковидной Х-хромосоме, полученной от отца. Кроссоверные (т.е. В саг+ по фенотипу) самки содержали двуплечую Г-образную Х-хромосому. Схема кроссинговера в IX паре хромосом кукурузы в опытах Крейтона и МакКлинток Эти результаты подтвердили гипотезу Т.Х. Моргана и его сотрудников о том, что кроссинговер представляет собой обмен участками гомологичных хромосом и что гены действительно локализованы в хромосомах. Аналогичные результаты были получены на кукурузе (Рис.). Г. Крейтон и Б. МакКлинток получили линию, в которой хромосомыIX пары у кукурузы оказались цитологически различными (гетероморфными). Одна была нормальной и несла гены с (неокрашенный эндосперм) и Wx (крахмалистый эндосперм), другая несла knob (утолщение) одного плеча, другое плечо было длиннее. Эта хромосома была помечена генами С (окрашенный эндосперм) и wx (восковидный эндосперм). В этом скрещивании обнаружили, что кроссоверные зерна неизменно содержали IX хромосому с обменявшимися участками: хромосому нормальной длины, но с утолщением, или хромосому без утолщения, но удлиненную. 7.Митотический (соматический) кроссинговер. Факторы, влияющие на кроссинговер До сих пор мы рассматривали обмены участками хромосом, происходящие в ходе мейоза. Однако, как выяснилось, кроссинговер может происходить и в соматических клетках в ходе митоза. Гомологичные хромосомы в интерфазе конъюгируют и входят в митотическое деление спаренными. Соматический кроссинговер может быть обнаружен, если он осуществляется на стадии четырех хроматид (Рис.). На частоту кроссинговера влияют: а) внешние условия (температура и др.), б) стадии развития (возраст), в) пол, г) генотип (определенные гены илиструктурные изменения хромосом). Кроссинговер обнаружен почти у всех изученных видов животных и растений, однако формирование обменов хромосом зависит от пола, например, у самцов дрозофилы и самок шелкопряда (оба пола гетерогаметные) кроссинговер не происходит. Схема митотического кроссинговера Острое воздействие высокой температурой, например, тепловой шок при 35°С на стадии 12 час куколки дрозофилы приводит к огромному увеличению частоты обменов. На участке между генами It и stw при 25°С нормальной для дрозофилы температуры - выявлены низкая частота обменов 0,05%. После теплового шока она возрастает более чем в 30 раз (т.е. достигает значения 1,7%). Обнаружены и другие факторы, влияющие на частоты перекреста, такие как дополнительные хромосомы в геноме, хромосомные перестройки и т.д.
Источник: |
|
18. цитоплазматическое) наследование цитопл.мужская стерильность.Не все эукариотические гены локализованы в хромосомах клеточных ядер. После переоткрытия менделеевских законов наследование стало ясно, что некоторые типы изменчивости не подчиняются этим законам. В 1909 г. Карл Корренс опубликовал работу по наследованию пестролистности у Mirabilis galapa, в которой был описан не менделевский тип наследования. Для многих видов декоративных растений характерно пёстролистность – появление белых и жёлтых пятен и полос на листьях зелёных растений. Жёлтые участки могут быть небольших размеров, но иногда жёлтыми становятся целые побеги, тогда как другие остаются зелёными или пёстрыми. Корренс брал пыльцу с цветков, растущих на жёлтых, пёстрых и зелёных побегов, и нанося её (удалив тычинки) на пестики цветов, растущих на побегах всех трёх типов. Свойства, проросших из таких семян растений определяются характером материнского цветка и не зависят от свойств цветка, с которого была взята пыльца. Эти результаты были первым примером цитоплазматической наследственности. Известно, что зелёный цвет растений определяется хлоропластами, содержащими фотосинтетический пигмент – хлорофилл. Зелёные хлоропласты развиваются из самостоятельно делящихся органелл, называемых пластидами, и находящихся в цитоплазме клеток растений. Пластиды клеток из жёлтых участков пёстролистных растений не способны развиваться в нормальные зелёные хлоропласты. Растения, выросшие из семян, завязавшихся в цветках на жёлтых побегах, не способны к фотосинтезу и скоро погибают. Хлоропластная ДНК (хлДНК) представляет собой замкнутую кольцевую двуспиральную молекулу. Ее размеры варьируют у разных видов растений преимущественно в интервале 130—160 тыс. н. п. В настоящее время полностью расшифрована нуклеотидная последовательность хлДНК ряда видов, в том числе табака и риса. При этом обнаружены общие принципы организации хлоропластной ДНК и ее консервативность (неизменность первичной структуры) в ходе эволюции. ХлДНК содержит около 130 генов. В ней представлены по два гена четырех типов (4,5S, 5S, 16S и 23S) рибосомальных РНК (рРНК), гены всех транспортных РНК (около 30 видов), гены рибосомальных белков (около 20). Гены субъединиц РНК-полимеразы — фермента, осуществляющего синтез РНК на хлДНК. Хлоропластный геном кодирует около 40 белков тилакоидной мембраны, участвующих в формировании комплексов электронтранспортной цепи. Это составляет около половины входящих в них белков. Остальные белки тилакоидной мембраны кодируются в ядре. ХлДНК содержит ген большой субъединицы ключевого фермента фотосинтеза рибулозодифосфаткарбоксилазы (РДФК). Организация генетического аппарата хлоропластов и бактерий имеет много общего. По прокариотическому типу организованы промоторы, регулирующие начало транскрипции и локализованные в области 35 — 10 н.п. до точки начала транскрипции, и терминаторы, определяющие ее окончание. Вместе с тем в отличие от прокариот в хлДНК обнаружены интроны, характерные для генов эукариот. Хлоропластные рибосомы относятся к 70S-типу, характерному для прокариот. Для каждого вида растений характерно определенное число хлоропластов в клетке, варьирующее у разных видов от нескольких единиц до величин, превышающих сотню. Число хлоропластов в клетке, а следовательно, их деление контролируется ядром. Таким образом, формирование всех важнейших структур хлоропласта зависит и от ядра, и цитоплазмы. Это объясняет невыполнимость идеи создания культуры изолированных хлоропластов, где бы они самостоятельно размножались на питательной среде. Происхождение ДНК органелл Широко распространено мнение, что митохондрии и хлоропласты произошли от прокариотических эндосимбионтов, которые обитали в цитоплазме предшественников эукариот. Как полагают, митохондриям дали начало пурпурные бактерии, а хлоропластам (позднее) — цианобактерии (синезеленые водоросли) или близкие к ним организмы. Симбионты проникли в эукариотические клетки и в ходе эволюции потеряли свою автономность, передав большое число важнейших генов в ядерный геном. В результате независимая бактериальная клетка превратилась в полуавтономную органеллу, сохранившую главную исходную функцию — способность к фотосинтезу (у хлоропластов) и систему окислительного фосфорилирования (у митохондрий). Хотя многие гены этих древних бактерий все еще используются для синтеза белков органеллы, большая их часть по неясным причинам включилась в ядерный геном, где они кодируют ферменты, которые сходны с бактериальными и синтезируются на рибосомах в цитоплазме, а затем переходят в органеллу.
Источник: |
40. МОДИФИКАЦИОННАЯ ИЗМЕНЧИВОСТЬ. Адапт-е и эволюц-е значение. Наследуется не признак, а способность к его проявлению =>учитывается влияние среды. I.e.: Эпигамный тип опредления пола у морского червя Bonellia viridis. Личинка, попавшая на хоботок матери ~>самец, паразитирующий в матер.теле и ополодотв-ий яйца; личинка, осевшая на грунт ~>самка. Наследуется и степень возможного изменения выраженности признака (i.e.: у мух линии Bar размер глаз варьируется меньше, чем у мух линии Eyeless). 3 типа фенотипических проявлений: 1.Гипоморфизм (↑числа мутант.генов =>нормализация фенотипа); 2.Антиморфизм (действие одного мутант.гена аллеля уравновешивает действие одного норм.аллеля, выраженность проявления генов одинакова); 3.Неоморфизм (действие мутант.гена не зависит от наличия норм.генов аллеля). Пенетратность – доля особей (%), в которых рассматриваемый признак проявляется у всех особей с одинаковым генотипом (в т.ч.и проявляющийся незначительно). Экспрессивность – степень выраженности (%) рассматриваемого признака по отношению к его максимальной выраженности среди особей данного генотипа. Эти два показателя опред-ся не только генотипом, но и условиями обитания. Примеры модифик.изменчивости: развитие черной окраски шерсти гималайских кроликов в местах, подвергавшихся охлаждению, изменение размера листьев стрелолиста в воде и на воздухе. Норма реакции — способность реагировать на варьирующие условия развития. Отличия модифик.изменений от мутаций: 1.Проявление у всех особей, помещенных в данные условия (а не одной – как с мутациями); 2.Адаптивность большинства модификация, а не случайное возникновение нового признака. Вывод: на проявление генотипа в фенотипе влияют другие гены генома (супрессоры etc), внутренние факторы развития и физиологии организма и внешние условия (среда обитания).
|
48.химич. и биол.факторы мутагенеза. Мутаген – фактор, вызывающий мутацию. Классы: физические (основными мутагенами явл-ся ионизирующие излучения, ультрафиолетовые лучи и повышенная температура. К группе ионизирующих излучений относят рентгеновы лучи, γ-лучи и β-частицы, протоны, нейтроны. Ионизирующие излучения, проникая в клетки, на своем пути вырывают электроны из молекул, что приводит к образованию положительно заряженных ионов. Освободившиеся электроны присоединяются к другим молекулам, кот становятся отрицательно заряженными. В рез-те облучения клеток образуются свободные радикалы водорода (Н) и гидроксила (ОН), кот дают соединение Н2О2. Такие превращения в молекулах ДНК и кариотипе в приводят к изменению функций генетического аппарата клеток, возникновению точковых мутаций. Ионизирующие облучения могут нарушить процессы деления в соматических клетках, вследствие чего возникают нарушения и злокачественные образования), химические (это вещества химической природы, способные индуцировать мутации: алкилирующие соединения (диметил- и диэтилсульфат, фотрин), аналоги азотистых оснований и нуклеиновых кислот (кофеин), красители (акридин желтый и оранжевый), азотистая кислота, пероксиды, пестициды, минеральные удобрения (нитраты). Химические мутагены индуцируют генные и хромосомные мутации) и биологические (это простейшие живые организмы, вызывающие мутации у животных: вирусы, бактерии. Биологические мутагены вызывают широкий спектр мутаций в клетках животных (хромосомные). Антимутагены – вещества, в различной степени снижающие уровень мутабильности. Важная особенность их - стабилизация мутационного процесса до естественного уровня. Им присуща физиологичность действия (в высоких дозах могут действовать как мутагены – аргинин). Отдельные мутагены характеризуются специфичностью действия - они эффективны только по отношению к аберрациям хромосом или генным мутациям. Механизм действия антимутагенов связывают с нейтрализацией мутагена до его взаимодействия с ДНК; активацией ферментных систем детоксикации поступающих из среды загрязнителей; предотвращением ошибок в процессе репликации ДНК. Группы антимутагенов: 1) витамины и провитамины ( витамин Е снижает мутагенное действие ионизирующих излучений и химических соединений; витамин С способствует уменьшению частоты аберраций хромосом, вызванных ионизирующими излучениями; витамин А снижает естественное и искусственное мутирование в клетках у животных; витамина В снижает действия алкилирующих соединений, ультрафиолетового облучения путем усиления репарации.) 2) аминокислоты (аргинин, гистидин, метионин, цистеин). 3) ферменты (пероксидаза, каталаза). 4) фармакологические средства (интерферон). 5) группа веществ с антиокислительными свойствами (производные галловой кислоты). 6) комплексные соединения. Пути снижения концентраций вредных веществ: создание безотходных технологий; переход от химических средств борьбы в сельском хозяйстве на безвредные биологические; создание устойчивых сортов растений, не требующих химических средств защиты; выявление мутагенов в окружающей среде и их изъятие . продолжение |
|
57.исходный мат-л в селекции.понятие о ге Ногеографии. Селекция является одной из важнейших областей практического приложения генетики. Теоретическая база селекции - генетика. Хотя генетика и селекция являются вполне самостоятельными дисциплинами, они неразрывно связаны между собой. Управление процессами наследования, изменчивости и индивидуального развития растений и животных требует знания законов наследственности, действия гена в системе генотипа, генетического потенциала данного вида и т.д. Задачи селекции. Задача селекции состоит в создании новых и улучшении уже существующих сортов растений, пород животных и штаммов микроорганизмов. Выдающийся советский генетик и селекционер, академик Н.И.Вавилов, определяя содержание и задачи современной селекции, указывал, что для успешной работы по созданию сортов и пород следует изучать и учитывать: исходное сортовое и видовое разнообразие растений и животных; наследственную изменчивость (мутации); роль среды в развитии и проявлении изучаемых признаков; закономерности наследования при гибридизации; формы искусственного отбора, направленные на выделение и закрепление желательных признаков. Основные направления селекции. В соответствии с требованиями, предъявляемыми к сортам различных культур, породам животных и применительно к климатическим, почвенным зонам, селекция имеет следующие ориентации: 1. на продуктивность сортов растений и пород животных; 2. на качество продукции (технические, технологические свойства, химический состав зерна - содержание белка, клейковины, жиров, отдельных незаменимых аминокислот); 3. на физиологические свойства (скороспелость, засухоустойчивость, иммунитет к заболеваниям и т.д.); 4. на создание сортов интенсивного типа, способных высокопроизводительно использовать условия высокой современной агротехники, в том числе орошения, пригодность к механизированному возделыванию и т.д. В селекции растений важное место занимает отдаленная гибридизация - скрещивание растений разных видов или родов. В развитии метода отдаленной гибридизации и преодолении трудностей получения плодовитых гибридов (обусловленных различиями в структуре генома, негомологичностью хромосом и др.) В опытах по получению межродового гибрида (капусты и редьки), способного к размножению, метод совмещения геномов родительских форм, отличающихся по количеству хромосом, с помощью искусственной полиплоидии. В современной селекции для увеличения разнообразия исходного материала все шире используется явление полиплоидии. Полиплоидией называют явление кратного увеличения набора хромосом в ядрах клеток организмов. Растения, в соматических клетках которых содержится обычный двойной набор хромосом, называются диплоидными. Если у растений набор хромосом повторяется более двух раз, они являются полиплоидными. Большинство видов пшеницы имеют 28 или 42 хромосомы и относятся к полиплоидам, хотя известны диплоидные виды с 14 хромосомами (например, однозернянка). Среди видов табака и картофеля есть виды с 24, 48 и 72 хромосомами. Полиплоидия - довольно частое явление в природе, особенно у цветковых растений (злаковых, пасленовых, сложноцветных и др.). По внешним признакам полиплоиды обычно бывают более мощными, чем диплоиды, с рослыми крепкими стеблями, крупными листьями, цветками и семенами. Это объясняется тем, что у полиплоидов клетки значительно крупнее, чем у диплоидов. В селекционной работе для создания разнообразия исходных форм широко применяется экспериментальный мутагенез - получение мутаций под воздействием рентгеновских или ультрафиолетовых лучей, низких или высоких температур, различных химических веществ и др. Большинство мутантов отличаются пониженной жизнеспособностью или не имеют хозяйственно ценных признаков. Все же часть мутаций вызывает благоприятные изменения отдельных признаков и свойств, не снижая жизнеспособности, а иногда даже повышая ее. Встречаются мутанты, проявляющие более высокую продуктивность, чем исходные сорта. Такие формы были получены у ячменя, овса, гороха, люпина, льна, арахиса, горчицы и других культур. Порода (сорт) - искусственно созданная в процессе селекции совокупность особей которая характеризуется определенными наследственными особенностями: высокой продуктивностью, морфологическими и физиологическими признаками. Штамм - что-то связанное с бактериями, микроорганизмами (пример, кишечная палочка с внедрённым геном, синтезирует инсулин.
|
65.генетика как теоретич.основа селекции. Опухолевое заболевание растении, известное как корончатый галл известно давно. В начале нашего века Е. Смит и К. Таундсен (1907) показали, что вызывает это заболевание почвенная бактерия. Выделенная в виде чистой культуры Agrobacterium tumefaciens способна приводить к образованию опухолей у некоторых представителей голосеменных и большинства двудольных покрытосеменных растений. Клетки растительных опухолей интенсивно растут на искусственных средах и при этом не нуждаются в добавлении фитогормонов в отличие от клеток нормальных тканей. В 70-х годах выяснилось, что причиной опухолеобразования являются так называемые Ti-плазмиды, обнаруженные в клетках некоторых штаммов A. tumefaciens. Ti-плазмиды — это кольцевые молекулы ДНК размером 50—80 мкм с молекулярной массой около 1,3108 Д длиной до 200 тыс. п. н. Эти плазмиды проникают из бактерий в клетки растения, и часть ДНК Ti-плазмиды, так называемая Т-ДНК, ковалентно встраивается в хромосомы инфицируемого растения. Будучи интегрирована с хромосомой, Т-ДНК вызывает образование опухоли, гиперпродукцию фитогормонов: цитокининов и индолилуксусной кислоты (ауксина), а также синтез ряда производных аминокислот, объединяемых под общим термином опины. Опухоль возникает вследствие нарушения баланса фитогормонов, от которого зависит нормальный морфогенез растения. Опины, выделяемые клетками опухоли, бактерия использует в качестве источников углерода и азота, причем только в том случае, когда A. tumefuciens содержит Ti-плазмиду, заразившую клетки растения. I Ti-плазмида относится к классу конъюгитивных плазмид, т.е. может передаваться в клетки A.tumefаciens, лишенные её. Этот процесс эффективно происходит в зараженном растении и стимулируется опинами. Описанные здесь взаимоотношения A. tiimefaciens и высшего растения Дж. Шелл назвал генетической колонизацией, которая представляет собой эксперимент по генной инженерии, поставленный самой природой. Таким образом, Ti-плазмида — это природный вектор для трансформации клеток высших растений. Как показал Дж. Шелл, если из клеток корешков табака с интегрированной Т-ДНК получить культуру (каллус) растительной ткани, а затем целые растения-регенеранты, то при последующем генетическом анализе признак «присутствие Т-ДНК» обнаруживает менделевское расщепление. В качестве векторов для клонирования генов и последующей трансформации растений используют две разновидности Ti-плазмид. Они различаются по типу опинов (октопины или нопалины), которые синтезируют зараженные ими растения. Клонируемый ген встраивают вместо кодирующей части генов октопинсинтетазы или нопалинсинтетазы, входящих в состав Т-ДНК. Для клонирования гена в бактерии, обычно Е. coli, конструируют гибридные плазмиды. После заражения растения плазмидой ее Т-ДНК со встроенным геном интегрирует с хромосомной ДНК. В настоящее время выделены и проклонированы несколько десятков генов высших растений, в том числе гены, контролирующие запасные белки: сои, ячменя, гороха, кукурузы, а также некоторые гены, контролирующие активность ферментов: алкогольдегидрогеназы и каталазы кукурузы, -амилазы ячменя; некоторые гены хлоропласта пшеницы, шпината и др. Первыми чужеродными генами, введенными в начале 80-х годов в высшие растения, были гены устойчивости к антибиотикам из Е. coil. Так, в клетки табака был передан ген устойчивости к метатрексату — ингибитору дигидрофолатредуктазы. В табак был введен также ген дрожжей, кодирующий алкогольдегидрогеназу. Этот ген устойчиво наследовался в мейозе у растений-регенерантов, полученных из каллусной ткани, но не экспрессировался в клетках растений. Ген, кодирующий -глобин кролика, удалось интегрировать в геном табака. Он устойчиво наследовался в культуре каллусной ткани, но опять же не экспрессировался. В клетки подсолнечника с помощью Ti-плазмиды был передан ген фазеолина бобов. Фазеолин — это гликопротеин, составляющий до 50 % запасного белка бобов. Будущее растение, полученное первоначально в виде каллусной массы, получило наименование санбин (от объединения англ. названия подсолнечника — sunflower и бобов— bean). Тот же ген фазеолина введен в табак и получены растения-регенеранты, синтезирующие менее 1 % фазеолина от общего белка растения. Получены растения табака, которые светятся в темноте благодаря экспрессии в них гена люциферазы светлячка. Это лишь первые шаги генной инженерии растений.
|
53. Методы генетики чел.: 1. Генеалогический метод (позволяет преодолеть сложности связанные с невозмож-тью скрещивания и малоплодностью чел.). Если есть родословные, то можно, использ. данные по неск. семьям, опред. тип наследован.(домин.,рецессив., сцеплен. с полом, аутосомный) признака + его моногенности или полиген.. Заболев.: домин- «габсбургская губа» (толст. выпяч. ниж. губа) прослежив. в династии Габсбургов с 15 века.; домин.- короткопалость (недоразвит. или срастание конц. фаланг.);домин.- ахондроплазия (карликовость-резкое укороч. конечн.). Гемофилия А (отсутствие VII фактора или нет образ. фибриноген-фибрин) наслед. как рецессивн. аллель в Х-хром =>сцепл. с полом. Лечен-введение VII из донор. крови. Гемофилия В (девект тромбопластин=IX)-рецесс. сцепл. с полом. Трудность метода-нехватка данных.. Обозначения в родослов.: квадр-т –муж, круг-жен., ромб-неизв.пол, --брак, =-родствен. брак, перечеркнуые фигуры-умерш., круг с точкой- гетерозигот. носительнича мутант. гена в Х-хром., близнец. двуяйц.-(вверх ногами), а однояйц. + соеденинины. Аборт-линия мален.черн круг, выкидыш-мал. черн. треуг.. 2. Близнецовый метод (для выяснения степени наследственной обусловленности исследуемых признаков.) Полиэмбриония: появление однояйц. близнец.(ОБ), разнояйц (РБ). ОБ-одного пола, РБ-м.б. совсем разн.. Основоположник метода- Гальтон(19в.) предложил сравнивать ОБ и РБ для выяснения влияния наследственности и влияния среды на проявл. признак. Положения: 1. ОБ. имеют идентичн. генотипы,РБ-разл. 2. Среда, в кот. развиваются Б и под дей-ем кот. появл. различия призн., мб. одинак. и неодин. для одной и той же рары ОБ. 3. Все св-ва орг-ма определяются взаимод-ем 2 фак-ров: генотипа и среды. Эти полож. позв. сравнивать влияния генотипа и среды на разв. призн. На основе данных вычисляют показатели конкордантности (частоты сходства) и дискод. (част. различ). Сравнив(норм. призн.-группы крови, форм. бровей, цв. глаз, волос; пат. призн- косолапость, рахит, корь, рак, слабоумие, эпилепсия…). У ОБ конкордантность выше, чем у РБ, но степень варьирует от призн. к призн.=> оценка влиян. генот. и среды. Доля наследственности в развит. признака (Н)=(М%-D%)/(100%-D%),где М-конкордантность у ОБ, D- у РБ. Пытались анализ. склонность к преступл., но сходство поведения м.б. результат. их одинак.соц. опыта. Близнец. метод показывает, что генетич. детерминир. призн. м.б. подвергаться модификац. изменчивости. 3. Цитогенетич. метод-трудность- большое кол-во трудно отличимых др. от друга (в предел. групп) хромосом. Решение- дифференц. окраска. Материал получ. культивированием клеток чел (лейкоц.) in vitro. ЦМ примен. при диагностике наследств забол, кот связ. с явл-ями анэуплоидии и разл. хромосомн. абберациями.; наблюдение интерфазных клеток (муж. и жен. разл по налич. тельца Барра, или полового хроматина, кот есть у жен. в этих кл.). Пол. хроматин –результат гетерохроматинизации одной из 2-х Х-хром, инактив. у жен., его идентиф. из слизист рта исп в спорт мед. для установл. ген. пола. ЦМ исследов. людей, имеющ. разн. кол-во X Y хром.-> B=X-P/2, где В-число телец Барра, X-Xхромосом, P- плоидность. Гибридизация соматических клеток открыла нов. воз-ти (получ. гибрид. чел и мышин. сомат. кл.)-преодол. проблем, связ. с невозможн. скрещ. Клонирование ряда генов чел. позвол. обнаруж. полиморфизм по этим генам на основе использ. рестрикционного анализа хромосом. ДНК. Различающ. фрагменты ДНК (соотв. данному гену) выявл. электрофорез. рестриктов+гибридизация их с радиоактив.зондом (клонированн. уч. ДНК). Зонды использ. для локализац. генов на препаратах хромосом. Если этот подход+диффер.окраска=> можем привязать конкр. гены к конкр. уч. конр. хромосом. Генеологический+цитогенетический+генная инженерия=> быстр. какртирование генов чел.
|
|
55.медико-генетич.консультирование. Наиболее эффективным подходом к профилактике наследственных болезней является медико-генетическое консультирование. Впервые такая консультация была организована в конце 20-х годов ХХ века крупнейшим русским генетиком и невропатологом С. Н. Давыденковым при институте нервно-психиатрической профилактики в Москве.
Суть консультирования заключается в следующем:
1) определение прогноза рождения ребенка с наследственной болезнью;
2) объяснение вероятности этого события консультирующимся;
3) помощь семье в принятии решения.
Обычно в консультацию обращаются семьи, где у детей имеются наследственные заболевания и есть риск наследственной патологии у будущего потомства. Появление таких признаков предполагается у в связи с наличием заболеваний у родственников, кровно-родственных браков, возраста родителей старше 35-40 лет, облучение и другие причины. Врач-генетик способствует постановке диагноза, используя специальные генетические методы.
Эффективность консультации зависит от:
1) точности диагноза;
2) точности расчета генетического риска;
3) уровня понимания значения генетического консультирования.
Консультирование включает 3 этапа. Первый этап начинается с уточнения диагноза наследственного заболевания. В зависимости от точности диагноза выделяют 3 группы лиц: 1) у которых имеются подозрения на наследственное заболевание;
2) с установленным диагнозом, однако он вызывает сомнение;
3) с правильным диагнозом. |
54.хромосомы человека в норме и пат-ии.на Следств.заб-я. Хромосомы – плотные, интенсивно окрашивающиеся структуры, которые являются единицами морфологической организации генетического материала и обеспечивают его точное распределение при делении клетки. Число хромосом в клетках каждого биологического вида постоянно. Обычно в ядрах клеток тела (соматических) хромосомы представлены парами, в половых клетках они не парны. Одинарный набор хромосом в половых клетках называют гаплоидным (n), набор хромосом в соматических клетках диплоидным (2n). Хромосомы разных организмов различаются размерами и формой. Диплоидный набор хромосом клеток конкретного вида живых организмов, характеризующийся числом, величиной и формой хромосом, называют кариотипом. В хромосомном наборе соматических клеток парные хромосомы называют гомологичными, хромосомы из разных пар - негомологичными. Гомологичные хромосомы одинаковы по размерам, форме, составу (одна унаследована от материнского, другая – от отцовского организма). Хромосомы в составе кариотипа делят также на аутосомы, или неполовые хромосомы, одинаковые у особей мужского и женского, и гетерохромосомы, или половые хромосомы, участвующие в определении пола и различающиеся у самцов и самок. Кариотип человека представлен 46 хромосомами (23 пары): 44 аутосомы и 2 половые хромосомы ( у женского пола две одинаковые X-хромосомы, у мужского – X- и Y- хромосомы).
Кариотип – совокупность хромосом соматической клетки определенной формы, числа и размера, типичного для данного вида. Одним из основателей учения о кариологии был Навашин. Им были описаны спутники (сателлиты) хромосом. Он считал, что форма и число хромосом характерны для каждого вида.
Геном – полный гаплоидный набор генов или хромосом клетки или организма. Изменения генетического аппарата половых органов приводят к патологиям дочерних организмов. Они могут касаться изменений структуры ДНК - генные мутации, структуры хромосом - хромосомные мутации, количество хромосом - геномные мутации. Все виды мутаций вызывают наследственные болезни. К ним относится обширный круг заболеваний: болезни внутренних органов, обмена веществ, крови, эндокринной системы, кожи, глаз, мочеполовой системы, нервные и психические заболевания.
В случае генных мутаций заболевание можно проследить с помощью генеалогического метода, т.к. мутантные гены передаются из поколения в поколение. Большинство же хромосомных аномалий, в частности анеуплодии, характеризуются множественными пороками развития, пониженной жизнеспособностью, психической отсталостью, бесплодием и чаще несовместимы с жизнью. Таким образом большинство хромосомных мутаций не наследуется, но в каждом поколении они появляются в некотором количестве (0, 5-0, 7%) в основном как результат вновь возникшей мутации в половых клетках у фенотипически и генотипически здоровых родителей. Основным сигналом понятия наследственные болезни является не факт наследуемости этих заболеваний, а нарушения в наследственном аппарате половых клеток родителей.
Различают моногенные болезни, при которых генетическое нарушение связано с мутацией в единичном локусе хромосомы, и полигенные - обусловленные совокупным действием мутаций в нескольких локусах хромосом. В последнем случае обычным является предрасположенность к заболеванию, сама болезнь является результатом взаимодействия генетических факторов и среды.
Наследственная патология проявляется в разном возрасте: и в эмбриональный, и постэмбриональные периоды, в зрелом и даже пожилом возрасте.
Предрасположенность проявляется в изменении нормы реакции организма на действие факторов внешней среды. Например, у предрасположенных к диабету изменена норма реакции на крахмал и сахар. Они вызывают расстройство умственного, а затем и общего обмена, при расположенности к пигментной ксеродерме чувствительность на УФ лучи.
Генетическая индивидуальность проявляется во многих вариациях строения органов, физиологических функций и биохимических реакций (изменчивость по химическому составу тканей, разные типы экскреций, разная активность ферментов). Отсюда возникают различные реакции организмов на воздействие патогенных факторов. Воздействие одной и той же интенсивности для одного является патогенным, для другого безвредным. При любой патологии, в том числе наследственной, обусловлены взаимодействием генетических факторов и среды.
Во многих случаях мутантный аллель обуславливает предрасположенность к болезни. Так в случае подагры пенетрантность заболевания составляет 10-20% у мужчин, проявление к 30-50 годам. Развитию болезни способствует переедание, злоупотребление мясной пищей, виноградными винами, а также велико значение микроэлемента молибдена. При его повышенном содержании в почве заболевание среди населения возрастает (он входит в состав фермента, окисляющего ксантин, гипоксантин в мочевую кислоту).
Феномен предрасположения особенно характерен для полигенных болезней: - атеросклероз, гипертония, шизофрения и др. У предрасположенных к наследственным гипертониям людей заболевание развивается вследствие перенапряжений, конфликтных ситуаций, другие же люди под влиянием таких же факторов не испытывают возникновения заболевания. Также развиваются наследственные патологии близорукости, дальнозоркости и др.
В связи с выше изложенным можно разделить наследственные заболевания на 5 групп в зависимости от соотношения роли среды и генотипа . Необходимо различать понятия врожденные и наследственные заболевания. Иногда они совпадают, если наследственное заболевание бывает врожденным, однако в ряде случаев такого совпадения нет. Термин врожденное заболевание говорит лишь о времени проявления заболевания, а не о его причинах, которые могут быть как наследственными, так и нет. Например пороки развития лицевого черепа (расщелины губы и неба), скелета рук (поли-, синдактилия), некоторые пороки сердца и внутренних органов, могут возникать как в случае мутации генов, так и в результате влияния вредных факторов среды в критические периоды развития органов. К таким факторам относятся гипоксия плода, авитаминозы, вирусные или паразитарные заболевания матери на ранних стадиях беременности (краснуха, токсоплазмоз). Такие копии наследственных пороков называют фенокопиями, а они не наследуются.
Основной причиной возникновения наследственных заболеваний является наследование, сцепленное с полом. Признаки, расщепление по которым при скрещивании связанно с полом, называют сцепленным с полом. Эти признаки обуславливаются генами, локализованными в половых хромосомах. Установленно, что наследование их зависит в основном от Х-хромосомы. Y-хромосома имеет небольшие размеры, состоит преимущественно из гетерохроматина и является генетически инертной,за исключением, некоторых генов, контролирующих воспроизводительную функцию и признаки пола. У самцов млекопитающих гены, локализованные в Х-хромосоме, не имеют доминантных или рецессивных аллелей на Y-хромосоме. Особей женского пола, гетерозиготных по любому из сцепленных признаков, называют носителями соответствующего рецессивного гена. Они фенотипически нормальны, но половина их гамет несет рецессивный ген. Несмотря на наличие у отца нормального гена, сыновья матерей носительниц с вероятностью 50% будут страдать данной болезнью.
Р ♀XHXh × ♂ XHY
g XH Xh XH Y
F XHXH XHXh XHY XhY |
52.факторы динамики популяции.биомониторинг. В популяциях животных постоянно изменяются частоты генов, что можно наблюдать при анализе смежных поколений. Такие изменения составляют суть динамики популяций. Факторы генетической динамики популяций: миграция, эмиграция, мутации, хищничество, отбор, генетический дрейф, конкуренция и др.
Родственное скрещивание — это скрещивание особей, состоящих в близком родстве: родители - дети, брат — сестра. Родственное скрещивание у животных обозначают термином инбридинг, в растениеводстве самоопыление растений -- инцухт. Однако часто термином инбридинг обозначают близкородственное скрещивание вообще. Длительный инбридинг сопровождается гомозиготизацией потомства, то есть все большее число генов присутствует в одной из возможных аллельных форм. Чем меньшее количество генов ответственно за развитие признака и чем дальше степень родства, тем медленнее наступает гомозиготность. Однако, следует иметь в виду, что абсолютной гомозиготности не наблюдается никогда, поскольку всегда возникают мутации. Путем применения инбридинга выводят чистые линии -гомозиготные формы одного сорта.
Неродственное скрещивание (аутбридинг) — скрещивание неродственных особей, которые могут принадлежать к одной или разной породе или сорту, и даже к разным видам и родам. Если инбридинг приводит к фиксированию определенных признаков в ряду поколений, то за счет аутбридинга осуществляют объединение различных свойств в одном организме. Одним из важнейших следствий аутбридинга является гетерозиготизация, при которой большое число генов генофонда группы организмов присутствует в двух или более аллельных формах.
Для сельского хозяйства ценен один из эффектов аутбридинга —гетерозис. Гетерозис —явление резкого увеличения жизненной силы у гибридов, полученных при скрещивании родителей двух чистых линий. Под жизненной силой при этом подразумевают плодовитость, выживаемость и ряд других свойств. Наиболее сильно гетерозис проявляется у гибридов первого поколения, после чего в ряду поколений достаточно быстро исчезает. Биологические механизмы гетерозиса еще не достаточно изучены. Выдвинуто несколько гипотез, однако ни одна из них не дает исчерпывающего объяснения этому явлению. Для усиления гетерозиса также используют метод двойной межлинейной гибридизации, при этом скрещивают гибридов, полученных от скрещивания чистых линий.
Отдаленная гибридизация — скрещивание особей, относящихся к разным видам и родам. Её применение позволяет получать особей с уникальным сочетанием признаков, характерных для разных видов. Несмотря на то, что в природе существуют механизмы, препятствующие межвидовому скрещиванию, в некоторых случаях все-таки удается получать потомство (например, мул — гибрид от лошади и осла). Часто, однако, существенным недостатком таких гибридов является их стерильность, однако и это иногда может быть преодолено, в результате аллодиплоидизации.
|
|
20.микроорганизмы-обьект генетики.методы обнаружения мутаций. В 40-х годах XX в. началась новая эра в изучении генетических закономерностей. Генетическими исследованиями занялись не только генетики, но и физики, химики, микробиологи. Объектом исследований стали прокариоты. Долгое время существовало мнение, что микроорганизмы не обладают наследственностью. Микробиологи и генетики по-разному оценивали их с точки зрения целостной единицы. Первые считали организмом, т.е. живой единицей, огромную популяцию клеток, иными словами, бактериальную культуру. Вторые же рассматривали культуру микроорганизмов как сообщество свободно живущих клеток, а колонию — как потомство одной клетки. Информация, по их мнению, должна передаваться от клетки к клетке, а не от культуры. В связи с этим было различным и представление об изменчивости бактерий. Так, по мнению микробиологов, кишечная палочка, обычно культивирующаяся на лактозе, в результате адаптации к условиям существования спустя определенное время после посева может дать рост и на среде с другим сахаром (глюкозой). Генетики же полагают, что способность бактерий расти на глюкозе может развиться и без всякой связи с углеводом при условии, если в культуре будет хотя бы одна клетка, сбраживающая этот сахар, и будет время для ее размножения. Сталкиваясь с разнообразием клеток в культуре, микробиологи по-разному объясняли это явление. Некоторые утверждали, что бактерии, обладая огромной биологической пластичностью, могут принимать любую биологическую форму и изменять физиологическую функцию. Такое направление получило название плейоморфизм. Последователи другого направления — мономорфизма — считали, что потомки одной бактерии обладают строго постоянной структурой и функцией и изменчивость является результатом засорения культуры. По мере более глубокого изучения изменчивости бактерий, их способности адаптироваться к условиям обитания существующие концепций оказывались все более несостоятельными и вытеснялись новыми гипотезами. Согласно концепции диссоциации, изменчивость обусловливалась превращением одной формы бактерий в другую. Например, шероховатая форма непатогенных пневмококков может диссоциировать в гладкую патогенную: R→S. В то же время сторонники онтогенной (циклогенной) теории считали, что гладкие и шероховатые формы пневмококков — это лишь различные фазы жизненного цикла одних и тех же бактерий. Все это свидетельствовало об отсутствии четких представлений о причинах изменчивости бактериальных клеток. Бактерии долго не включались в генетические исследования из-за малых размеров, исключающих возможность достаточно четкого цитологического анализа их, отсутствия конкретных представлений о причинах изменчивости микроорганизмов, а также навыков по гибридологическому анализу. Датой рождения генетики микроорганизмов следует считать 1943 г., когда появились работы С. Луриа и М. Дельбрюка, которые показали, как следует строить опыты с микроорганизмами, вести учет их признаков, проводить количественный анализ полученных результатов. Микроорганизмы оказались очень удобным объектом для генетических исследований прежде всего потому, что 1 они являются гаплоидными организмами, у них одна хромосома и она представляет собой молекулу нуклеиновой кислоты, не связанную с белком. Кроме того, 2 микроорганизмы обладают коротким жизненным циклом: некоторые вирусы и бактериофаги живут 20-30 мин, грибы— 1-2 ч. За такой промежуток времени вследствие 3 большой скорости размножения они дают многочисленное потомство. Это позволяет уловить генетические события, происходящие с частотой одно на 1 млн. клеток и реже. И, наконец, 4 микроорганизмам присущи два способа размножения — половой и бесполый. Микроорганизмы как объект генетических исследований должны обладать рядом достаточно хорошо регистрируемых признаков. Это прежде всего морфологические признаки, т. е. форма и размер колоний, отдельных бактериальных клеток, окраска и характер поверхности (гладкая, шероховатая) колоний и т. д. Эти признаки можно оценить визуально с помощью светового микроскопа или же без специальных приборов и инструментов. Сравнительно несложно учитываются и физиологические (функциональные) признаки бактерий — устойчивость к температуре, свету, химическим веществам, в том числе антибиотикам. Например, фенол или этиловый спирт вызывает у некоторых бактерий образование добавочных жгутиков, а избыток солей кальция подавляет спорообразование. При исключении из среды этих факторов морфологические признаки микроорганизмов восстанавливаются. Нарушение способности синтезировать те или иные необходимые для нормальной жизнедеятельности бактерий вещества лежит в основе биохимических признаков. Все микроорганизмы по способу питания делятся на две группы: прототрофы и ауксотрофы. Прототрофы — бактерии дикого типа. Они могут жить на минимальной питательной среде, содержащей лишь минеральные соли и углеводы, и нужные им вещества (аминокислоты, витамины и пр.) синтезируют сами. Ауксотрофы — микроорганизмы, потерявшие способность синтезировать определенные вещества. Они живут только на полной питательной среде, содержащей все нужные для них метаболиты. Для учета биохимических изменений (мутаций) используется метод «отпечатков» и метод «селективных сред». Первый сводится к тому, что на чашку Петри с полной питательной средой высевается исследуемый штамм микроорганизмов и после роста колоний делается отпечаток их на чашки Петри (с минимальной и полной питательной средой) с помощью кусочка бархата, натянутого на диск, одинаковый по диаметру с чашкой. Затем сравнивают колонии, появившиеся на обеих чашках, и отмечают те, которые не дали роста на минимальной среде. Это ауксотрофные мутанты, требующие дальнейшего анализа, чтобы выяснить, какие же вещества они потеряли способность синтезировать. Данный анализ проводится методом селективных сред, т. е. набора сред, содержащих не все метаболиты сразу, а один какой-нибудь (определенный витамин, аминокислоту, азотистое основание). В зависимости от того, на какой среде ауксотрофный мутант дает рост, можно определить присущий ему биохимический дефект.
Источник: |
24.репликация и репарация днк. Репликация ДНК Уотсон и Крик уже во второй своей работе 1953 года предположили возможный механизм копирования наследственного материала. Легко представить, что цепи молекулы ДНК расходятся и каждая из них становится матрицей, на которой синтезируется новая комплементарная цепь. В результате образуются две дочерние двуспиральные молекулы ДНК, неотличимые от родительской молекулы. Каждая молекула ДНК состоит из одной цепи исходной родительской молекулы и одной вновь синтезированной цепи. Такой механизм копирования называется полуконсервативным. В то же время обсуждались две другие модели, одна из них "консервативная" другая "дисперсионная" (Рисунок). Доказали существование полуконсервативной модели М. Мезелсон и Ф. Сталь в 1958 году. Авторы выращивали бактерии Е. coli несколько поколений на минимальной среде, в которой единственным источником азота был 15NH4C1 (хлорид аммония). В этом соединении нормальный изотоп 14N, был заменен на 15N. В результате все клеточные компоненты бактерий, включая пурины и пиримидины в молекулах ДНК содержали более тяжелый азот 15N. Затем клетки переносили на среду, содержащую изотоп 14N. Через 1 или 2 поколения выделяли ДНК и центрифугировали в градиенте CsCl. Фракции, содержащие легкие или тяжелые цепи, а так же гибридные 15N/14N, легко отделялись одна от другой. В 1957 году Артур Корнберг (в 1959 году Артуру Корнбергу (Arthur Kornberg) была присуждена Нобелевская премия за открытие механизма биосинтеза ДНК) обнаружил у бактерии Е. coli фермент, катализирующий процесс полимеризации ДНК из нуклеотидов – ДНК-полимеразу. Открытие Корнберга показало, что в основе удвоения молекул ДНК лежат обычные биохимические реакции. По современным представлениям в репликации ДНК у прокариот выделяют следующие этапы: 1. Релаксация суперспирализованной ДНК. Этот процесс катализируется ферментом топоизомеразой. 2. Денатурация двойной спирали ДНК. Поскольку синтез ДНК происходит на одноцепочечной матрице, ему должно предшествовать обязательное разделение двух цепей ДНК. Участок начала расхождения цепей называется репликационной вилкой из-за характерной Y-образной формы. Именно в этой репликационной вилке ДНК-полимеразы синтезируют дочерние молекулы ДНК. Модели репликации ДНК: а - полуконсервативная, б - консервативная, в - дисперсионная. Родительские цепи изображены в виде красных лент, вновь синтезированные показаны синим цветом. Участок ДНК, в котором репликация уже завершилась, выглядит как пузырек или "глазок" в нереплицированной ДНК. Репликационные глазки образуются в тех местах, где находятся специфические последовательности – точки начала репликации (origin of replication). Они состоят примерно из 300 нуклеотидов. С ориджина ими связываются инициаторные белки репликации. Для того, чтобы цепи ДНК разъединились, функционирует особый фермент – ДНК-хеликаза, который связывается с инициаторными белками. Этот фермент движется по одиночной цепи ДНК и, встречая участок двойной спирали, он разрывает водородные связи между основаниями, разделяет цепи и продвигает репликационную вилку. Субстратом для ДНК-полимеразы являются дезоксирибонуклеозид-трифосфаты (дНТФ), полимеризующиеся на одноцепочечной матрице. ДНК-полимеразы последовательно наращивают одну нить ДНК, шаг за шагом присоединяя к ней следующие звенья в направлении от 5' к 3' концу. В клетках присутствуют несколько разных типов ДНКполимераз, выполняющих различные функции и имеющих разное строение: они могут быть построены из различного количества белковых цепей (субъединиц), от одной до десятков. Однако, все они работают на любых последовательностях нуклеотидов матрицы; задача этих ферментов - сделать точную копию каждой матрицы. Генетический материал живых организмов имеет огромные размеры и реплицируется с высокой точностью. В среднем, в процессе воспроизведения генома млекопитающего, состоящего из ДНК длиной 3 млрд. пар нуклеотидов, возникает не более трех ошибок. При этом ДНК синтезируется чрезвычайно быстро (скорость ее полимеризации колеблется в пределах от 500 нуклеотидов в секунду у бактерий до 50 нуклеотидов в секунду у млекопитающих). Высокая точность репликации, наряду с ее высокой скоростью, обеспечивается наличием специальных механизмов, осуществляющих коррекцию, т.е. устраняющих ошибки. Суть механизма коррекции заключается в том, что ДНК-полимеразы дважды проверяют соответствие каждого нуклеотида матрице: один раз перед включением его в состав растущей цепи, второй раз перед тем, как включить следующий нуклеотид. Очередная фосфодиэфирная связь синтезируется лишь в том случае, если последний нуклеотид растущей цепи ДНК образовал правильную уотсон-криковскую пару с соответствующим нуклеотидом матрицы. Строение репликационной вилки ДНК-полимеразы не могут начинать синтез ДНК на матрице, а способны только добавлять новые дезоксирибонуклеотидные звенья к 3'-концу уже имеющейся полинуклеотидной цепи. Такую заранее образованную цепь, к которой добавляются нуклеотиды, называют затравкой (или праймером). Короткую РНК-затравку синтезирует из рибонуклеозидтрифосфатов фермент, не обладающий корректирующей активностью и называемый ДНК-праймазой. Праймазная активность может принадлежать либо отдельному ферменту, либо одной из субьединиц ДНК-полимеразы. Установлено, что дочерние цепи ДНК растут только в направлении 5'→3', т.е. всегда удлиняется 3'-конец затравки, а матрица считывается ДНК-полимеразой в направлении 3'→ 5'. Синтез ДНК происходит непрерывно только на одной из матричных цепей. На второй цепи ДНК синтезируется сравнительно короткими фрагментами - от 100 до 1000 нуклеотидов, названными "фрагментами Оказаки" по имени открывшего их ученого - Тунеко Оказаки. С одиночными цепями ДНК связываются специальные белки, дестабилизирующие спираль (SSB -single strand binding proteins). Они не позволяют им сомкнуться. Для того, чтобы репликационная вилка могла продвигаться вперед, вся еще не удвоенная часть ДНК должна была бы очень быстро вращаться. Белки ДНК-топоизомеразы вносят одноцепочечные или двуцепочечные разрывы, позволяющие цепям ДНК разделиться, а затем заделывают эти разрывы. На рисунке ниже показано расположение цепей и молекул ферментов во время репликации. Спираль расплетается ДНК-хеликазой; этому процессу помогаютДНК-топоизомераза, раскручивающая цепи ДНК, и множество молекулдестабилизирующего белка (SSB), связывающихся с обеими одиночнымицепями ДНК. В области вилки действуют две ДНК-полимеразы - наведущей и отстающей цепи. На ведущей цепи ДНК-полимеразаработает непрерывно, а на отстающей фермент время от времени прерываети вновь возобновляет свою работу, используя короткие РНК-затравки,синтезируемые ДНК-праймазой. Расположение основных белков в репликационной вилке Молекула ДНК-праймазы непосредственно связана с ДНК-хеликазой, образуя структуру, называемую праймосомой. Праймосома движется в направлении раскрывания репликационной вилки и по ходу движения синтезирует РНК-затравку для фрагментов Оказаки. В этом же направлении движется ДНК-полимераза ведущей цепи и ДНК-полимераза отстающей цепи. Для этого, как полагают, последняя накладывает цепь ДНК, которая служит ей матрицей, саму на себя, что и обеспечивает разворот ДНК-полимеразы отстающей цепи на 180 градусов. Согласованное движение двух молекул ДНК-полимераз обеспечивает координированную репликацию обеих нитей. Всего в репликационной вилке одновременно работает около двадцати разных белков. Процесс репликации хромосомы бактерий начинается в точке начала репликации и продолжается до тех пор, пока не удвоится вся ДНК хромосомы. Молекулярно-биологические процессы, происходящие во времярепликации ДНК, в основном похожи у эукариот и прокариот. Еслибактериальная хромосома представляет собой единицу репликации – репликон,то репликация ДНК эукариотической хромосомы осуществляется посредством разделения ее на множество отдельных репликонов. Полагают, что у эукариот гомологами ориджинов начала репликации являются автономно реплицирующиеся последовательности или ARS (autonomously replicating sequences). По эукариотической хромосоме в каждый момент времени может двигаться независимо друг от друга множество репликационных вилок. Остановка продвижения вилки происходит только при столкновении с другой вилкой, движущейся во встречном направлении, или по достижении конца хромосомы. В результате вся ДНК хромосомы в короткий срок оказывается реплицированной. Репликоны у эукариот имеют существенно меньшие размеры, чем у прокариот (хотя в пределах генома одного вида они могут варьировать в размерах в 10 раз). Скорость репликации существенно ниже у эукариот. 4. Репарация ДНК В любой клетке под влиянием различных факторов в ДНК ежедневно происходят тысячи случайных изменений, а за год в каждой клетке накапливается лишь очень небольшое число стабильных изменений нуклеотидной последовательности ДНК. Среди множественных случайных замен оснований в ДНК лишь одна на тысячу приводит к возникновению мутации. Все остальные повреждения очень эффективно ликвидируются в процессе репарации ДНК. Механизм репарации («залечивание» повреждений ДНК) основан на том, что молекула ДНК имеет две копии генетической информации – по одной в каждой из нитей молекулы. Основной путь репарации включает три этапа: - измененный участок поврежденной цепи ДНК распознается и удаляется с помощью ДНК-репарирующих нуклеаз. В спирали ДНК в этом месте возникает брешь; - ДНК-полимераза и гликозилазы заполняют эту брешь, присоединяя нуклеотиды один за другим, копируя информацию с целостной нити; - ДНК-лигаза «сшивает» разрывы и завершает восстановление молекулы. Нарушение репарации у людей, пораженных пигментной ксеродермой (повышенная чувствительность к солнечному свету), приводит к раку кожи. Активность УФ-эндонуклеазы, необходимая для репарации, при этом отсутствует. Если подавляются репарационные системы, то мутагенез усиливается.
Источник: |
30.транскрипция и ее этапы.особ-ти и-рнк про- и эукариот. Транскрипция Передача информации от ДНК осуществляется посредством информационной или матричной рибонуклеиновой кислоты (мРНК). Синтез мРНК называется транскрипцией. Молекула мРНК, комплементарная одной из цепей матричной ДНК, образуется в ходе сополимеризации четырех рибонуклеозидтрифосфатов (аденин-, гуанозин-, цитозин- и урацилтрифосфата) с образованием 3-5-фосфодиэфирных связей и освобождением неорганического пирофосфата. Транскрипцию осуществляет фермент ДНК-зависимая РНК-полимераза. Синтез мРНК молекулами РНК-полимеразы начинается в определенных местах ДНК, называемых промоторами, и завершается на особых нуклеотидных последовательностях – терминаторах. Совокупность нуклеотидов ДНК, заключенных между промотором и терминатором, называют транскрипционной единицей или транскриптоном. Процесс транскрипции подразделяют на 4 стадии: связывание РНК-полимеразы с ДНК и распознавание промотора, инициация, элонгация и терминация. Предполагается, что после первоначального непрочного связывания с ДНК в случайном месте молекула РНК-полимеразы перемещается вдоль двойной спирали ДНК до тех пор, пока не обнаружит последовательность нуклеотидов промотора. В этом месте связывание молекулы фермента с ДНК становится более прочным. Инициация транскрипции начинается с образования на промоторе предъиниционного комплекса, состоящего из РНК-полимеразы и матричной ДНК. После сборки предъинициационный комплекс претерпевает температурно-зависимые конформационные изменения, которые сопровождаются локальным плавлением, то есть расплетением двойной спирали ДНК, и комплекс становится способным к транскрипции. При наличии рибонуклеозидтрифосфатов происходит образование первых фосфодиэфирных связей в молекуле синтезируемой мРНК, после чего начинается стадия элонгации, то есть последовательное удлинение синтезируемой молекулы мРНК. В 1992 г. М. Чэмберлен с сотрудниками разработали общую модель элонгации мРНК, согласно которой перемещение РНК-полимеразы вдоль ДНК и присоединение нуклеотидов к растущей цепи мРНК в активном центре фермента разделены во времени. Это разделение возможно потому, что у РНК-полимеразы имеется два сайта (участка), удерживающих растущую цепь мРНК, и два участка связывания ДНК-матрицы. Молекула РНК-полимеразы перемещается вдоль ДНК подобно гусенице: когда один сайт связывания ДНК фиксирован, другой перемещается вперед. ДНК-зависимые РНК-полимеразы фагов, состоящие из одной субъединицы, синтезируют РНК в условиях in vitro со скоростью 200-400 нуклеотидов в секунду. При перемещении фермента вдоль матрицы цепи ДНК подвергаются плавлению и повторному отжигу, в результате которого восстанавливается исходная структура ДНК. Стадия элонгации заканчивается после достижения РНК-полимеразой терминатора транскрипции. Затем синтезированная РНК и РНК-полимераза освобождаются из транскрипционного комплекса. Только минус-цепь ДНК служит матрицей для синтеза мРНК. Участки ДНК, несущие информацию о строении белка – экзоны, разделены неинформативными интронами. В процессе транскрипции считывается информация как с экзонов, так и с интронов. Образуется предшественник мРНК - про-мРНК. Молекулы про-мРНК претерпевают созревание – процессинг. В ядре из про-мРНК происходит вырезание интронов и объединение экзонов – сплайсинг. После этого мРНК соединяется с белком, образуя инфорсому. Она выходит через поры в ядерной оболочке в цитоплазму. мРНК высвобождается из инфорсомы и одноцепочечная неспирализованная молекула мРНК присоединяется к участку малой субъединицы рибосомы, который примыкает к большой субъединице. К рибосоме прикрепляется небольшой участок цепи мРНК, содержащий один кодон, состоящий из трех азотистых оснований. Один кодон соответствует одной аминокислоте.
Источник: |
|
32.трансляция.особ у про и эукариот. Трансляция Трансляция (перевод) – процесс воплощения генетической информации мРНК в структуру полипептида. Это второй этап белкового синтеза, осуществляемый последовательной поликонденсацией отдельных аминокислотных остатков, начиная с аминоконца полипептидной цепи к карбоксильному концу. Зрелая матричная РНК выходит в цитоплазму, где осуществляется процесс транскрипции – декадирование мРНК в аминокислотную последовательность белка. Процесс декадирования осуществляется в направлении от 5`→3` и происходит в рибосомах. Комплекс мРНК и рибосом называется полисомой. Подобно транскрипции механизм трансляции состоит из трех этапов: инициации, элонгации и терминации. Трансляция начинается со стартового кодона АУГ, который при локализации в смысловой части структурного гена кодирует аминокислоту метионин. Каждую аминокислоту доставляет к полисоме транспортная РНК (тРНК), специфичная к данной аминокислоте. тРНК выполняет роль посредника между кодоном мРНК и аминокислотой. Молекулы тРНК узнают в цитоплазме соответствующий триплет (кодон в мРНК) по принципу спаривания комплементарных азотистых оснований. тРНК, которая подходит к малой субчастице, образует связь кодон-антикодон, при этом одновременно передает свою аминокислоту в аминоацильный участок (А-участок) большой субъединице. К кодону АУГ «подходит» антикодон только той тРНК, которая переносит метионин. Поэтому прежде всего к рибосоме доставляется метионин. Затем кодон АУГ переходит на пептидильный участок большой субъединицы (Р-участок). В результате этих процессов образуется транслирующая рибосома – инициирующий комплекс. Элонгация – это последовательное включение аминокислотных остатков в состав растущей полипептидной цепи. Каждый акт элонгации состоит из трех этапов: - узнавание кодона, которое заключается в связывании антикодона с очередной молекулой тРНК, несущей аминокислоту, с кодоном свободного А-участка на рибосоме; - образование пептидной связи, которое происходит лишь тогда, когда оба участка А и Р заняты молекулами тРНК. Часть большой субъединицы рибосомы – фермент пептидилтрансферазу, катализирующий образование пептидной связи; - транслокация, где тРНК участка Р, не связанная с пептидом, покидает рибосому. Затем молекула тРНК с полипептидом переходят из А на Р-участок и, наконец, рибосома перемещается вдоль РНК на один кодон. Терминация (окончание синтеза) происходит по команде кодонов УАА, УАГ, УГА. В природе не существует таких молекул тРНК, антикодоны которых соответствовали бы этим кодонам. Каждая мРНК транслируется, как правило, несколько раз, после чего разрушается. Среднее время жизни молекулы мРНК около 2 мин. Разрушая старые и образуя новые мРНК, клетка может довольно строго регулировать как тип продуцируемых белков, так и их количество. Это регуляция синтеза белка на уровне транскрипции. У эукариот возможна регуляция и на уровне трансляции. Синтез белка – один из существеннейших показателей жизни.
Источник: |
33.центральная догма молек.биологии.типы переноса инф-ии. Современные представления о роли ДНК в передаче наследственной информации лучше всего отражает "Центральная догма молекулярной биологии", сформулированная Ф. Криком в 1970 году. Автор предложил разделить все виды переноса биологической информации в клетке на три группы: 1. Процессы, существование которых уже показано: ДНК → ДНК, ДНК → РНК, РНК → белок, РНК → РНК. 2. Процессы, которые не были экспериментально выявлены и с теоретической точки зрения не казались строго необходимыми: РНК → ДНК, ДНК → белок. 3. Невозможные переносы: белок → белок, белок → РНК, белок → ДНК. Таким образом, информация во всех случаях в клетке переносится однонаправленно по цепи: ДНК →РНК → белок. Белок не может служит матрицей для синтеза ДНК или РНК, поскольку у молекул белка нет свойства комплементарности отдельных частей молекулы, что бы позволяло использовать её как матрицу. "Центральная догма молекулярной биологии". Сплошные стрелки показывают обычный путь переноса генетической информации, пунктирной - более редкие пути, также существующие в природе Синтез одной молекулы белка, состоящего из 150 аминокислот, идет примерно за 1,5 минуты, т. е. со скоростью 2 аминокислоты в секунду. Он зависит от многих факторов. Например, состояние рибосомы может оказать влияние на считывание информации. Рибосома «читает с ошибками», если на нее воздействовать какими-либо внешними факторами, к примеру облучением, химическими веществами, способными изменять структуру и функцию рибосомы. Однако если переносы типа ДНК→ДНК, ДНК→РНК, РНК→РНК и РНК→белок имели экспериментальные прямые или непрямые доказательства, то в пользу других переносов доводов и теоретических обоснований в то время не было. Изучение механизмов взаимодействия с клеткой опухолеродных вирусов натолкнуло на мысль о возможности существования иных типов связей. В 1969-1971 гг. Р. Дульбеко экспериментально доказал, что ДНК опухолеродного вируса прочно связывается с ДНК клетки, находя в ее хромосомах тайное убежище. Но опухолеродные вирусы делятся на две большие группы: ДНК-содержащие и РНК-содержащие. Включение вирусной ДНК в ДНК клетки и их интеграцию представить легко. Но как применить эту гипотезу к РНК-содержащим вирусам? В 60-х годах Г. Темин высказал предположение, согласно которому «жизненный цикл» РНК-содержащих опухолеродных вирусов должен включать стадию образования ДНК-продукта — провируса. Это явно противоречило центральной догме молекулярной биологии, гласившей, что генетическая информация передается только в одном направлении: ДНК→РНК→белок. Если допустить, что существует и путь РНК→ДНК, то в клетке должен быть и специальный фермент, участвующий в синтезе такого рода. В 1970 г. Г. Темин и С. Мизутани обнаружили в составе вируса саркомы Рауса (РНК-содержащий вирус) фермент, способный синтезировать ДНК на матрице РНК. Этот фермент назвали обратной транскриптазой или РНК-зависимой ДНК-полимеразой (ревертазой, по В. А. Энгельгардту). Одновременно Д. Балтимор обнаружил фермент, синтезирующий ДНК, у вируса миелобластоза птиц. Ревертаза в настоящее время найдена во всех без исключения РНК-содержащих опухолеродных вирусах. В 1975 г. Р. Дульбеко, Г. Темину и Д. Балтимору была присуждена Нобелевская премия за открытие процесса передачи наследственной информации, который получил название обратной транскрипции. Формула центральной догмы молекулярной биологии дополнилась: ДНК ← → РНК → белок Процесс обратной транскрипции состоит из двух этапов. Сначала на РНК-матрице синтезируется нить ДНК, т. е. образуется промежуточный продукт реакции, состоящий из гибридных молекул, одна нить которых — вирусная РНК, другая — комплементарная ей синтезированная нить ДНК. На ДНК-вой нити гибридной молекулы синтезируется вторая нить ДНК и получается конечный продукт реакции — двухцепочечная спиральная молекула ДНК, содержащая генетическую информацию, полностью переписанную с вирусной РНК. Оба этапа осуществляются, по-видимому, одним и тем же вирусным ферментом, точнее, его активным центром, т. е. ревертаза обладает и РНК-зависимой и ДНК-зависимой ДНК-полимеразной активностью и ведет всю реакцию от начала до конца. Открытие ревертазы натолкнуло на мысль, что путем выявления ее в клетках можно осуществлять раннюю и быструю диагностику злокачественных опухолей и лейкозов. Однако вскоре обнаружилось, что ревертазы свойственны и тканям здоровых, не зараженных вирусами организмов. Особенно много их оказалось в эмбриональных клетках. Тем не менее существуют количественные различия ревертаз в опухолевых и нормальных клетках, за исключением эмбриональных. Установлены также различия в активности и физико-химических свойствах ревертаз онкогенных вирусов и нормальных клеток. Несомненно, обратная транскрипция нужна для злокачественной трансформации. Наличие ревертазы во всех нормальных клетках свидетельствует о возможности передачи информации от РНК к ДНК. Но с какой целью? Отмечено, что на определенной стадии эмбриогенеза в клетках амфибий резко возрастает число генов, кодирующих рибосомальную РНК. Вместо двух копий (2 гомологичные хромосомы) в клетках обнаруживается по несколько сотен копий каждого гена, которые определенный период эмбриогенеза функционируют изолированно от хромосомы, а затем разрушаются. В 1971 г. Тартоф открыл такое же явление и у дрозофилы. Оно было названо амплификацией генов. Механизм амплификации не известен. Однако установлено, что в условиях повышенного требования синтеза белка в клетке происходит размножение генов рибосомальной РНК методом обратной транскрипции. Это обеспечивает синтез РНК не на хромосомной матрице, а на матрице генов, образующихся в цитоплазме. Очевидно, амплификация генов играет существенную роль в регуляции феногенетических процессов и происходит всегда, когда требуется увеличить количество белка.
Источник: |
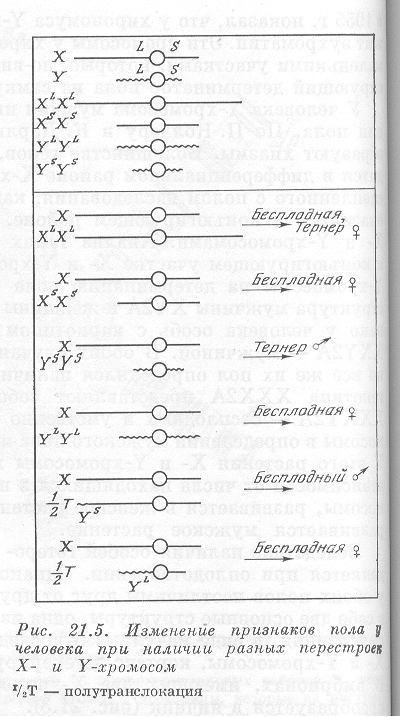
11.теории пола:хромосомная.балансовая. Физиол-я. . Теории определения пола. Пол у большинства животных и растений определяется генетически в момент оплодотворения. При исследовании кариотипов многих животных было установлено, что у женского организма каждая хромосома имеет парную (идентичную по размерам, морфологии и содержанию генов), а у мужских организмов имеются две непарные хромосомы, которые резко отличаются по величине, морфологии и заключенной в них генетической информации. При дальнейшем исследовании было показано, что эти непарные хромосомы и определяют пол организма. Их назвали половыми, или гетерохромосомами, в отличие от остальных - аутосом. Большую из непарных хромосом, одинаковую у мужского и женского организмов, назвали Х-хромосомой, а меньшую, имеющуюся только у мужских организмов, — У-хромосомой. 3.1. Хромосомная теория пола К. Корренса (1907). Суть ее заключается в том, что пол будущего потомка определяется сочетанием половых хромосом в момент оплодотворения. Пол, имеющий одинаковые половые хромосомы, называют гамогаметным, так как он дает один тип гамет, а имеющий тип гамет, а имеющий разные — гетерогаметным, так как он образует два типа гамет. У человека, всех млекопитающих, мухи дрозофилы гомогаметный пол женский, а гетерогаметный- мужской. Мужской и женский пол различаются наличием особой пары половых хромосом. Пара половых хромосом гомогаметного пола состоит из двух одинаковых хромосом в виде ХХ. В некоторых крайних случаях гетерогаметный пол совершенно теряет второй компонент пары половых хромосом в виде Y-хромосомы. В этих случаях половые хромосомы представлены одной хромосомой (тип ХО). Гетерогаметным полом у различных форм бывает разный пол. У человека, дрозофилы и других форм гетерогаметен мужской пол, который обладает XY-хромесомами. У клопа Protenor гетерогаметность мужского пола связана с наличием одной Х-хромосомы (тип ХО). У птиц, бабочек и у ряда других видов гетерогаметен женский пол типа XY. У некоторых бабочек гетерогаметен женский пел, имеет тип XO. Во всех этих случаях наследование пола определяется хромосомной конституцией образующихся гамет и дает в каждом поколении отношение самок к самцам по формуле 1:1 (табл).
Балансовая теория пола К. Бриджеса При изучении наследования пола у мухи дрозофилы было установлено, что самцы могут иметь разные наборы половых хромосом XY и ХО (последние имеют все признаки мужского пола, но стерильные, так как в Y-хромосоме содержатся гены, необходимые для нормального течения сперматогенеза). Из этого был сделан вывод, что Y-хромосома у мухи дрозофилы не имеет существенного значения для определения мужского пола. Затем были получены особи с разнообразными сочетаниями числа Х-хромосом и наборов аутосом (А) и изучен их пол: 2Х: 2А — нормальные самки; 1Х: 2А — нормальные самцы; ЗХ: 2А — сверхсамки; гипертрофированы признаки женского пола, бесплодны; 1Х: ЗА — сверхсамцы; гипертрофированы признаки мужского пола, бесплодны; 2X: ЗА — интерсексы; имеют признаки обоих полов, бесплодны. Пол в данном случае определяется не половыми хромосомами, а отношением (балансом) числа Х-хромосом и количества наборов аутосом. Если это отношение 1: 1— развиваются нормальные самки, если отношение 1: 2— развиваются нормальные самцы. Чем больше в кариотипе Х-хромосом, тем более выражены признаки женского пола; чем больше наборов аутосом, тем резче проявляются признаки мужского пола. При отношении 1: 1,5 (2Х: ЗА) развиваются признаки обоих полов.
При нарушении течения митоза могут образовываться особи — гинандроморфы. Содержание половых хромосом в разных клетках таких особей разное (мозаичность). Например, у мухи дрозофилы в одних клетках содержатся две Х-хромосомы, а в других — ХО, в связи с чем разные части тела могут иметь соответствующие признаки пола. У человека могут быть разные случаи мозаицизма: ХХ/ХХХ, XY/XXY, ХО/ХХХ, ХО/XXY и др. Если процент мозаичных клеток велик, возможны морфо-физиологические проявления.
|
|
39.ненасл.изменчивость.сезонная.зкологич. Онтогенетич.морфозы и фенокопии. Наследственность и изменчивость являются важнейшими факторами эволюции всего живого на Земле. Под наследственностью понимают свойство организмов обеспечивать материальную и функциональную преемственность в ряду поколений, а также определять уникальный характер индивидуального развития в специфических условиях среды. Явления наследственности и изменчивости лежат в основе всех жизненных проявлений. Наследственность обеспечивает сходство морфологических характеристик, механизмов развития и жизнедеятельности, а структурно-функциональное разнообразие особей любого вида зависит от другого фундаментального свойства живых организмов — изменчивости. Под изменчивостью понимают свойство живых организмов приобретать в процессе индивидуального развития (онтогенеза) новые морфо-функциональные признаки и особенности, отличающиеся от родительских. Различают два вида изменчивости: наследственную и ненаследственную. Первая имеет отношение к изменениям в наследственном материале, вторая – является результатом реагирования организма на условия окружающей среды. Наследственную изменчивость подразделяют на мутационную и комбинативную. Первопричиной мутационной изменчивости являются мутации. Их можно определить как наследуемые изменения генетического материала. Изменчивость, вызываемая расщеплением и перекомбинацией мутаций, и обусловленная тем, что гены существуют в разных аллельных состояниях, называется комбинативной. С эволюционной точки зрения различают два вида биологической изменчивости: групповую изменчивость, под которой понимают различия между популяциями, этносами или расами, и индивидуальную изменчивость, т.е. различия между особями одной популяции. Примерами групповой изменчивости могут служить различия в окраске кожных покровов у африканцев и европейцев, характер оволошения и структуры волос, разрез глаз и многие другие признаки, различающие представителей различных рас. Индивидуальная изменчивость гораздо шире групповой. Она включает все различия между конкретными индивидами по характеру, темпераменту, цвету глаз, наличию определенной группы крови, особенностям внешнего облика, росту, телосложению и т.д. Процессы, определяющие изменчивость, неоднородны. Одни из них могут проявляться только в виде вариации признаков, т. е. только как изменение признака; другие затрагивают генетический аппарат. Соответственно этому выделяют фенотипическую (ненаследственную) и генотипическую (наследственную) изменчивость. 1.2 Ненаследственная изменчивость При фенотипической изменчивости наследственный материал в изменения не вовлекается. Они касаются только признаков индивида и происходят под действием факторов внешней и внутренней среды. Подобные изменения не передаются по наследству, даже если они обусловлены постоянным воздействием на протяжении исторически длительного времени. Например, у некоторых народов известны ритуалы, связанные с нанесением специфических повреждений: протыкание носовой перегородки или губ, удаление зубов (клыков), уродование ступней или костей черепа. Подобные изменения, как известно, не наследуются. Если изменения признака являются реакцией на действие определенного фактора и по выраженности не выходят за пределы нормы реакции, то такие изменения называют модификационными. Наиболее четко модификационная изменчивость проявляется как реакция организма на изменения факторов среды: например, географических условий проживания, интенсивности солнечной радиации, характера питания и т.д. Модификационная изменчивость имеет адаптивное (приспособительное) значение. В тех случаях, когда изменения появляются в результате действия большого количества факторов, их называют случайными. Одним из проявлений модификационной изменчивости является феномен фенокопирования. Термин «фенокопия» был предложен для обозначения признаков, болезней или пороков развития, возникающих под воздействием определенных условий среды, но фенотипически (клинически) похожих на такие же состояния, обусловленные генетическими факторами мутациями. Таким образом, фенокопия — это признак, развивающийся под действием средовых факторов, но лишь копирующий наследственно обусловленный признак. Окраска кожных покровов африканцев характеризуется выраженной пигментацией, даже если человек не подвергается воздействию солнечных лучей. Кожа европейцев, как правило, пигментирована лишь в слабой степени, но становится смуглой под действием солнечного света. Таким образом, загорелые, но наследственно светлокожие индивиды представляют собой как бы «копии» генетически темнокожих людей. Известно большое число клинических примеров, иллюстрирующих ситуации, когда определенный фенотип может являться продуктом конкретного генотипа, а может быть фенокопией, т.е. развиваться под действием факторов среды. Например, слепота, обусловленная помутнением хрусталика глаза (катаракта), может быть вызвана механическими повреждениями, или действием ионизирующего излучения, или в результате внутриутробного поражения вирусом краснухи. Но развитие катаракты может вызвать специфический ген без какого-либо дополнительного внешнего воздействия на организм. Слабоумие может быть обусловлено специфическим генотипом (например, генной или геномной мутацией), но может развиться при отсутствии йода в рационе ребенка или в результате повреждающего воздействия цитомегаловирусной инфекции на мозг плода во время внутриутробного развития.
Источник: |
42.комбинативная изм-ть.ее эволюц. Роль. Наследственная изменчивость Сформировавшиеся новые признаки могут служить основой для эволюции вида при условии их наследования. Если бы все члены вида были идентичны по какому-либо признаку, то отбор отсутствовал, поскольку не было бы точки приложения его действия. Явление изменчивости, таким образом, обеспечивает возможность естественного отбора. Однако для эволюции требуется не просто изменчивость, а наследуемая изменчивость, для того чтобы имелась возможность распространить полезные или удалить вредные для вида возникшие изменения. При этом для эволюционных преобразований генетической структуры вида самым важным является то, что различающиеся по генетической конституции особи оставляют различное число потомков. Этим определяется основной механизм эволюции. Генотипическая изменчивость в зависимости от природы клеток подразделяется на генеративную (изменения в наследственном аппарате гамет) и соматическую (изменения в наследственном аппарате клеток тела). В рамках генеративной и соматической изменчивости выделяют 1) комбинативную и 2) мутационную изменчивость. Комбинативная изменчивость возникает в генотипах потомков вследствие случайной перекомбинации аллелей. Сами гены при этом не изменяются, но генотипы родителей и детей различны. Комбинативная изменчивость возникает в результате нескольких процессов: а) независимого расхождения хромосом в процессе мейоза; б) рекомбинации генов при кроссинговере; в) случайной встречи гамет при оплодотворении. Комбинативная изменчивость является главным источником наблюдаемого генетического разнообразия. Известно, что в геноме; человека содержится примерно 30-40 тыс. генов. Около трети всех генов имеют более чем один аллель, т. е. являются полиморфными, Однако даже при наличии лишь небольшого числа локусов, содержащих по нескольку аллелей, только при рекомбинации (вследствие перемешивания генных комплексов) возникает колоссальное множество уникальных генотипов. Так, только при 10 генах, содержащих по 4 аллеля каждый, теоретическое число уникальных диплоидных генотипов составляет 10 миллиардов! Поскольку около одной трети генов в геноме человека являются полиморфными, то только за счет рекомбинации создается неисчерпаемое генетическое разнообразие человека. В свою очередь неповторимость генетической конституции во многом определяет уникальность и неповторимость каждого человека. Мутационная изменчивость обусловлена мутациями (от лат. mutatio — изменение, перемена) — устойчивым изменением генетического материала и, как следствие, наследуемого признака. Переходных форм изменчивости по сравнению с исходным состоянием не наблюдается.
Источник: |
46.спонтанный мутагенез. Иногда выделяют категорию системных мутаций. В 1940 г. Р. Гольдшмидт предложил называть так структурные перестройки хромосом, связанные с радикальными изменениями во всей системе клеточных реакций. При системных мутациях не изменяется ни генный состав, ни линейнаяструктура хромосом, ни число хромосом. Системные мутации возникают в результате пространственной реорганизации интерфазных хромосом в ядре за счет изменения хромосомно-мембранных взаимоотношений. В любой популяции живых организмов, живущих на Земле, всегда есть особи, несущие мутации. Многие годы до открытия возможности искуственной индукции мутаций селекционеры и исследователи наследственности, включая Менделя и Моргана, использовали мутации этого типа. Их называют спонтанными. Начиная с 1925 года С.С. Четвериков и его молодые коллеги Б.Л. Астауров, Н.К. Беляев, С.М. Гершензон, П.Ф. Рокицкий, Д.Д. Ромашов в результате экспериментальной проверки природных популяций дрозофилы нашли в них большое число различных мутаций. Каждый ген с той или иной частотой спонтанно переходит в мутантное состояние. Причины индукции спонтанных мутаций не ясны. Долгое время полагали, что к числу индуцирующих факторов относится естественный фон ионизирующих облучений, образуемый доходящими до поверхности земли космическими лучами, гамма излучениями Земли и радиоактивными веществами (К, 14С, Rn), поступающими в малых количествах в организм из окружающей среды. Однако, как показали расчеты, у дрозофилы естественый радиационный фон может быть ответствен только приблизительно за 0,1% спонтанных мутаций. Хотя, по мере увеличения продолжительности жизни организма воздействие естественного фона может накапливаться, и у человека от 1/4 до 1/10 спонтанных мутаций может быть отнесено за счет естественного фона радиации. Второй причиной спонтанных мутаций являются случайные повреждения хромосом и генов в ходе нормальных метаболических процессов, происходящих в клетке. По многочисленным данным спонтанные мутации возникают во время деления хромосом и репликации ДНК. Считают вероятным, что спонтанные мутации представляют чаще всего следствие случайных ошибок в функционировании молекулярных механизмов. Третьей причиной спонтанных мутаций является перемещение по геному мобильных элементов, которые могут внедриться в любой ген и вызвать в нем мутацию. По расчетам американского генетика Мелвина Грина около 80% спонтанных мутаций приходится на счет перемещений мобильных элементов.
Источник: |
|
50.генетич.стр-ра попул.самоопылителей. Генетическая структура популяции самоопылителей Генетическая структура популяции самоопыляющихся организмов (сем. злаковых — ячмень, пшеница; сем. бобовых) характеризуется известной степенью гомозиготности особей по ряду генов. Самоопыление, приводя к гомозиготации особей, вовсе не делает популяцию генетически однородной. При самоопылении особей, гетерозиготных по одной паре аллелей, например Аа, в ряду поколений будет постоянно уменьшаться число гетерозигот, по при этом выщепятся по крайней мере две генетически неодинаковые гомозиготные чистые линии: АА и аа. Если учесть, что гомозиготация идет не по одной, а по многим парам аллелей, легко предположить, сколько чистых линий с различной комбинацией гомозигот по каждой паре аллелей может образоваться в популяции. Например, гомозиготация по двум парам аллелей приведет к формированию четырех чистых линий: ААВВ, ААвв, ааВВ и аавв. Чистая линия представляет собой потомство одного гомозиготного организма. Особи в пределах чистой линии генетически однородны и имеют сходный фенотип — различия особей внутри чистой линии носят, как правило, модификационный характер (например, у злаков одного вида сходные по генотипу особи могут различаться по длине колоса, числу колосков в колосе, размеру и весу семян). Не исключается и возможность нарушения генетической чистоты линии за счет возникновения мутаций. Популяция самоопылителей состоит из чистых линий и потому генетически и фенотипически неоднородна. Фонд генетической изменчивости такой популяции составляют фенотипические и генотипические различия между чистыми линиями. Прекрасной иллюстрацией этого являются селекционные опыты (отбор по весу семян) в популяциях и чистых линиях фасоли, проведенные В. Иоганнсеном в 1903 г. Изменчивость по весу семян в исходной популяции фасоли выражалась вариационной кривой, где крайние значения веса семян составляли 150 и 750 мг. Иоганнсен провел отбор и в дальнейшем отдельно высевал семена с весом 250—350 мг и 550—650 мг. В потомстве средний вес семян был соответственно 443,4 и 518,7 мг. При дальнейшем отборе крупных и мелких семян в чистых линиях изменения среднего веса семян не наблюдалось ни в одном из последующих шести поколений. На основании полученных данных Иоганнсен сделал вывод, что изменчивость особей в пределах чистых линий ограничивается модификациями и потому отбор в них бесперспективен. Отбор действует лишь на популяцию, так как она представляет собой генетически неоднородный материал. Исследования Иоганнсена — хорошая теоретическая основа для селекции. Генетически грамотный селекционер не станет вести отбор по признаку у самоопылителей в пределах чистой линии, ибо он успехов не принесет. Таким образом, в популяции самоопылителей наблюдается тенденция к гомозиготации и распаду популяции на генетически однородные чистые линии. Однако в связи с тем, что наряду с самоопылением иногда возможно перекрестное опыление, а также вследствие постоянно возникающих мутаций в популяции всегда сохраняется известный уровень гетерозиготности по отдельным локусам. Это обусловливает определенную пластичность ее в процессе приспособления к среде обитания. Если же при гомозиготации в популяции происходит выщепление вредных мутаций, это нередко приводит к депрессии ее и даже вырождению.
Источник: |
|
|