
- •3. Основные понятия о реакционной способности органических молекул
- •1. Концепция теории мезомерии.
- •2. Концепция теории резонанса (Полинг, 1928 г.).
- •3. Делокализованное π-облако изображается пунктиром (в цикле – сплошной линией).
- •4. Классификация химических реакций и промежуточных частиц
- •Стабилизация интермедиатов.
- •Примеры построения названий по систематической номенклатуре
- •7. Кислотные и основные свойства органических соединений
- •Кислотные и основные функции веществ
- •Кислотность и основность по Бренстеду-Лоури.
- •Примеры.
- •Кислотность спиртов.
- •Сольватация аминов.
- •Кислоты и основания Льюиса.
- •Жесткие и мягкие кислоты и основания по Пирсону (жмко).
- •8. Углеводороды
- •8.1 Алканы
- •5. Воздействие анаэробных бактерий на растительные остатки:
- •6.1 Гидролиз карбидов:
- •7.1 Гидрирование алкенов:
- •7.2 Гидрирование алкадиенов:
- •7.3 Гидрирование алкинов:
- •1. Реакции замещения атомов водорода при взаимодействии с активными радикалами.
- •1.1.1 Фтор:
- •1.1.3 Бром:
5. Воздействие анаэробных бактерий на растительные остатки:
(С6Н10О5)n
+ H2O
![]() 3n
СO2
+ 3n
СН4
3n
СO2
+ 3n
СН4
Лабораторные методы:
6. Реакция металлорганических соединений с водой. Соединения, содержащие связь металл – углерод, в большинстве случаев легко реагируют с водой, образуя углеводороды.
6.1 Гидролиз карбидов:
Al4C3+12
H2O![]() 3
СН4
+ 4 Al(OH)3
3
СН4
+ 4 Al(OH)3
CaC2, SrC2 и BaC2 в реакции с водой образуют ацетилен, а Fe3C и Ni3C в реакции с кислотами образуют смеси углеводородов.
6.2 Гидролиз алкилмагнийгалогенидов (реактивов Гриньяра):
R–MgHal
+ H2O![]() R–H
+ Mg(OH)Hal
R–H
+ Mg(OH)Hal
R–Hal +
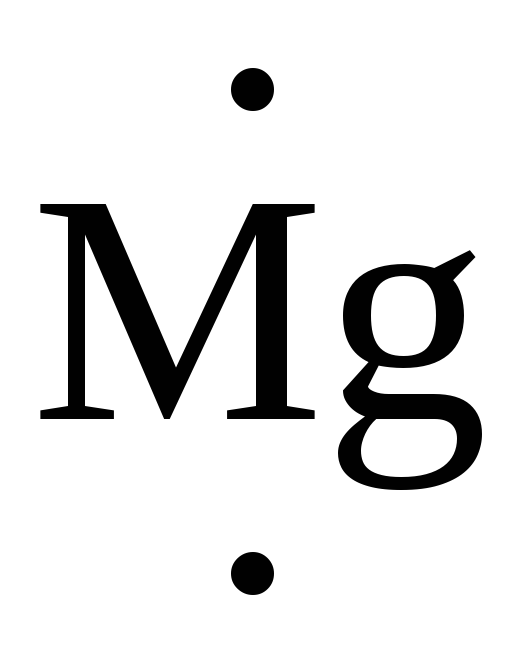
![]() Rδ––δ++MgHal–
Rδ––δ++MgHal–
![]() R–H + Mg(OH)Hal
R–H + Mg(OH)Hal
7. Гидрирование ненасыщенных углеводородов. Реакция присоединения водорода по кратным связям происходит при обычных температурах и давлении на катализаторе, в качестве которого используют металлы с недостроенным d-подуровнем, чаще всего это металлы VIII группы (никель, платина, палладий). Гидрирование осуществляют молекулярным водородом, который активируется катализатором и присоединяется к непредельному соединению:
7.1 Гидрирование алкенов:
R–CH=CH–R
+ Н2
![]() R–CH2–CH2–R
R–CH2–CH2–R
7.2 Гидрирование алкадиенов:
R–CH=CH–CH2–CH=CH–R
+ 2Н2
![]() R–CH2–CH2–CH2–CH2–CH2–R
R–CH2–CH2–CH2–CH2–CH2–R
7.3 Гидрирование алкинов:
R–C≡C–R
+ 2Н2
![]() R–CH2–CH2–R
R–CH2–CH2–R
8. Восстановление галогенпроизводных алканов. Восстановление проводят амальгамой натрия, гидридами металлов, водородом на палладии, а также йодистым водородом:
R–Hal +
H2
![]() R–H
+ HHal
R–H
+ HHal
R–I +
HI![]() R–H
+ I2
R–H
+ I2
9. Реакция Вюрца (Ш. Вюрц, 1855 г.):
2R–Hal +
2Na![]() R–R
+ 2NaHal
R–R
+ 2NaHal
3R–Hal +
3R1–Hal
+ 6Na![]() 2R–R
+ 2R1–R1
+ 2R–R1
+ 6NaHal
2R–R
+ 2R1–R1
+ 2R–R1
+ 6NaHal
Механизм реакции осуществляется с образованием ион – радикалов и алкильных радикалов:
2Rδ+–Halδ–
+ 2![]()
![]() 2[R
2[R![]() Hal]•–Na+
Hal]•–Na+![]() 2R•
+2Hal–
+ 2Na+
2R•
+2Hal–
+ 2Na+![]() R–R + 2NaHal
R–R + 2NaHal
R•
+![]()
![]() RNa
RNa![]() R–R
+ 2NaHal
R–R
+ 2NaHal
10. Реакция Вюрца – Гриньяра, катализатор – соли кобальта:
R–Hal +
R1–MgHal![]() R–R1
+ MgHal2
R–R1
+ MgHal2
11. Реакция Кори – Хауса:
R–I
+ 2Li![]() R–Li
+LiI
R–Li
+LiI
2 R–Li
+CuI
![]() R2CuLi
+ LiI
R2CuLi
+ LiI
R1–I
+ R2CuLi
![]() 2R1–
R + CuI + LiI
2R1–
R + CuI + LiI
12. Электролиз солей карбоновых кислот (реакция Кольбе, 1849 г.):
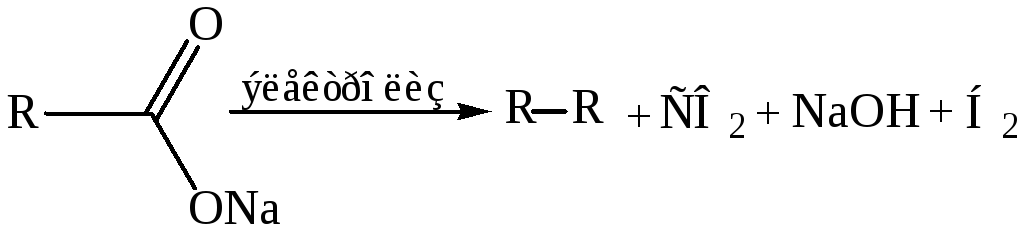
13. Декарбоксилирование солей карбоновых кислот (синтез Дюма):

14. Сплавление гидразонов альдегидов и кетонов со щелочью (реакция Киннера):
R–CH=N–NH2![]() R–CH–
H2
+ N2
R–CH–
H2
+ N2
15. Восстановление карбонильных соединений (метод Клемменсена):
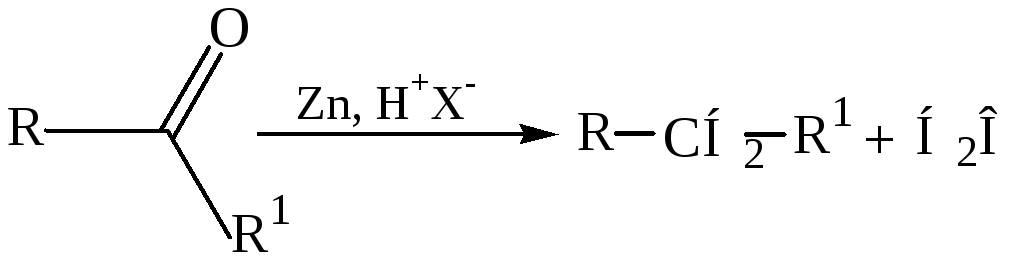
Физические свойства. Алканы представляют собой бесцветные вещества, в обычных условиях газообразные или жидкие, алканы с большим числом углеродных атомов являются твердыми веществами.
Газообразные и твердые алканы не имеют запаха, жидкие имеют характерный бензино-керосиновый запах.
Температура плавления нормальных углеводородов в гомологическом ряду увеличивается медленно. Главным фактором, влияющим на температуру плавления вещества, является плотность упаковки молекулы в кристаллической решетке. Чем симметричнее молекула, тем плотнее ее упаковка в кристалле и тем выше температура плавления (у н-пентана –132°С, у неопентана –20 °С).
Связи С–С и С– Н в молекулах алканов практически неполярны, и, следовательно, единственными силами, участвующими в притяжении молекул друг к другу, являются ван-дер-ваальсовы взаимодействия. В связи с этим алканы имеют низкие температуры кипения по сравнению со многими соединениями с близкой молекулярной массой.
Температура кипения у всех разветвленных алканов ниже, чем у нормальных алканов, и притом тем ниже, чем более разветвлена углеродная цепь молекулы (табл. 19).
Температура плавления оказывается самой высокой у изомеров с максимально разветвленной углеродной цепью. Эти закономерности объясняются следующими причинами:
превращению жидкости в газ препятствуют ван-дер-ваальсовы силы взаимодействия между атомами отдельных молекул. Поэтому чем больше атомов в молекуле, тем выше температура кипения вещества, следовательно, в гомологическом ряду температура кипения должна равномерно расти. Если сравнить силы взаимодействия молекул н-пентана и неопентана, то ясно, что эти силы больше для молекулы с нормальной цепью углеродных атомов, чем для разветвленных, так как в молекуле неопентана центральный атом вообще выключен из взаимодействия;
форма разветвленной молекулы стремится к сферической, при этом площадь поверхности соприкосновения уменьшается, что приводит к уменьшению взаимодействия и, следовательно, для преодоления слабых сил взаимодействия требуется меньшая энергия;
каждая дополнительная группа СН2 вносит довольно постоянный вклад в температуру кипения и плотность и несколько меньший вклад в температуру плавления (рис. 21).
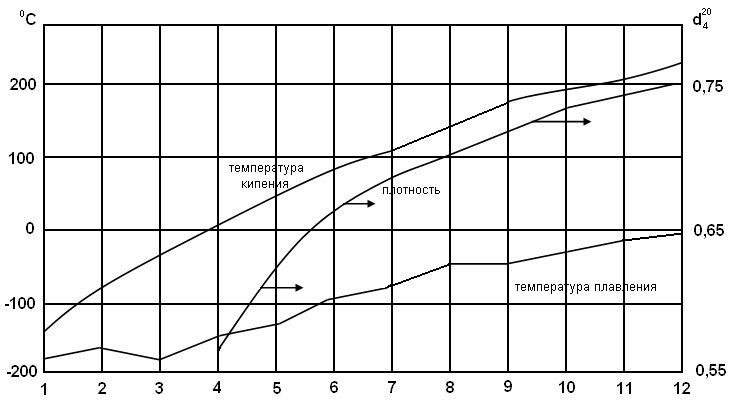
Рисунок 21 –
Зависимость температур плавления,
кипения и плотности,
![]() от
числа атомов углерода (n)
для алканов с неразветвленной цепью
от
числа атомов углерода (n)
для алканов с неразветвленной цепью
Таблица 19 – Физические свойства алканов
|
Соединение |
|
Формула |
Температура, °С |
Плотность,
| |
|
плавления |
кипения | ||||
|
метан |
16 |
СН4 |
–182,5 |
–161,5 |
0,415* |
|
этан |
30 |
СН3-СН3 |
–183,3 |
–88,6 |
0,546* |
|
пропан |
44 |
СН3СН2СН3 |
–187,7 |
–42,1 |
0,501* |
|
бутан |
58 |
СН3(СН2)2СН3 |
–138,3 |
–0,5 |
0,579* |
|
изобутан |
58 |
СН3СН(СН3)СН3 |
–159,6 |
–11,7 |
0,557* |
|
пентан |
72 |
СН3(СН2)3СН3 |
–129,7 |
36,1 |
0,626 |
|
изопентан |
72 |
СН3СН(СН3)СН2СН3 |
–159,9 |
27,9 |
0,620 |
|
гексан |
86 |
СН3(СН2)4СН3 |
–95,3 |
68,7 |
0,660 |
|
гептан |
100 |
СН3(СН2)5СН3 |
–90,6 |
96,4 |
0,684 |
|
октан |
114 |
СН3(СН2)6СН3 |
–56,8 |
125,1 |
0,702 |
|
изооктан |
114 |
СН3С(СН3)2СН2СН(СН3)2 |
–107,4 |
99,2 |
0,692 |
|
нонан |
128 |
СН3(СН2)7СН3 |
–53,5 |
150,8 |
0,718 |
|
декан |
142 |
СН3(СН2)8СН3 |
–29,7 |
174,1 |
0,730 |
|
пентадекан |
212 |
СН3(СН2)13СН3 |
9,9 |
270,6 |
0,768 |
|
эйкозан |
282 |
СН3(СН2)18СН3 |
36,8 |
342,7 |
0,789** |
|
триконтан |
422 |
СН3(СН2)28СН3 |
65,8 |
446,4 |
0,810** |
|
гектан |
1402 |
СН3(СН2)98 СН3 |
115,2 |
– |
– |
|
полиэтилен (ПЭВД) |
30 – 800 тыс. |
–(СН2)n– |
– |
– |
0,918-0,930 |
|
полиэтилен (ПЭНД) |
30 – 800 тыс. |
–(СН2)n– |
– |
– |
0,955-0,968 |
Алканы практически нерастворимы в воде, так как их молекулы малополярны и не взаимодействуют с молекулами воды. Алканы намного легче воды. Жидкие алканы легко смешиваются друг с другом. Они хорошо растворяются в неполярных органических растворителях, таких как бензол, тетрахлорметан (четыреххлористый углерод), диэтиловый эфир и др.
Химические свойства.
Предельные углеводороды являются наименее реакционно-способными органическими соединениями. Их часто называют парафинами (от лат. parum affinis – малое сродство).
