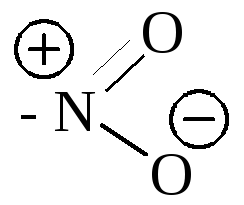
- •3. Основные понятия о реакционной способности органических молекул
- •1. Концепция теории мезомерии.
- •2. Концепция теории резонанса (Полинг, 1928 г.).
- •3. Делокализованное π-облако изображается пунктиром (в цикле – сплошной линией).
- •4. Классификация химических реакций и промежуточных частиц
- •Стабилизация интермедиатов.
- •Примеры построения названий по систематической номенклатуре
- •7. Кислотные и основные свойства органических соединений
- •Кислотные и основные функции веществ
- •Кислотность и основность по Бренстеду-Лоури.
- •Примеры.
- •Кислотность спиртов.
- •Сольватация аминов.
- •Кислоты и основания Льюиса.
- •Жесткие и мягкие кислоты и основания по Пирсону (жмко).
- •8. Углеводороды
- •8.1 Алканы
- •5. Воздействие анаэробных бактерий на растительные остатки:
- •6.1 Гидролиз карбидов:
- •7.1 Гидрирование алкенов:
- •7.2 Гидрирование алкадиенов:
- •7.3 Гидрирование алкинов:
- •1. Реакции замещения атомов водорода при взаимодействии с активными радикалами.
- •1.1.1 Фтор:
- •1.1.3 Бром:
1. Концепция теории мезомерии.
Делокализацию электронов изображают стрелками.
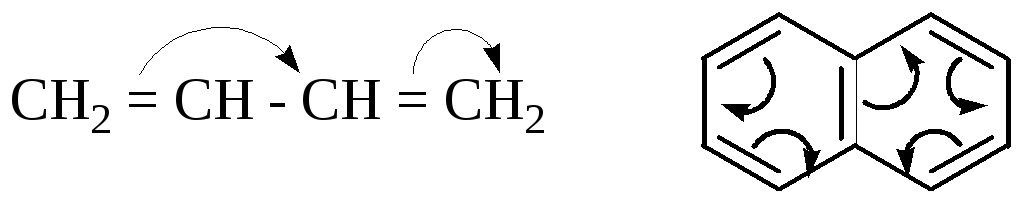
2. Концепция теории резонанса (Полинг, 1928 г.).
Представление К. Ингольда о мезомерии вошли как составная часть в теорию резонанса, разработанную в 1928–1938 г. Л. Полингом. Согласно Полингу, молекулу можно описать как быстро флуктуирующую структуру между двумя электронными формулами (резонирующими структурами) и приобретающими стабильность большую, чем любая из формул, благодаря резонансной энергии этой флуктуации. Реальная молекула описывается как "резонансный гибрид", в котором распределение электронной плотности является промежуточным между распределением электронной плотности в резонансных гибридных структурах. Сопряженные системы изображают с помощью набора резонансных структур, объединяемых резонансной стрелкой. Реальная структура есть результат суперпозиции нескольких резонансных структур:
![]()
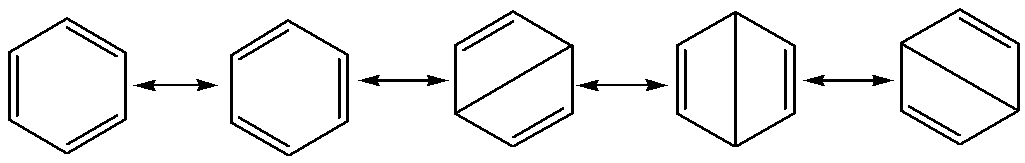
Бензол может быть изображен пятью резонансными структурами:
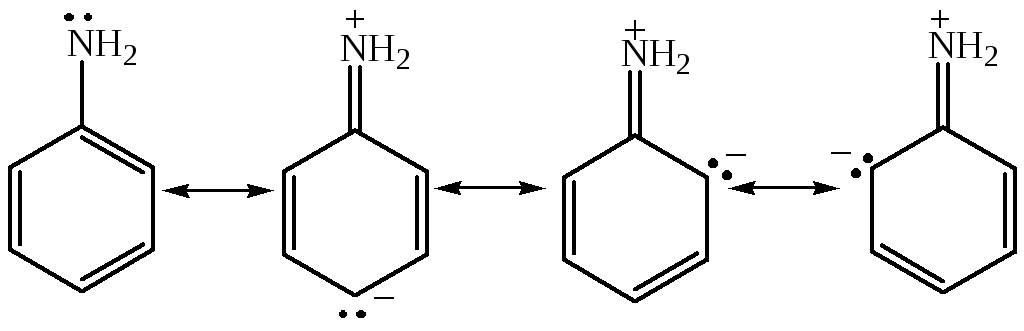
Основные резонансные структуры анилина следующие:
3. Делокализованное π-облако изображается пунктиром (в цикле – сплошной линией).
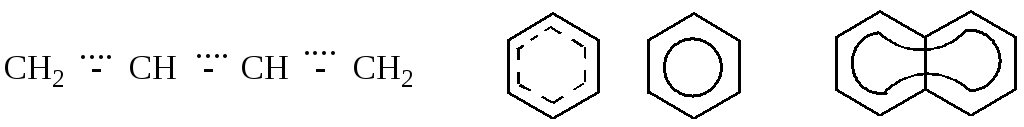
Концепция мезомерии – резонанса является способом реального электронного строения молекул с помощью граничных структур. Резонансные формулы обладают хорошей наглядностью и позволяют подчеркивать особенности электронной структуры. Дальнейшее развитие представлений о взаимодействии связей и перераспределении электронной плотности в сопряженных молекулах нашло свое воплощение в квантовой органической химии.
Таблица 9 – Соотношение индуктивных и мезомерных эффектов заместителей
|
Заместитель |
I эффект |
М эффект |
ЭД- или ЭА- влияние заместителя |
|
Алкилы |
+ I |
– |
ЭД |
|
СН3–, С2Н5– |
–I |
– |
ЭА |
|
–ОН |
–I |
+М |
ЭД (+М > –I) |
|
–ОСН3 |
–I |
+М |
ЭД (+М > –I) |
|
–NH2 |
–I |
+М |
ЭД (+М > –I) |
|
|
–I |
–М |
ЭА |
|
|
–I
|
–М
|
ЭА
|
|
|
–I
|
–М
|
ЭА
|
|
|
–I
|
–М
|
ЭА
|
|
–Cl, –Br, –I |
–I |
+ М |
ЭА (+М < –I) |
Электронное строение сопряженных систем. Сопряженная система – система sp2 гибридизованных атомов с общим копланарным σ-скелетом с делокализованным π-облаком и обладающая повышенной термодинами-ческой устойчивостью.
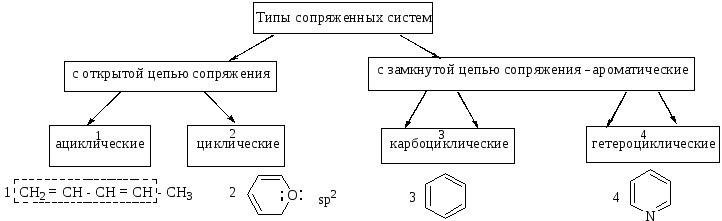
Сопряжение – взаимное перекрывание рz-орбиталей нескольких π- или π, р-систем, приводящее к делокализации π-электронного облака и повышению термодинамической устойчивости.
Энергия сопряжения ER (мера термодинамической устойчивости) – разность энергий образования реально существующей сопряженной молекулы и соответствующей молекулы (реальной или гипотетической) с изолированными двойными связями.
Пентадиен – 1,3 (I)
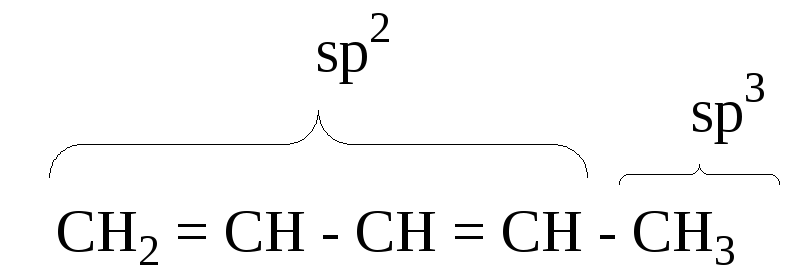
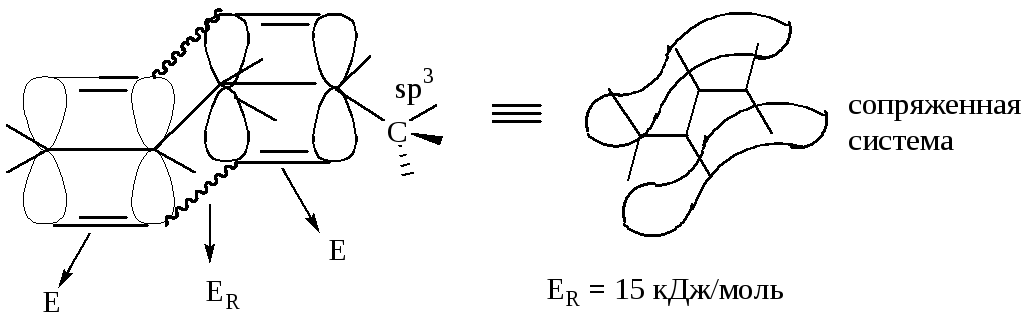
Пентадиен – 1,4 (II) СН2 = СН – СН2 – СН = СН2
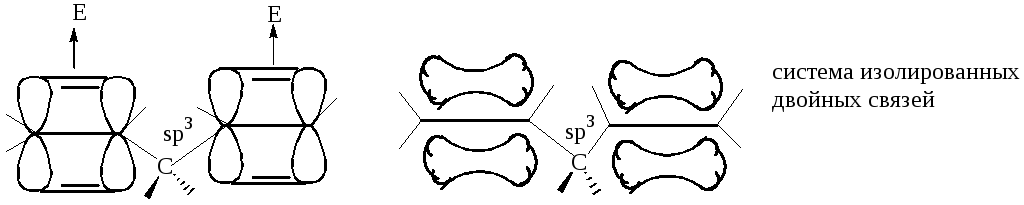
Бензол

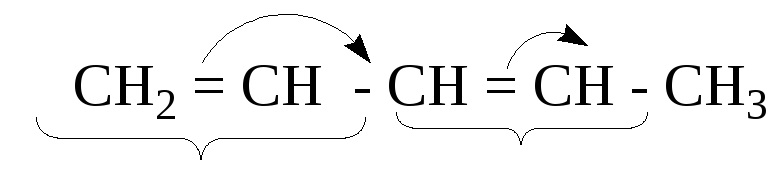
Типы сопряжения. π,π-сопряжение – в сопряжении участвуют π-электроны нескольких π-систем (не менее 4-х центров).
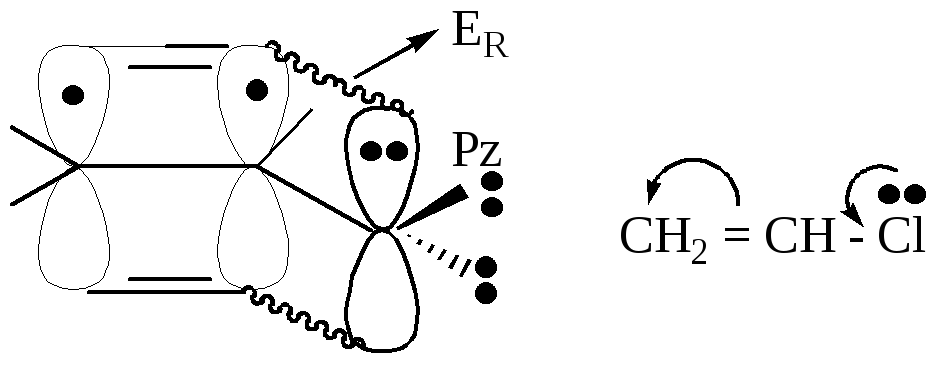
р, π-сопряжение – в сопряжении участвуют π-электроны π-системы и р-электроны на pz-орбитали гетероатома (не менее 3-х центров).
Ароматическая система – замкнутая сопряженная система рz- орбиталей с делокализованными π- или р-электронами, число которых соответствует формуле Хюккеля.
Условия сопряжения. Для ациклических сопряженных систем:
sp2 гибридизация всех атомов в сопряженном фрагменте;
копланарность общего σ-скелета, валентный угол 120о.
Для ароматических систем:
наличие цикла;
sp2 гибридизация всех атомов в цикле;
копланарность σ-скелета, отсутствие углового напряжения, валентный угол 120о;
Число делокализованных электронов должно соответствовать формуле Хюккеля:
![]()
где n – целое число; N – число делокализованных электронов.