
БХ Экзамен 2021
.pdf
86.ПЕРЕВАРИВАНИЕ БЕЛКОВ (СХЕМА ГИДРОЛИТИЧЕСКОГО РАСЩЕПЛЕНИЯ). ОБЩАЯ ХАРАКТЕРИСТИКА ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ ПИЩЕВАРИТЕЛЬНОГО КАНАЛА.
ПЕРЕВАРИВАНИЕ БЕЛКОВ
Переваривание белков начинается в желудке. Большую роль в этом процессе занимает соляная кислота. Белки, поступающие в желудок, стимулируют выделение гистамина и группы белковых гормонов – гастринов, которые вызывают секрецию соляной кислоты (образуется в обкладочных клетках желудочных желез) и профермента пепсиногена. Под действием соляной кислоты происходит денатурация белков пищи, не подвергшихся термической обработке. НСl обладает бактерицидным действием и препятствует попаданию патогенных бактерий в кишечник. Она активирует пепсиноген и создает оптимум рН для действия пепсина
Желудочное содержимое (химус) в процессе перевариваня поступает в двенадцатиперстную кишку. Низкое значение рН химуса вызывает в кишечнике выделение секретина, поступающего в кровь. Он стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3- , что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина (рН резко возрастает от 1,5-2,0 до 7,0).
Поступление пептидов в тонкий кишечник вызывает секрецию холецистокинина, который стимулирует выделение панкреатических ферментов с оптимумом рН 7,5 – 8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков.
Под влиянием протеолитических ферментов образуются аминокислоты, которые всасываются в кишечнике, либо диффузно, либо путем активного транспорта.
ОБЩАЯ ХАРАКТЕРИСТИКА ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ ПИЩЕВАРИТЕЛЬНОГО КАНАЛА
Ферменты, переваривающие белки (гидролизующие пептидные связи), называются протеиназы (пептидазы, протеазы, протеолитические ферменты)
Катепсины – лизосомальные протеиназы, обеспечивающие распад тканевых (собственных) белков, рН оптимум их лежит в кислой среде Для протеолитических ферментов характерно:
–выделяются железами пищеварительной системы в неактивном состоянии (в форме проферментов),
–имеют единый механизм активации – частичный протеолиз – отщепление одного или нескольких пептидов от молекулы с образованием активного фермента,
–наличие субстратной специфичности,
–независимость действия.
Протеиназы ЖКТ
Эндопептидазы
(синтезируются в неактивной форме)
•Пепсин;
•Реннин;
•Гастриксин;
•Трипсин;
•Химотрипсин;
•Эластаза.
Экзопептидазы
•Карбоксипептидазы А и В;
•Аминопептидазы;
•Дипептидазы;
•Трипептидазы.
87.ПРОТЕИНАЗЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА; ПРОФЕРМЕНТЫ ПРОТЕИНАЗ И МЕХАНИЗМЫ ИХ ПРЕВРАЩЕНИЯ В ФЕРМЕНТЫ. ЗНАЧЕНИЕ ПРОЦЕССА.
ПРОТЕИНАЗЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Эндопептидазы:
1.Пепсин – протеолитический фермент, вырабатывающийся в главных клетках слизистой оболочки желудка в неактивной форме – в виде пепсиногена. Активируется c помощью HCL отщеплением от N-конца фермента (частичный протеолиз). Он способен гидролизировать белки при рН 1,5-2,5 (протеолитическая активность), а при рН 5,0 – створаживать казеиноген молока за счет превращения его в казеин, в основе превращения лежит также гидролиз пептидных связей (химазная активность).
2.Гастриксин – протеолитический фермент, имеющий наибольшее значение при питании молочнорастительной пищей, слабо стимулирующей выделение соляной кислоты и одновременно нейтрализующей ее в просвете желудка. При рН 3-3,5 гидролизует связи, образованные карбоксильными группами дикарбоновых аминокислот. Он является эндопептидазой.
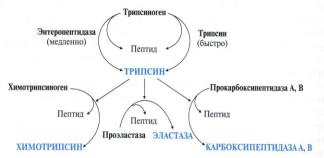
3.Трипсиноген в двенадцатиперстной кишке подвергается частичному протеолизу под действием фермента энтеропептидазы, секретируемой клеткам кишечного эпителия. От профермента отделяется гексапептид, что приводит к формированию активного центра трипсина. Трипсин гидролизует внутренние пептидные связи, образованные аргинином и лизином.
Трипсин может осуществлять аутокатализ, т.е. превращение последующих молеку трипсиногена в трипсин, также он активирует остальные протеолитические ферменты панкреатического сока –
химотрипсиноген, проэластазу, прокарбоксипептидазу. Также трипсин участвует в переваривании пищевых липидов.
4.Химотрипсиноген образуется из химотрипсиногена при участии трипсина и промежуточных, уже активных, форм химотрипсина, которые выстригают два дипептида из цепи профермента. Фермент специфичен к пептидным связям, образованным с участием карбоксильных групп фенилаланина, тирозина и
триптофана (ароматические).
5.Эластаза активируется в просвете кишечника трипсином из проэластазы. Гидролизует связи, образованные карбоксильными группами малых аминокислот аланина, пролина, глицина.
Экзопептидазы:
1.Карбоксипептидазы являются экзопептидазами, т.е. отщипляет свободную АК с С- конца пептидной цепи. Карбоксипептидазы А отщепляют с С-конца остатки алифатических и ароматических аминокислот, карбоксипептидазы В – остатки лизина и аргинина.
2.Аминопептидазы, являясь экзопептидазами, аминопептидазы отщепляют N- концевые аминокислоты. Важными представителями являются аланинаминопептидаза и лейцинаминопептидаза, обладающие широкой специфичностью. Например, лейцинаминопептидаза отщепляет с N-конца белка не только лейцин, но и ароматические аминокислоты и гистидин.
3.Дипептидазы гидролизуют дипептиды, в изобилии образующиеся в кишечнике при работе других ферментов. (Трипептидазы, соответственно – гидролизуют трипептиды)
Малое количество дипептидов и пептидов пиноцитозом попадают в энтероциты и здесь гидролизуются лизосомальными протеазами.
ПРОФЕРМЕНТЫ ПРОТЕИНАЗ И МЕХАНИЗМЫ ИХ ПРЕВРАЩЕНИЯ В ФЕРМЕНТЫ
Биологический смысл проферментов – защита тканей пищеварител. желёз от самопереваривания (аутолиза)
Пепсиноген - белок, состоящий из одной полипептидной цепи с молекулярной массой 40 кД. Под действием НСl он превращается в активный пепсин (с оптимумом рН 1,0-2,5. В процессе активации в результате частичного протеолиза от N-конца молекулы пепсиногена отщепляются 42 аминокислотных остатка, которые содержат почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. Таким образом, в активном пепсине преобладающими оказываются отрицательно заряженные аминокислоты, которые участвуют в конформационных перестройках молекулы и формировании активного центра.
Образовавшиеся под действием НСl активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ).
Механизм превращения – частичный протеолиз:
-пепсиноген под действием соляной кислоты превращается в пепсин;
-трипсиноген под действием энтеропептидазы превращается в трипсин;
-химотрипсиноген под действием трипсина превращается в химотрипсин;
-проэластаза под действием трипсина превращается в эластазу.
-Прокарбоксипептидаза под действием трипсина
превращается в карбоксипептидазу.
Активация панкреатических ферментов. В поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и В. В кишечнике они путём частичного протеолиза превращаются в активные ферменты трипсин, химотрипсин, эластазу и карбоксипептидазы А и В. Активация трипсиногена происходит под действием фермента эпителия кишечника энтеропептидазы Изменение конформации оставшейся части полипептидной цепи приводит к формированию активного центра, и образуется активный трипсин.

88.СУБСТРАТНАЯ СПЕЦИФИЧНОСТЬ ПРОТЕИНАЗ. ЭКЗОПЕПТИДАЗЫ И ЭНДОПЕПТИДАЗЫ.
СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ ПРОТЕАЗ.
Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три). Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот. Причём карбоксипептидаза А отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В - остатки аргинина и лизина. Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи. Наиболее известна лейцинаминопептидаза - Zn2+- или Мn2+-содержащий фермент, несмотря на название, обладающий широкой специфичностью по отношению к N-концевым аминокислотам.
Дипептидазы расщепляют дипептиды на аминокислоты, но не действуют на трипептиды.
В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот.
ЭКЗОПЕПТИДАЗЫ (экзопротеиназы) — ферменты, гидролизующие белки, отщепляя аминокислоты от конца пептида: карбоксипептидазы — от C-конца, аминопептидазы — от N-конца, дипептидазы расщепляют дипептиды. Экзопептидазы синтезируются в клетках тонкого кишечника (аминопептидазы, дипептидазы) и в поджелудочной железе (карбоксипептидаза). Функционируют эти ферменты внутриклеточно в кишечном эпителии и, в небольшом количестве, в просвете кишечника.
ЭНДОПЕПТИДАЗЫ (эндопротеиназы) — протеолитические ферменты (пепсин, трипсин, химотрипсин), расщепляющие пептидные связи внутри пептидной цепи. С наибольшей скоростью ими гидролизуются связи, образованные определёнными аминокислотами. Эндопептидазы синтезируются в виде проферментов, активируемых затем при помощи избирательного протеолиза. Таким образом клетки, секретирующие эти ферменты, защищают собственные белки от разрушения. От действия ферментов клеточную мембрану клеток животных защищает также поверхностный слой олигосахаридов —гликокаликс, а в кишечнике и желудке — слой слизи.
89.ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ БИОХИМИЧЕСКОГО АНАЛИЗА ЖЕЛУДОЧНОГО И ДУОДЕНАЛЬНОГО СОКА. КРАТКАЯ ХАРАКТЕРИСТИКА СОСТАВА ЭТИХ СОКОВ.
ЖЕЛУДОЧНЫЙ СОК
-продукт нескольких типов клеток. Обкладочные клетки стенок желудка образуют соляну кислоту, главные клетки секретируют пепсиноген, добавочные клетки муцинсодержающую слизь.
Функции:
-активирует пепсин из пепсиногена.
-обеспечивает химическую защиту от инородных тел.
-"внутренним фактором" (фактором Касла). Этот белок связывает "внешний фактор" - витамин В12, предотвращает его разрушение и способствует всасыванию.
-под действие соляной кислоты происходит денатурация белков
-содержит пепсин, расщепляющий белок.
ДУОДЕНАЛЬНЫЙ СОК - пищеварительный сок двенадцатиперстной кишки, состоящий из секрета поджелудочной железы, желчи, сока кишечных крипт и дуоденальных желез Панкреатический сок имеет высокую концентрацию бикарбонатов,
которые обусловливают его щелочную реакцию. Его рН колеблется от 7,5 до 8,8. В соке содержатся хлориды натрия, калия и кальция, сульфаты и фосфаты. Вода и электролиты выделяются в основном центроацинарными и эпителиальными клетками выводах протоков. В состав сока входит и слизь, которая вырабатывается бокаловидными клетками главного протока поджелудочной железы. Они вырабатываются ацинарными панкреацитами.Протеолитические ферменты (трипсин, химотрипсин, эластаза, карбок-сипептидазы А и В)
ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ биохимического анализа
желудочного сока: нахождение патологических составляющих (молочной кислоты, крови, желчи).
Определение общей кислотности: общая кислотность желудочного сока может повышаться (гиперацидное состояние) и снижаться (гипоацидное), вплоть до исчезновения (анацидное состояние)
Гиперацидное состояние вызывается в основном избытком свободной соляной кислоты, т.е. возникает
гиперхлоргидрия. Снижение HCI в желудочном соке – это гипохлоргидрия, отсутствие – ахлоргидрия.
Изменение кислотности желудочного сока имеет место при язвенной болезни, гастритах, при раке, злокачественном малокровии.
дуоденального сока: позволяет сделать или опровергнуть окончательный диагноз панкреатитов, воспалительных процессов или даже злокачественных образований ДПК и тонкой кишки.
90.ПРОТЕИНАЗЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ И ПАНКРЕАТИТЫ. ПРИМЕНЕНИЕ ИНГИБИТОРОВ ПРОТЕИНАЗ ДЛЯ ЛЕЧЕНИЯ ПАНКРЕАТИТОВ.
ПРОТЕИНАЗЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ И ПАНКРЕАТИТЫ
1.Трипсиноген в двенадцатиперстной кишке подвергается частичному протеолизу под действием фермента энтеропептидазы, секретируемой клеткам кишечного эпителия. От профермента отделяется гексапептид, что приводит к формированию активного центра трипсина. Трипсин гидролизует внутренние пептидные связи, образованные аргинином и лизином.
Трипсин может осуществлять аутокатализ, т.е. превращение последующих молеку трипсиногена в трипсин, также он активирует остальные протеолитические ферменты панкреатического сока –
химотрипсиноген, проэластазу, прокарбоксипептидазу. Также трипсин участвует в переваривании пищевых липидов.
2.Химотрипсиноген образуется из химотрипсиногена при участии трипсина и промежуточных, уже активных, форм химотрипсина, которые выстригают два дипептида из цепи профермента. Фермент специфичен к пептидным связям, образованным с участием карбоксильных групп фенилаланина, тирозина и триптофана (ароматические).
3.Эластаза активируется в просвете кишечника трипсином из проэластазы. Гидролизует связи, образованные карбоксильными группами малых аминокислот аланина, пролина, глицина.
4.Карбоксипептидазы являются экзопептидазами, т.е. отщипляет свободную АК с С- конца пептидной цепи. Карбоксипептидазы А отщепляют с С-конца остатки алифатических и ароматических аминокислот, карбоксипептидазы В – остатки лизина и аргинина.
ПРИМЕНЕНИЕ ИНГИБИТОРОВ ПРОТЕИНАЗ ДЛЯ ЛЕЧЕНИЯ ПАНКРЕАТИТОВ Панкреатиты – группа воспалительных заболеваний поджелудочной железы, в результате которых она поражается частично или даже полностью.
Необходимые для биохимии панкреатиты – возникают вследствие ранней активации панкреатических ферментов (особенно протеиназ), т.е. их активация до выхода в просвет кишки – когда они ещё находятся в пределах поджелудочной железы, что приводит к процессу её самопереваривания и несёт за собой очень тяжёлые последствия.
Весьма широко используются в настоящее время ингибиторы протеиназ (контрикал) при панкреатитах – состояниях, когда происходит активирование пищеварительных ферментов в протоках и клетках поджелудочной железы.
Некоторые продукты могут содержать в своём составе ингибиторы протеиназ, например, соя. Когда человек употребляет большое количество сои, то у него нарушается переваривание белков в организме и пищеварение в целом.
91.КАТАБОЛИЗМ БЕЛКОВ В ТКАНЯХ. ТРАНСПОРТ АМИНОКИСЛОТ В КЛЕТКУ, ПУТИ ПРЕВРАЩЕНИЙ АМИНОКИСЛОТ В КЛЕТКАХ.
ТРАНСПОРТ АМИНОКИСЛОТ В КЛЕТКУ
Конечными продуктами гидролитического расщепления белков являются свободные аминокислоты, подвергающиеся активному транспорту через мембрану энтероцита в кровь.
Аминокислоты, образовавшиеся при переваривании белков, быстро всасываются в кишечнике. Транспорт их осуществляется двумя путями: через воротную систему печени, ведущую прямо в печень, и по лимфатическим сосудам, сообщающимся с кровью через грудной лимфатический проток. Максимальная концентрация аминокислот в крови достигается через 3050 мин после приёма белковой пищи (углеводы и жиры замедляют всасывание аминокислот). Всасывание L-аминокислот (но не D-изомеров) - активный процесс, требующий затраты энергии. Аминокислоты переносятся через кишечную стенку от слизистой её поверхности в кровь. Перенос через щёточную кайму осуществляется целым рядом переносчиков, многие из которых действуют при участии Na+-зависимых механизмов симпорта, подобно переносу глюкозы.
Перенос аминокислот через мембраны клеток, как в кишечнике, так и в других тканях, осуществляется при помощи двух механизмов: вторичный активный транспорт и глутатионовая транспортная система.
A.Транспорт с использованием градиента концентрации натрия – вторичный активный транспорт.
Внастоящее время известно по крайней мере пять специфических транспортных систем, каждая из которых функционирует для переноса определённой группы близких по строению аминокислот:
нейтральных, с короткой боковой цепью (аланин, серин, треонин);
нейтральных, с длинной или разветвлённой боковой цепью (валин, лейцин, изолей-цин);
с катионными радикалами (лизин, аргинин);
с анионными радикалами (глутаминовая и аспарагиновая кислоты);
иминокислот (пролин, оксипролин).
Причём к числу Na+-зависимых относятся переносчики аминокислот, входящих в первую и пятую группы, а также переносчик метионина. Независимые от Na+ переносчики специфичны для некоторых
нейтральных аминокислот (фенилаланин, лейцин) и аминокислот с катионными радикалами (лизин). Вторичный активный транспорт основан на использовании низкой концентрации натрия внутри клеток, создаваемой Na+,K+-АТФазой. Специфический белок-транспортер связывает на апикальной поверхности энтероцитов аминокислоту и ион натрия. Используя движение натрия по градиенту концентрации, белок переносит аминокислоту в цитозоль.
B.Транспорт аминокислот в комплексе с глутатионом при помощи фермента γ- глутамилтрансферазы – для нейтральных аминокислот.
Переносчиком некоторых аминокислот (обычно нейтральных) по этой схеме является трипептид глутатион (γ- глутамилцистеилглицин). При взаимодействии глутатиона с аминокислотой на внешней стороне клеточной мембраны при участии глутамилтрансферазы. γ-глутамильный остаток связывает аминокислоту и происходит ее перемещение внутрь клетки. Глутатион при этом распадается на составляющие. После отделения аминокислоты происходит ресинтез глутатиона
ПУТИ ПРЕВРАЩЕНИЙ АМИНОКИСЛОТ В КЛЕТКАХ
1.Декарбоксилирование;
2.Трансаминирование;
3.Дезаминирование;
92.ТРАНСАМИНИРОВАНИЕ: АМИНОТРАНСФЕРАЗЫ; КОФЕРМЕНТНАЯ ФУНКЦИЯ ВИТАМИНА В6. СПЕЦИФИЧНОСТЬ АМИНОТРАНСФЕРАЗ.
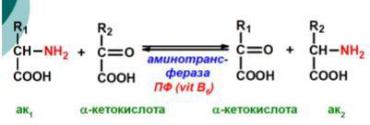
ТРАНСАМИНИРОВАНИЕ
Трансаминирование – процесс переноса аминогруппы с α-аминокислоты на кетокислоту при участии ферментов трансаминаз (В6 – фосфопиридоксаль). Этому процессу подвергаются все аминокислоты, кроме лизина, треонина и пролина.
АМИНОТРАНСФЕРАЗЫ
Реакцию трансаминирования катализируют высокоактивные аминотрансферазы:
аланинаминотрансфераза (АЛТ) и аспартатаминотрансфераза (АСТ), которые обладают субстратной специфичностью.
КОФЕРМЕНТНАЯ ФУНКЦИЯ ВИТАМИНА В6
В переносе аминогруппы активное участие принимает кофермент трансаминаз пиридоксальфосфат, производное витамина В6, который в процессе реакции обратимо превращается в пиридоксаминфосфат, играющий роль переносчика аминогруппы от одной аминокислоты к другой
СПЕЦИФИЧНОСТЬ АМИНОТРАНСФЕРАЗ
АЛТ и АСТ – органоспецифические ферменты, в норме в крови их активнрсть равна 5-40 ЕД/л, т.е. активность трансаминаз сравнительно низкая. При заболеваниях, сопровождающихся деструкцией (некрозом) клеток, происходит выход ферментов в кровь и повышение их активности. Определение активности АЛТ и АСТ имеет большое диагностическое значение. Для дифференциальной диагностики заболеваний печени и сердца определяют соотношение активности АСТ/АЛТ в сыворотке крови – «коэффициент де Ритиса», который в норме составляет 1,33±0,42.
При гепатитах активность АЛТ увеличивается в 6-8 раз по сравнению с нормой, а АСТ – в 2-4 раза. «Коэффициент де Ритиса» уменьшается примерно до 0,6. Особенно важное значение для диагностики имеет повышение активности АЛТ при безжелтушных формах вирусного гепатита. У детей при гепатитах активность АЛТ возрастает еще в дожелтушный период развития болезни. Однако, при церрозе печени «Коэффициент де Ритиса» приближается к 1,0, что свидетельствует о некрозе клеток, при котором в кровь выходят обе фракции (цитоплазматическая и митохондриальная).
При инфаркте миокарда активность АСТ увеличивается в 8-10 раз, а АЛТ – в 1,5 -2,0 раза. Значение «Коэффициента де Ритиса» резко возрастает. Инфекционные и токсические миокардиты характеризуются повышением АСТ, это же самое наблюдается при операциях на сердце.
При стенокардии, пороках сердца, инфаркте легкого активность аминотрансфераз в крови не возрастает.
93.АМИНОКИСЛОТЫ, УЧАСТВУЮЩИЕ В ТРАНСАМИНИРОВАНИИ; ОСОБАЯ РОЛЬ ГЛУТАМИНОВОЙ КИСЛОТЫ. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ РЕАКЦИЙ ТРАНСАМИНИРОВАНИЯ.
АМИНОКИСЛОТЫ, УЧАСТВУЮЩИЕ В ТРАНСАМИНИРОВАНИИ
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных - глутамат, аланин, аспартат и соответствующие им кетокислоты - α-
кетоглутарат, пируват и оксалоацетат.
ОСОБАЯ РОЛЬ ГЛУТАМИНОВОЙ КИСЛОТЫ
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных - глу-тамат, аланин, аспартат и соответствующие им кетокислоты - α- кетоглутарат, пируват и оксалоацетат. Основным донором аминогруппы служит глутамат.
Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию (аминокислота 1), служит α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат, который способен передавать эту группу любой α-кетокислоте с образованием другой аминокислоты (аминокислота
2).
БИОЛОГИЧЕСКАЯ РОЛЬ РЕАКЦИЙ ТРАНСАМИНИРОВАНИЯ
•Путь синтеза заменимых аминокислот
•Путь перераспределения азота без образования токсичного аммиака
•Путь пополнения энергетического материала (образование субстратов окислительного декарбоксилирования ПВК и ЦТК)
94.ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ; ГЛУТАМАТДЕГИДРОГЕНАЗА. НЕПРЯМОЕ ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ.
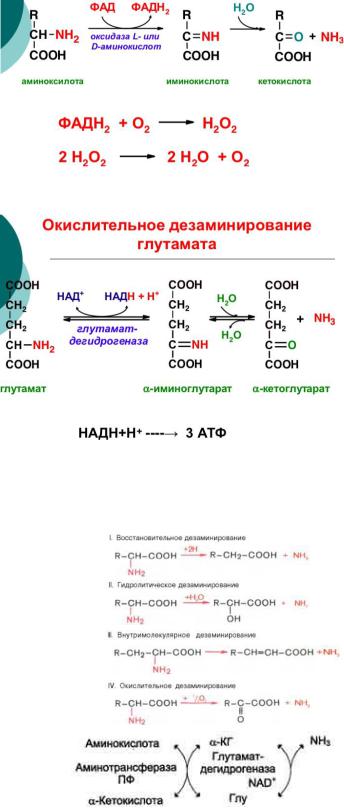
Дезаминирование – процесс потери аминокислотой аминогруппы, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. В организме подвергается этому процессу только глутаминовая кислота, т.к. в организме активен фермент глутаматдегидрогеназа (ГДГ). Фермент ГДГ активен в митохондриях клеток всех органов, кроме мышечной ткани.
ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ Окислительное дезаминирование аминокислот является необратимым процессом. В организме не встречается, т.к.
аммиак, образующийся в результате данной реакции, токсичен для организма; оксидазы L-аминокислот работают при рН=10, что не соответствует оптимуму большинства клеток, а оксидазы D-аминокислот работают в нормальном оптимуме, однако в организме человека D-аминокислоты практически не образуются.
Биологическое значение:
-обеспечивает распад аминокислот;
-образующиеся α-кетокислоты могут поступать в ЦТК (α-кетоглутарат, ЩУК).
ГЛУТАМАТДЕГИДРОГЕНАЗА
Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом
глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование а-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется а-
кетоглутарат. Окислительное дезаминирование глутамата -
обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении,
как восстановительное шинирование α-кетоглутарата.
Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент - олигомер, состоящий из 6 субъединиц (молекулярная масса
312 кД). Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДф активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образованиеα-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом).
НЕПРЯМОЕ ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ
(трансдезаминирование) Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α- кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
Стадии:
1.Перенос аминокислот в результате трансаминирования на α- кетоглутарат с образованием глутаминовой кислоты (при участии аминотрансферазы).
2.Прямое окислительное дезаминирование глутаминовой кислоты (при участии глутаматдегидрогеназы).
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
непрямое дезаминирование - основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты.
БИОЛОГИЧЕСКАЯ РОЛЬ: Азот всех аминокислот собирается в форме одной аминокислоты (глутамата), которая обратимо подвергается окислительному дезаминированию.
95.ОСНОВНЫЕ ИСТОЧНИКИ АММИАКА В ОРГАНИЗМЕ, ОБЕЗВРЕЖИВАНИЕ АММИАКА В МЕСТЕ ОБРАЗОВАНИЯ, ТРАНСПОРТНЫЕ ФОРМЫ АММИАКА.
Аммиак – токсичное соединение, особенно для центральной нервной системы. Это судорожный яд, требующий постоянного обезвреживания.
Механизм токсического действия аммиака:
1.на обезвреживание аммиака расходуется α-кетоглутаровая кислота, это приводит к выключению ее из цикла трикарбоновых кислот, блокаде ЦТК и развитию гипоэнергетического состояния,
2.повышенная концентрация аммиака в крови (гипераммониемия) приводит к нарушению кислотно-основного состояния, развивается алкалоз,
3.нарушается синтез медиаторов, нарушается проведение нервных импульсов, страдает нервная система,
4.изменяется концентрация в крови катионов натрия и калия, нарушается электролитный баланс.
Поскольку аммиак очень токсичен, его необходимо повсеместно обезвреживать с образованием транспортных форм (глутамата, глутамина, амидированных карбоксильных групп белков плазмы крови), которые затем направляются в печень или в почки, где осуществляется окончательное обезвреживание аммиака с образованием менее токсичных форм его выведения – мочевины, аммонийных солей. При катаболизме сложных белков распад простетических групп приводит к образованию других азотсодержащих конечных продуктов (желчных пигментов, мочевой кислоты). Высокая степень разветвленности метаболических путей превращения аминокислот вовлекает в процесс множество высокоспецифичных ферментных систем, генетические дефекты которых обуславливают появление большого количества наследственных нарушений аминокислотного обмена, проявляющихся тяжелыми наследственными болезнями.
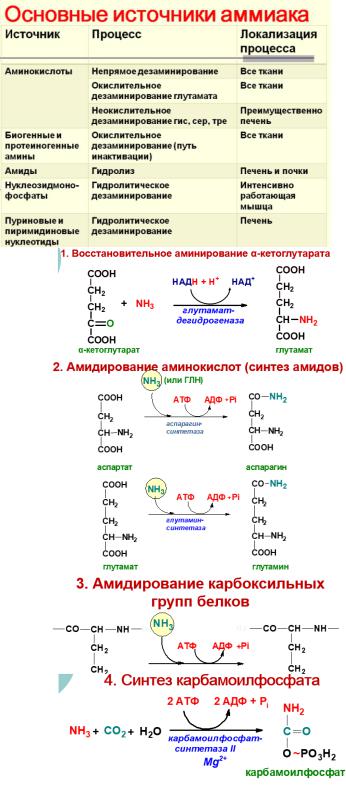
ОСНОВНЫЕ ИСТОЧНИКИ АММИАКА В ОРГАНИЗМЕ
Аммиак в организме образуется в результате дезаминирования аминокислот, биогенных аминов и нуклеотидов. Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение). Концентрация аммиака в крови в норме – 0,4-0,7мг/л. Это токсичное соединение, поэтому аммиак не накапливается, а вступает в реакцию с глутаминовой или аспарагиновой кислотами с образованием индифферентной транспортной формы – глутамина или аспарагина.
ОБЕЗВРЕЖИВАНИЕ АММИАКА В МЕСТЕ ОБРАЗОВАНИЯ
В почках глутамин под влиянием глутаминазы расщепляется с образованием аммиака, идущего на нейтрализацию кислых соединений с образованием аммонийных солей. Этот процесс является одним из механизмов регуляции кислотно-щелочного равновесия в организме и сохранения важнейших катионов (Na+, K+) для поддержания осмотического давления. Глутамин – основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров, белков, глюкозы. Также источниками образования аммиака служат процессы:
-дезаминирования биогенных аминов;
-распад пиримидиновых оснований (урацил, тимин, цитозин);
-дезаминирования аминокислот;
-дезаминирования пуриновых оснований (гуанина и
аденина).
ТРАНСПОРТНЫЕ ФОРМЫ АММИАКА
1.Глутаминовая кислота
2.Амиды аминокислот (аспарагин и глутамин)
3.Амидированные белки
Транспортными формами аммиака из тканей в печень являются глутамин и аланин, в меньшей степени аспарагин и глутамат,
некоторое количество аммиака находится в крови в свободном виде. Глутамин и аланин являются наиболее представленными, их доля среди всех аминокислот крови составляет до 50%. Большая часть глутамина поступает от мышц и нервной ткани, аланин переносит аминный азот от мышц и стенки кишечника.
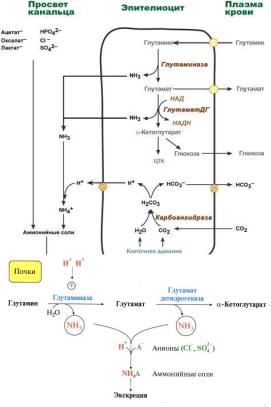
96.РОЛЬ ГЛУТАМИНА В ОБЕЗВРЕЖИВАНИИ И ТРАНСПОРТЕ АММИАКА. ГЛУТАМИН КАК ДОНОР АМИДНОЙ ГРУППЫ ПРИ СИНТЕЗЕ РЯДА СОЕДИНЕНИЙ. ГЛУТАМИНАЗА ПОЧЕК; ОБРАЗОВАНИЕ И ВЫВЕДЕНИЕ СОЛЕЙ АММОНИЯ.
РОЛЬ ГЛУТАМИНА В ОБЕЗВРЕЖИВАНИИ И ТРАНСПОРТЕ АММИАКА
Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутаминсинтетазы.
Основными тканями – поставщиками глутамина служат мышцы, мозг и печень.
Глутамин легко транспортируется через клеточные мембраны путем облегченной диффузии и поступает из тканей в кровь. С током крови глутамин транспортируется в кишечник и почки.
ГЛУТАМИН КАК ДОНОР АМИДНОЙ ГРУППЫ
Высокий уровень глутамина в крови и легкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах.
Глутамин – основной донор азота в организме. Амидный азот глутамина используется для синтеза АК, пуриновых и пиримидиновых нуклеотидов, аспарагина, аминосахаров, гистидин, триптофан и т.д.
ОБРАЗОВАНИЕ И ВЫВЕДЕНИЕ СОЛЕЙ АММОНИЯ
Непосредственный синтез аммонийных солей или аммониегенез происходит в просвете канальцев почек из
секретируемых сюда аммиака и ионов водорода и фильтрующихся органических и неорганических анионов первичной мочи. Около 10% всего аммиака выводится почками в виде аммонийных солей.
Часть глутамина крови, не задержавшаяся в печени, достигает почек. В эпителиальных клетках почечных канальцев, в основном в дистальных канальцах, имеется фермент глутаминаза, гидролизующая амидную группу с образованием глутамата. Глутамат дезаминируется ГДГ Параллельно в эпителии происходят процессы клеточного дыхания, сопровождающиеся образованием угольной кислоты, которая диссоциирует на ион Н+икарбонат-ион НСО3−. Ионы водорода секретируются в первичную мочу, карбонат-ионы – в кровь. Выделяемый аммиак диффундирует в просвет канальца, где соединяется с ионом Н+, образуя ионы аммонияNH4+. Они связываются с неорганическими (фосфаты, хлориды, сульфаты) или с органическими анионами (уксусной, щавелевой, молочной кислот).
Биологическая роль аммониегенеза
1.Обезвреживание и выведение токсического аммиака
2.Поддержание кислотно-основного состояния (КОС) за счёт выведения избыточных протонов
3.Сохранение ионов натрия
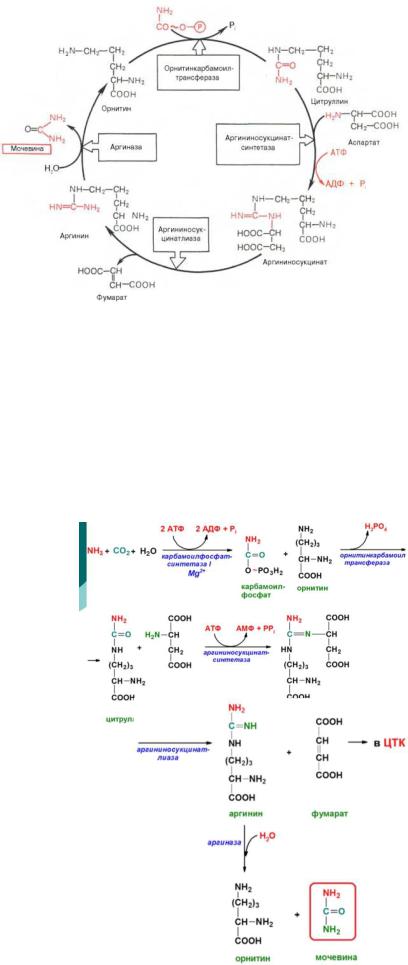
97.СИНТЕЗ МОЧЕВИНЫ, ХИМИЗМ, ЭНЕРГЕТИКА ПРОЦЕССА. СВЯЗЬ ОРНИТИНОВОГО ЦИКЛА С ЦТК. ПРОИСХОЖДЕНИЕ АТОМОВ АЗОТА МОЧЕВИНЫ. НАРУШЕНИЯ СИНТЕЗА И ВЫВЕДЕНИЯ МОЧЕВИНЫ. ГИПЕРАММОНЕМИИ.
СИНТЕЗ МОЧЕВИНЫ
Кребс и Гензеляйт установили, что синтез мочевины представляет собой циклический процесс, в котором ключевым соединением, замыкающим цикл, является орнитин. Кохен и Ратнер выяснили, что начальной реакцией этого цикла является синтез карбамоилфосфата.
В печени аммиак связывается с СО2 с образованием карбамоилфосфата под действием карбамоилфосфатсинтетазы. Затем под действием орнитин-карбамоилтрансферазы карбамоильная группа карбамоилфосфата переносится на орнитин и образуется цитруллин. В следующей реакции аргининосукцинатсинтетаза связывает его с аспартатом и образуется аргининоянтарная кислота. Аспартат – источник второго атома азота мочевины. Далее происходит расщепление аргининоянтарной кислоты на аргинин и фумарат (идет в ЦТК). Аргинин гидролизуется под действием
аргиназы на орнитин и мочевину. Образующийся орнитин взаимодействует с новой молекулой карбамоилфосфата, и цикл замыкается.
Первые две реакции происходят в митохондриях гепатоцитов. Затем цитруллин транспортируется в цитозоль, где и осуществляются дальнейшие превращения.
Орнитиновый цикл в печени выполняет 2 функции:
1.превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов - аммиака;
2.синтез аргинина и пополнение его в организме.
Отмечается, что у детей первых месяцев жизни функция печени развита недостаточно, что проявляется в том, что у ребенка количество аммиака по сравнению с взрослым человеком увеличено в 2-2,5 раза. У новорожденных – 20-30% общего азота падает на азот мочевины.
Мочевина – безвредное для организма соединение. Главным местом ее образования в организме является печень, где есть ферменты мочевинообразования. В головном мозге имеются все ферменты синтеза мочевины, кроме карбамоилфосфатазы, поэтому в нем мочевина не образуется.
Мочевина – основной конечный продукт азотистого обмена, в составе которого из организма выделяется до 90% всего выводимого азота. В норме экскрекция мочевины – 25-30 г/сут.
Основной источник аммиака - аминокислоты. Большая часть образовавшегося аммиака обезвреживается в орнитиновом цикле в печени и выделяется в виде мочевины. Основной реакцией обезвреживания аммиака в тканях является синтез глутамина, который затем используется в анаболических процессах и для обезвреживания веществ в печени.
ХИМИЗМ
1.Связывание аммиака под действием митохондриальной карбамоилфосфатсинтетазы I с диоксидом углерода с образованием карбамоилфосфата (процесс идет в митохондриях). Аммиак – источник первого атома азота
мочевины;
2.Карбамоильная группа карбамоилфосфата под действием орнитинкарбамоилтрансферазы переносится на орнитин, в результате чего образуется цитруллин, который выходит из митохондрий в цитоплазму
3.Связывание цитруллина с аспартатом под действием аргининосукцинатсинтетазы с образованием аргининосукцината
(аргининоянтарная кислота). Аспартат – источник второго атома
азота мочевины;
4.Расщепление аргининосукцината под действием аргининосукцинатлиазы с образованием аргинина (частично заменимая аминокислота) и фумарата, при этом аминогруппа аспартата оказывается в молекуле аргинина;
5.Гидролиз аргинина под действием аргиназы (органоспецифический) с образованием орнитина и мочевины.
