
БХ Экзамен 2021
.pdf
Федеральное государственное бюджетное образовательное учреждение высшего образования
«КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ» Министерства здравоохранения Российской Федерации
Сборник ответов на экзаменационные
вопросы по биологической химии
(студенческое пособие)
Порядок пользования документом
*Практически каждый вопрос начинается с новой страницы
*Подвопросы обозначены ПОЛУЖИРНЫМ И ПРОПИСНЫМ ТЕКСТОМ. Полужирным подчеркнутым текстом и курсивом выделены определения-подвопросы
*Определения выделены курсивом и подчеркнуты
*Ранее упомянутые понятия, элементы вопроса выделены только курсивом
*Классификации и подразделы только подчеркнуты
*Подвопросы, не отображенные в вопросе экзамена, напечатаны более мелким шрифтом
2021 г.
1.ПРЕДМЕТ И ЗАДАЧИ БИОЛОГИЧЕСКОЙ ХИМИИ. ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ, ИЕРАРХИЧЕСКАЯ СТРУКТУРНАЯ ОРГАНИЗАЦИЯ И САМОВОСПРОИЗВЕДЕНИЕ КАК ВАЖНЕЙШИЕ ПРИЗНАКИ ЖИВОЙ МАТЕРИИ.
Биологическая химия —наука, которая изучает химическую природу веществ, входящих в состав живых организмов, их превращения, а также связь этих превращений с деятельностью клеток, органов, тканей и организма.
Карл Нейберг (1903г.)– наука о химическом составе живых организмов, химических превращениях, протекающих в организме животных и растений
Главная задача биохимии – установление связи между молекулярной структурой и биологической функцией химических компонентов живых организмов)
ИЕРАРХИЧЕСКАЯ ОРГАНИЗАЦИЯ
Уровни организации биоты
1.Молекулярный - отражает особенности химизма живого вещества, а также механизмы и процессы передачи генной информации
2.Клеточный и субклеточный уровни - отражают особенности специализации клеток, а также внутриклеточные структуры. На этом уровне происходят процессы жизнедеятельности (обмен веществ, питание, дыхание, раздражимость и т. д.)
3.Организменный и органно-тканевый уровни - отражают признаки отдельных особей, их строение, физиологию, поведение, а также строение и функции органов и тканей живых существ
4.Популяционно-видовой - образуется свободно скрещивающимися между собой особями одного и того же вида, совокупность особей одного вида
5.Уровень биогеоценозов - структуры, состоящие из участков Земли с определенным составом живых и неживых компонентов, представляющих единый природный комплекс – экосистему
6.Биосферный - вся совокупность живых организмов Земли вместе с окружающей их природной средой
ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ
Важнейшее проявление жизни – непрекращающийся обмен веществом и энергией организма с окружающей средой Метаболизм (обмен веществ и энергии) – совокупность химических превращений веществ от момента их
поступления в клетку до выделения конечных продуктов. Обмен веществ состоит из двух противоположных, одновременно протекающих процессов:
1.Катаболизм – совокупность поэтапных ферментативных процессов расщепления сложных молекул до простых. Идет с высвобождением энергии – экзэргонический процесс.
2.Анаболизм – совокупность поэтапных ферментативных процессов построения сложных веществ из более простых предшественников. Идет с затратой энергии – эндэргонический процесс.
САМОВОСПРОИЗВЕДЕНИЕ
Самовоспроизведение – способность живого организма, его органа, ткани, клетки или клеточного органоида к образованию себе подобного
Самовоспроизведение свойственно целым организмам, отдельным их органам, тканям, клеткам, клеточным включениям и многим органеллам. Самовоспроизведение осуществляется посредством вегетативного, полового и бесполого размножений
В основе самовоспроизведения лежит образование новых молекул и структур, которое обусловлено информацией, заложенной в нуклеиновой кислоте ДНК. Самовоспроизведение тесно связано с явлением наследственности: любое живое существо рождает себе подобных, путем реализации механизма матричного синтеза ДНК.
2.МНОГОМОЛЕКУЛЯРНЫЕ СИСТЕМЫ (МЕТАБОЛИЧЕСКИЕ ЦЕПИ, МЕМБРАННЫЕ ПРОЦЕССЫ, СИСТЕМЫ СИНТЕЗА БИОПОЛИМЕРОВ, МОЛЕКУЛЯРНЫЕ РЕГУЛЯТОРНЫЕ СИСТЕМЫ) КАК ОСНОВНЫЕ ОБЪЕКТЫ БИОХИМИЧЕСКОГО ИССЛЕДОВАНИЯ.
Врамках биохимии изучаются все основные молекулярные процессы жизнедеятельности организма.
1.Метаболические цепи - процессы последовательных превращений исходного вещества, приводящие к образованию некоторого продукта.
Метаболическая цепь, состоящая из реакций, протекающих внутри одной системы– внутренней. Метаболическая цепь, реакции которой протекают в разных системах, называется межсистемной. Одно и то же вещество может участвовать в различных превращениях. В подобных случаях наблюдается пересечение различных метаболических цепей. Следствием такого пересечения является возникновение метаболической сети биологической системы.
2.Мембранные процессы – это физико-химические процессы, происходящие на поверхности клеточных мембран. К ним относят: процессы активного транспорта веществ, проведение и передача биопотенциалов, рецепция и др. Изучение природы мембранных процессов позволяет на клеточном уровне понимать характер протекающих процессов жизнедеятельности и их патологию.
3.Система синтеза биополимеров – совокупность ферментативных механизмов, которые обеспечивают воспроизведение специфических для данного организма видов высокомолекулярных соединений. Биополимеры играют важнейшую роль во всех процессах жизнедеятельности организма. Поэтому особенно важно понимать суть процессов их воспроизведения.
4.Молекулярные регуляторные системы - системы, направленные на поддержание гомеостаза. Данная системы включают в себя ряд биохимических процессов. Нарушение хотя бы одного звена в системе поддержания гомеостаза, способно вызвать изменения, которые могут привести к гибели.
3.УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ КЛЕТКИ. БИОХИМИЯ КАК МОЛЕКУЛЯРНЫЙ УРОВЕНЬ ИЗУЧЕНИЯ ЯВЛЕНИЙ ЖИЗНИ. БИОХИМИЯ И МЕДИЦИНА.
УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ КЛЕТКИ
Предшественники, поступающие из внешней среды (Аммиак, СО2, Н2О 18-44 Да)
Промежуточные соединения (Кетокислоты, рибоза, карбамоилфосфат, ацетат, малат 50-250 Да)
Строительные блоки (Аминокислоты, моносахара, жирные кислоты, мононуклеотиды 100-350 Да)
Макромолекулы (Белки, липиды, сложные углеводы, нуклеиновые кислоты 3 6 10 - 10)
Надмолекулярные комплексы (Полиферментные системы, рибосомы, сократительные системы 3 9 10 - 10)
Клеточные органеллы (Ядро, митохондрии, микросомы, лизосомы)
БИОХИМИЯ КАК МОЛЕКУЛЯРНЫЙ УРОВЕНЬ ИЗУЧЕНИЯ ЯВЛЕНИЙ ЖИЗНИ
Молекулярный уровень выступает основой для всей жизнедеятельности любого организма на планете, это уровень функционирования биологических макромолекул - биополимеров: нуклеиновых кислот, белков, полисахаридов, липидов, стероидов.
Именно на молекулярном уровне происходят различные процессы жизнедеятельности живых организмов: обмен веществ, превращение энергии, формирование биопотенциалов клетки.
С помощью молекулярного уровня осуществляется передача наследственной информации, образуются отдельные органоиды, происходят ферментативные процессы.
Биологическая химия – это наука о молекулярной сущности жизни. Она изучает химическую природу веществ, входящих в состав живых организмов, их превращения, а также связь этих превращений с деятельностью клеток, органов и тканей и организма в целом.
Биохимия занимается выяснением химических основ важнейших биологических процессов и общих путей и принципов превращений веществ и энергии, лежащих в основе разнообразных проявлений жизни, поэтому она изучает процессы, происходящие на молекулярном уровне организации живого.
БИОХИМИЯ И МЕДИЦИНА
Задачи медицинской биохимии:
Изучение химического состава и химических процессов, протекающих в больном и здоровом теле;
Разработка методов, позволяющих выявлять нарушение биохимических процессов с целью диагностики заболеваний;
Разработка основ фармакотерапии и рационального питания здорового и больного человека. Биохимические методы используется в диагностике заболеваний: например, содержание определенных ферментов в сыворотке крови может служить ценным критерием при диагностике перенесенного заболевания.
Также биохимия постепенно создает основу для рационального назначения лекарственных препаратов.
Исключительную важность представляет выяснение молекулярных механизмов некоторых заболеваний, например, серповидно-клеточной анемии или большого числа врожденных нарушений метаболизма, исследованных к настоящему времени.
4.ИСТОРИЯ ИЗУЧЕНИЯ БЕЛКОВ. ПРЕДСТАВЛЕНИЕ О БЕЛКАХ КАК ВАЖНЕЙШЕМ КЛАССЕ ОРГАНИЧЕСКИХ ВЕЩЕСТВ И СТРУКТУРНО-ФУНКЦИОНАЛЬНОМ КОМПОНЕНТЕ ОРГАНИЗМА ЧЕЛОВЕКА. ИСТОРИЯ ИЗУЧЕНИЯ БЕЛКОВ
Впервые белок был получен (в виде клейковины) в 1728 г. итальянцем Якопо Бартоломео Беккари из пшеничной муки.
Белки были выделены в отдельный класс биологических молекул в XVIII веке в результате работ французского химика Антуана де Фуркруа и других учёных, в которых было отмечено свойство белков коагулировать (денатурировать) под воздействием нагревания или кислот.
Голландский химик Геррит Мульдер на основе анализа химического состава белков выдвинул гипотезу, что практически все белки имеют сходную эмпирическую формулу. В 1836 году Мульдер предложил первую модель химического строения белков.
Вконце 1880-х гг. русский ученый А. Я. Данилевский отметил существование пептидных групп (CO—NH) в молекуле белка.
В1894 году немецкий физиолог Альбрехт Коссель сформулировал теорию, согласно которой именно аминокислоты являются основными структурными элементами белков.
Вначале XX века немецкий химик Эмиль Фишер экспериментально доказал, что белки состоят из аминокислотных остатков, соединенных пептидными связями.
Уильям Астбери в 1933 году высказал идею о том, что вторичная структура белков — результат образования водородных связей между аминокислотами.
Позднее Уолтер Каузман, опираясь на работы Кая Линдерстрём-Ланга, внёс весомый вклад в понимание законов образования третичной структуры белков и роли в этом процессе гидрофобных взаимодействий.
В1949 году Фред Сенгер определил аминокислотную последовательность инсулина, продемонстрировав таким способом, что белки — это линейные полимеры аминокислот, а не их разветвлённые (как у некоторых сахаров) цепи, коллоиды или циклолы.
Первые структуры белков, основанные на дифракции рентгеновских лучей на уровне отдельных атомов, были получены в 1960-х годах и с помощью ядерного магнитного резонанса в 1980-х годах.
ВXXI веке исследование белков перешло на качественно новый уровень, когда исследуются не только индивидуальные очищенные белки, но и одновременное изменение количества и посттрансляционных модификаций большого числа белков отдельных клеток, тканей или организмов.
ПРЕДСТАВЛЕНИЕ О БЕЛКАХ КАК ВАЖНЕЙШЕМ КЛАССЕ ОРГАНИЧЕСКИХ ВЕЩЕСТВ Белки (протеины) – высокомолекулярные азотсодержащие органические соединения, мало отличающиеся по
элементарному составу, но резко отличающиеся по химическому составу, строению, свойствам, функциям и составляющие основу всего живого.
Живая природа характеризуется рядом свойств, отличающих ее от неживой природы, и почти все эти свойства связаны с белками.
Прежде всего, для живых организмов характерны широкое разнообразие белковых структур и их высокая упорядоченность, последняя существует во времени и пространстве.
Способность живых организмов к самовоспроизведению также связана с белками (ДНК репликация). Сократимость, движение – непременные атрибуты живых систем – имеют прямое отношение к белковым структурам мышечного аппарата.
Наконец, жизнь немыслима без обмена веществ, постоянного обновления составных частей живого организма, т.е. без процессов анаболизма и катаболизма (этого удивительного единства противоположностей живого), в основе которых лежит деятельность каталитически активных белков – ферментов.
Таким образом, белки (белковые вещества) составляют основу и структуры, и функции живых организмов. Каждый организм характеризуется уникальным набором белков. Фенотипические признаки и многообразие функций обусловлены специфичностью объединения этих белков, во многих случаях в виде над- и мультимолекулярных структур, в свою очередь определяющих ультраструктуру клеток и их органелл.
ФУНКЦИИ БЕЛКОВ
•Каталитические (ферменты)
•Регуляторные (гормоны)
•Рецепторая (мембранные, цитозольные и др. рецепторы)
•Транспортные (Нb, трансферрин)
•Защитные (Ig, шапероны)
•Сократительные (актин, миозин)
•Структурные (коллаген, эластин)
•Питательные (казеин, овальбумин
5.АМИНОКИСЛОТЫ, ВХОДЯЩИЕ В СОСТАВ БЕЛКОВ, ИХ СТРОЕНИЕ И СВОЙСТВА. ПЕПТИДНАЯ СВЯЗЬ. ПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВ.
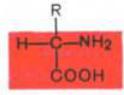
Структурными единицами (мономерами) белков являются α-аминокислоты (это АК, у которых амино- и карбоксильная группа связаны с одним и тем же α-углеродным атомом), соединённые между собой пептидными связями.
20 аминокислот, из которых построены все белки, называются протеиногенными.
СТРОЕНИЕ
α-Аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у α-углерода, замещен на аминогруппу (—NH2).

Аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка.
N-конец – начало (свободная аминогруппа);
C-конец – конец (свободная карбоксильная группа).
Классификация производных аминокислот
-2-10 аминокислотных остатков – пептид;
-10-100 аминокислотных остатков – полипептид;
-больше 100 аминокислотных остатков – белок.
СВОЙСТВА
Амфотерность, т.е. каждая аминокислота содержит как минимум одну кислотную и одну основную группы;
Кислотно-основные свойства – определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации аминокислот;
Легко растворяются в воде. Они кристаллизуются из нейтральных водных растворов в форме биполярных (амфотерных) ионов, а не в виде недиссоциированных молекул. В связи с этим, они могут проявлять как основные, так и кислотные свойства, что зависит еще от природы входящего в их состав радикала;
Оптическая активность: будучи растворенными в воде (или в НСl), они способны вращать плоскость поляризованного луча. Это свойство связано с наличием в молекуле всех природных аминокислот (за ислючением глицина) в α-положении асимметрического атома углерода (т. е. атома углерода, все четыре валентные связи которого заняты различными заместителями).
Стереохимия аминокислот. Важнейшим свойством аминокислот, освобождающихся в процессе гидролиза природных белков в условиях, исключающих рацемизацию, является их оптическая активность. Это свойство связано с наличием в молекуле всех природных аминокислот (за ислючением глицина) в α-положении асимметрического атома углерода. Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежит к L-ряду.
ПЕПТИДНАЯ СВЯЗЬ
Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты. Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки.
ПЕРВИЧНАЯ СТРУКТУРА БЕЛКОВ.
– строго определённая последовательность аминокислотных остатков, детерминированную строением ДНК.
Изменение местоположения хотя бы одной аминокислоты (или её замена, или отсутствие) приводят к изменению строения, свойств и биологической активности белка.
Закономерности первичной стуктуры:
1.Чем важнее роль белка в процессах жизнедеятельности, тем разнообразнее его аминокислотный состав (и, наоборот, чем примитивнее функция белка, тем беднее его «аминокислотная корзина»).
2.Чем важнее роль белка в процессах жизнедеятельности, тем больше сходство первичных структур гомологичных белков (гомологичные белки – белки, выполняющие одну и ту же функцию у разных видов).
3.Чем ближе расположены виды на эволюционной лестнице, тем больше сходство первичных структур
гомологичных белков. Первичная структура определяет:
-физико-химические свойства (размер, массу, растворимость, заряд и т.д.);
-все последующие уровни структурной организации белка, а следовательно:
-биологическую активность белка;
-видовую и тканевую специфичность белка.
Типы первичной структуры:
одна длинная полипептидная цепь (связи только пептидные);
две или больше коротких полипептидных цепей (связи пептидные и дисульфидные между цепями). Типы связей в первичной структуре:
пептидные;
дисульфидные (присутствуют в некоторых белках, первичная структура которых состоит из 2 и более полипептидных цепей).
Методы изучения первичной структуры белка:
1.Методы «меток» – определение концевых аминокислот (Сэнджера, Эдмана, Акабори, дансильный);
2.Гидролиз;
3.Хроматография;
4.Секвенирование.
6.ЗАВИСИМОСТЬ БИОЛОГИЧЕСКИХ СВОЙСТВ БЕЛКОВ ОТ ПЕРВИЧНОЙ СТРУКТУРЫ. ВИДОВАЯ СПЕЦИФИЧНОСТЬ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКОВ (ИНСУЛИНЫ РАЗНЫХ ЖИВОТНЫХ).
ЗАВИСИМОСТЬ БИОЛОГИЧЕСКИХ СВОЙСТВ БЕЛКОВ ОТ ПЕРВИЧНОЙ СТРУКТУРЫ
1.Первичная структура белков уникальна и детерминирована генетически. Каждый индивидуальный гомогенный белок характеризуется уникальной последовательностью аминокислот: частота замены аминокислот приводит не только к структурным перестройкам, но и к изменениям физико-химических свойств и биологических функций.
2.Стабильность первичной структуры обеспечивается в основном главновалентными пептидными связями; возможно участие небольшого числа дисульфидных связей.
3.В полипептидной цепи могут быть обнаружены разнообразные комбинации аминокислот; в полипептидах относительно редки повторяющиеся последовательности.
4.В некоторых ферментах, обладающих близкими каталитическими свойствами, встречаются идентичные пептидные структуры, содержащие неизменные (инвариантные) участки и вариабельные последовательности аминокислот, особенно в областях их активных центров. Этот принцип структурного подобия наиболее типичен для ряда протеолитических ферментов: трипсина, химотрипсина и др.
5.В первичной структуре полипептидной цепи детерминированы вторичная, третичная и четвертичная структуры белковой молекулы, определяющие ее общую пространственную конформацию.
ИНСУЛИНЫ РАЗНЫХ ЖИВОТНЫХ
Первичная структура инсулина у разных биологических видов несколько различается, как различается и его важность в регуляции обмена углеводов. Наиболее близким к человеческому является инсулин свиньи, который различается с ним всего одним аминокислотным остатком: в 30 положении B-цепи свиного инсулина расположен аланин, а в инсулине человека —треонин; бычий инсулин отличается тремя аминокислотными остаткам
7.КОНФОРМАЦИЯ ПЕПТИДНЫХ ЦЕПЕЙ В БЕЛКАХ (ВТОРИЧНАЯ И ТРЕТИЧНАЯ СТРУКТУРЫ). СЛАБЫЕ ВНУТРИМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ В ПЕПТИДНОЙ ЦЕПИ; ДИСУЛЬФИДНЫЕ СВЯЗИ.
КОНФОРМАЦИЯ ПЕПТИДНЫХ ЦЕПЕЙ В БЕЛКАХ Вторичная структура – это определенная конфигурация полипептидной цепи, стабилизированная
водородными связями (определенный вклад вносят и другие связи – пептидные и дисульфидные). При этом пептидные цепи могут приобретать регулярные структуры двух типов:
1)Альфа спираль: пептидный остов закручивается в видеспирали за счет образования водородных связей между атомами кислорода карбонильной группы и атомами азота аминогрупп, входящих в состав пептидной группы через 4 аминокислотных остатка. водородные связи ориентированных вдоль оси спирали точка на один виток спирали приходится 3, 6 аминокислотных остатка.
2)Бета структура: формируется за счет образования множества водородных связей между атомами пептидных групп линейныхобластей одной полипептидной цепи, делающий изгибы, или между разными полипептидными цепями. Бета структура образуют фигуру, подобную листу, сложенному гармошкой - складочный слой.
3)Нерегулярная вторичная структура представлена петлеобразными и кольцеобразными структурами с малой регулярностью укладки. Присутствует практически во всех белках наряду с α-спиралями и (или) β- структурами, она позволяет белковой молекуле сформировать пространственную – третичную структуру.
4)Ломаная спираль: В природе существуютбелки, строение которых, однако, не соответствует ни β-, ни α- структуре. Для коллагена вторичная структура называется ломаная спираль или транс-спираль (связи: гидрофобное взаимодействие за счетпролиновых колец).
Стабильность вторичной структуры обеспечивается в основном водородными связями (определенный вклад вносят и главновалентные связи – пептидные и дисульфидные). Водородная связь представляет собой слабое электростатическое притяжение (взаимодействие, связь) между одним электроотрицательным атомом (например, кислородом или азотом) и водородным атомом, ковалентно связанным со вторым электроотрицательным атомом.
Водородные связи, являясь нековалентными, отличаются малой прочностью. Поскольку в белковой молекуле число водородных связей очень велико (в образование водородных связей вовлечены все пептидные группы), они в сумме обеспечивают скручивание полипептидной цепи в спиральную структуру, сообщая ей компактность и стабильность.
Третичная или трёхмерная структура — пространственное строение полипептидной цепи. трехмерная пространственная структура, образующаяся за счёт взаимодействий между радикалами аминокислот, которые могут располагаться на значительном расстоянии друг от друга в полипептидной цепи
Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. Часть гидрофильных радикалов всё-таки оказывается внутри, а гидрофобные снаружи, т.е. на поверхности глобулы возникает так называемая «мозаичность» – чередование гидрофильных и гидрофобных участков.
Связи третичной структуры
1)диcульфи́дные — ковалентная связь между двумя атомами серы, входящими в состав серусодержащей аминокислоты цистеина. Образующие дисульфидную связь аминокислоты могут находиться как в одной, так и в разных полипептидных цепях белка.
2)ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
3)водородные
4)гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
5)Вандерваальсовы силы
По форме третичной структуры Фибриллярные белки: представляют собой длинные, узкие закрученные нити. В воде нерастворимы.
Примеры: коллаген (кожа, кости, зубы, сухожилия), кератин(волосы, ногти).
Глобулярные белки: имеют округлую, сферическую форму. Отчасти растворимы (образуют коллоидные растворы). Примеры: Гемоглобин (в эритроцитах), инсулин (гормон поджелудочнойжелезы), каталаза (обеспечивает распад пероксида водорода в живых клетках).
8.ОСНОВЫ ФУНКЦИОНИРОВАНИЯ БЕЛКОВ. АКТИВНЫЙ ЦЕНТР БЕЛКОВ И ЕГО СПЕЦИФИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ С ЛИГАНДОМ КАК ОСНОВА БИОЛОГИЧЕСКОЙ ФУНКЦИИ ВСЕХ БЕЛКОВ. КОМПЛЕМЕНТАРНОСТЬ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ БЕЛКА С ЛИГАНДОМ. ОБРАТИМОСТЬ СВЯЗЫВАНИЯ.
ОСНОВЫ ФУНКЦИОНИРОВАНИЯ БЕЛКОВ
Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций. Необходимое условие для функционирования белков - присоединение к нему другого вещества, "лиганда".
Лиганд – вещество, с которым взаимодействует белок при выполнении своих биологических функций.
Лигандами могут быть:
неорганические вещества (кислород, ион металла);
низкомолекулярные органические вещества (АК, липиды, витамины);
высокомолекулярные органические вещества (полисахарид, нуклеиновая кислота).
Типы лигандов:
присоединяющиесяк белку только в момент функционирования (кислород, транспортируемый гемоглобином);
постоянно связанные с белком и выполняющие вспомогательную роль при функционировании белка (железо, входящее в состав гемоглобина).
Взаимодействие белка с лигандом высокоспецифично, что определяется строением участка белка, называемого активным центром.
АКТИВНЫЙ ЦЕНТР БЕЛКОВ
Активный центр белков (центр связывания) - участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры (или четвертичной, если она есть) и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
СПЕЦИФИЧЕСКОЕ ВЗАИМОДЕЙСТВИЕ С ЛИГАНДОМ
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда.
Взаимодействие высокоизбирательно - комплиментарность взаимодействия (пространственное и химическое соответствие взаимодействующих молекул.)
Быстрое насыщение (1 лиганд - 1 АЦ)
Взаимодействие обратимо
Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
9.ДОМЕННАЯ СТРУКТУРА И ЕЁ РОЛЬ В ФУНКЦИОНИРОВАНИИ БЕЛКОВ.
Если первичная структура белка содержит более 200 аминокислотных остатков, то в третичной структуре могут выделяться самостоятельные участки – домены. Причем на одной пептидной цепи может быть два или больше доменов.
Доме́н белка́— элемент третичной структуры белка, представляющий собой достаточно стабильную и независимую подструктуру белка, чей фолдинг проходит независимо от остальных частей.
В состав домена обычно входит несколько элементов вторичной структуры. Сходные по структуре домены встречаются не только в родственных белках (например, в гемоглобинах разных животных), но и в совершенно разных белках.
Каждый домен выполняет самостоятельную функцию в общей функции белка. Например, в межклеточном веществе присутствует белок фибронектин, задача которого состоит в связывании компонентов межклеточного матрикса (коллагена, эластина, протеогликанов) между собой и с клеточными структурами. Каждый домен фибронектина взаимодействует с определёнными веществами, выполняя свою функцию.
Благодаря доменной структуре белков облегчается формирование третичной структуры.
Достаточно часто доменам присваивают отдельные названия, так как их присутствие непосредственно влияет на выполняемые белком биологической функции, к примеру, Ca2+-связывающий домен кальмодулина, гомеодомен, отвечающий за связывание с ДНК в различных факторах транскрипции. Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка.
10.ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКОВ. ОСОБЕННОСТИ СТРОЕНИЯ И ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ НА ПРИМЕРЕ ГЕМСОДЕРЖАЩЕГО БЕЛКА – ГЕМОГЛОБИНА.
Четверичная структура (или субъединичная, доменная) —способ укладки в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования.
СТРОЕНИЕ
Белки, имеющие четвертичную структуру, называются олигомерными, а каждая отдельная полипептидная цепь
– мономером, протомером или субъединицей.
Типы связей:
ионные,
водородные,
гидрофобные взаимодействия.
Субъединица – это функционально активная часть молекулы белка.
Кооперативность функционирования четвертичной структуры:
если белок имеет четвертичную структуру, то функционировать он будет при наличии всех субъединиц,
каждая субъединица влияет на остальные, усиливая их действие, например, присоединение первой молекулы кислорода к гемоглобину (тетрамеру, т.е. состоящему из четырёх протомеров), облегчает присоединение последующих таким образом, что четвёртая молекула О2 присоединяется в 450-600 раз легче первой.
Специфичность связывания протомеров за счет зависит от совокупности радикалов третичной структуры и определяется комплементарностью протомеров.
Олигомерные белки чаще построены из четного числа протомеров (от 2 до 4, реже от 6 до 8) с одинаковыми или разными молекулярными массами – от нескольких тысяч до сотен тысяч.
В молекуле белка имеются прочные (ковалентные) связи, а также слабые, что обеспечивает содной стороны стабильность молекулы, а с другой лабильность.
ФУНКЦИОНИРОВАНИЯ ОЛИГОМЕРНЫХ БЕЛКОВ НА ПРИМЕРЕ ГЕМОГЛОБИНА
Многие функциональные белки состоят из нескольких полипептидных цепей, соединенных не главновалентными связями, а нековалентными (аналогичными тем, которые обеспечивают стабильность третичной структуры).
Гемоглобин состоит из 4 протомеров: 2 α и 2 β – цепей, т.е. представляет собой тетрамер.
Четыре полипептидные цепи, соединенные вместе, образуют почти правильную форму шара, где каждая α- цепь контактирует с двумя β-цепями.
Каждая из этих цепей окружает группу гема – пигмента, придающего крови ее характерный красный цвет. Основной вклад во взаимодействие субъединиц вносят гидрофобные взаимодействия. И α, и β-цепи относятся к α-спиральному структурному классу, так как содержат исключительно α-спирали. Каждая цепь содержит восемь спиральных участков. Простетическая группа нековалентно связана с гидрофобной впадиной молекулы гемоглобина.
В определенных условиях (присутствие солей, 8М мочевины или резкие изменения рН) молекула гемоглобина обратимо диссоциирует на две α-и две β-цепи. Эта диссоциация обусловлена разрывом водородных связей. После удаления солей или мочевины происходит автоматическая ассоциация исходной молекулы гемоглобина
11.ЛАБИЛЬНОСТЬ ПРОСТРАНСТВЕННОЙ СТРУКТУРЫ БЕЛКОВ И ИХ ДЕНАТУРАЦИЯ. ФАКТОРЫ, ВЫЗЫВАЮЩИЕ ДЕНАТУРАЦИЮ.
ЛАБИЛЬНОСТЬ ПРОСТРАНСТВЕННОЙ СТРУКТУРЫ БЕЛКОВ
– способность структуры белковой молекулы претерпевать конформационные изменения под действием различных физико-химических факторов. За счет разрыва одних и образовании других слабых связей
ДЕНАТУРАЦИЯ
–процесс разрушения структурной организации белковой молекулы до первичной структуры под действием температуры, действием сильных кислот и щелочей, солей тяжелых металлов, некоторых растворителей (спирт), радиации и др. Денатурация происходит из-за разрушения слабых связей, удерживающих третичную и вторичную структуры.
При денатурации изменяются свойства белка:
o снижается растворимость белка, т.е. белок выпадает в осадок; o изменяются оптические свойства раствора;
o увеличивается вязкость раствора.
o Белок теряет биологическую активность.
oРадикалы аминокислот, формирующие активный центр белка, оказываются пространственно удаленными друг от друга, т. е. разрушается специфический центрсвязывания белка с лигандом.
oГидрофобные радикалы, обычно находящиеся в гидрофобном ядре глобулярных белков, при денатурации оказываются на поверхности молекулы, тем самым создаются условия для агрегации белков. Агрегаты белков выпадают в осадок.
В большинстве случаев денатурация –необратимый процесс.
Первичная структура при этом сохраняется, потому что она сформирована прочными ковалентными связями. Разрушение первичной структуры может произойти только в результате гидролиза белковой молекулы длительным кипячением в растворе кислоты или щелочи.
ФАКТОРЫ ДЕНАТУРАЦИИ
Высокая температура (более 50 ºС), увеличивающая тепловое движение атомов в молекуле и приводящая к разрыву слабых связей.
Интенсивное встряхивания раствора, приводящее к соприкосновению белковых молекул с воздушной средой на поверхности раздела фаз и изменению конформации этих молекул.
Органические вещества (этиловый спирт, фенол и его производные, мочевина и др.) способны взаимодействовать с функциональными группами белков, что приводит к их конформационным изменениям,
Кислоты и щелочи, изменяя pH среды, вызывают перераспределение связей в молекуле белка.
Соли тяжелых металлов (медь, ртуть, серебро, свинец и др.) образуют прочные связи с важными функциональными группами белков, изменяя их конформацию и активность,
Детергенты (например, различные мыла) – вещества, содержащие гидрофобный углеводородный радикал и гидрофильную функциональную группу, изменяют конформацию белков.
Ренатурация – процесс, обратный денатурации, при котором белки возвращают свою природную структуру.
Впробирке (in vitro) чаще всего это – необратимый процесс. Если же денатурированный белок поместить в условия, близкие к нативным, то он может ренатурировать, но очень медленно, и такое явление характерно не для всех белков.
Ворганизме, возможна быстрая ренатурация. Это связано с выработкой в живом организме специфических белков, которые «узнают» структуру денатурированного белка, присоединяются к нему с помощью слабых типов связи и создают оптимальные условия для ренатурации. Такие специфические белки известны как
«белки теплового шока» или «белки стресса».
12.ШАПЕРОНЫ – КЛАСС ЗАЩИТНЫХ БЕЛКОВ, ИХ РОЛЬ.
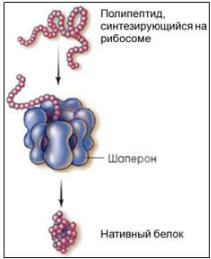
1.Участвуют в обеспечении фолдинга. Фолдинг – это процесс укладки вытянутой полипептидной цепи в правильную трехмерную пространственную структуру. Шапероны предотвращают взаимодействие новосинтезированных белков друг с другом, изолируют гидрофобные участки белков от цитоплазмы и "убирают" их внутрь молекулы, правильно располагают белковые домены.
2.Защищают белки от денатурирующий воздействий (температуры, рН,
гипоксий и пр.) Синтез шаперонов увеличивается при росте температуры, а также воздействие некоторых других экстремальных факторов. Такие шапероны называют «белками теплового шока».
3.Отслеживают конформационное состояние белка на всем протяжении жизни его молекулы, начиная с трансляции, помогают вновь синтезированной полипептидной цепи найти правильную форму, контролируют и ускоряют процесс фолдинга – образование нативной пространственной структуре.
4.Стабилизируют частично денатурированные молекулы белка, сортируя то, что еще можно спасти, переносят белки через мембраны, помогают в сборке олигомерных белков, участвуют в переключении конформации белков на активную.
13.МНОГООБРАЗИЕ БЕЛКОВ. ГЛОБУЛЯРНЫЕ И ФИБРИЛЯРНЫЕ БЕЛКИ, ПРОСТЫЕ И СЛОЖНЫЕ. КЛАССИФИКАЦИЯ БЕЛКОВ ПО ИХ БИОЛОГИЧЕСКИМ ФУНКЦИЯМ И ПО СЕМЕЙСТВАМ (СЕРИНОВЫЕ ПРОТЕАЗЫ, ИММУНОГЛОБУЛИНЫ).
До настоящего времен нет единой и стройной классификации, учитывающей различные параметры белков. В основе имеющихся классификаций обычно лежит один признак. Так, белки можно классифицировать:
1.по форме молекул (глобулярные или фибриллярные);
a)Глобулярные: имеют округлую, сферическую форму. Отчасти растворимы (образуют коллоидные растворы).
Примеры: гемоглобин (в эритроцитах), инсулин (гормон поджелудочной железы), каталаза (обеспечивает распад пероксида водорода в живых клетках).
b)Фибриллярные: представляют собой длинные, узкие закрученные нити. В воде нерастворимы.
Примеры: коллаген (кожа, кости, зубы, сухожилия), кератин (волосы, ногти).
2.по молекулярной массе (низкомолекулярные, высокомолекулярные и др.);
3.по химическому строению (наличие или отсутствие небелковой части);
a)Простые: содержат в своем составе только аминокислоты. (альбумины, глобулины, проламины, глютелины, протамины, гистоны, склеропротеины)
b)Сложные: апопротеин (белковая часть) + простетическая группа (небелковый компонент сложного белка). (: нуклеопротеины, хромопротеины, гликопротеины, фосфопротеины, липопротеины, металлопротеины)
4.по выполняемым функциям (транспортные, защитные, структурные белки и др.);
a)Каталитические (ферменты): протеазы, липазы, нулеазы.
b)Регуляторные (гормоны): соматропин, инсулин.
c)Транспортные (Hb, трансферрин).
d)Защитные (Ig, шапероны).
e)Сократительные (актин, миозин).
f)Структурные (коллаген, эластин).
g)Питательные (казеин, овальбумин).
5.по локализации в клетке (ядерные, цитоплазматические, лизосомальные и др.);
6.по локализации в организме (белки крови, печени, сердца и др.);
7.по возможности адаптивно регулировать количество данных белков: белки, синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез которых может усиливаться при воздействии факторов среды (индуцибельные);
8.по продолжительности жизни в клетке (от очень быстро обновляющихся белков, с Т1/2 менее 1 ч, до очень медленно обновляющихся белков, Т1/2 которых исчисляют неделями и месяцами);
9.по схожим участкам первичной структуры и родственным функциям (семейства белков).
Семейство – группа белков со сходной первичной структурой, функцией и трехмерной организацией, выполняющие одинаковые функции в различных органах и тканях.
a)Сериновые протеиназы – группа ферментов, катализирующих гидролиз пептидной связи (протеолиз).
Увсех сериновых протеиназ в активном центре находится остаток серина.
пищеварительные ферменты – трипсин, химотрипсин, эластаза;
ферменты системы гемостаза – тромбин, плазмин;
ферменты системы иммунитета и т.д.
b)Шапероны – семейство защитных белков, которые участвуют в обеспечении фолдинга (процесс укладки вытянутой полипептидной цепи в правильную трехмерную пространственную структуру). Также они защищают белки от денатурирующий воздействий.
c)Иммуноглобулины – семейство защитных белков, принимающих участие в иммунных реакциях. Их часто называют также антителами. У млекопитающих выделяют пять классов антител
(иммуноглобулинов) — IgG, IgA, IgM, IgD, IgE.
