
БХ Экзамен 2021
.pdf
46.ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПИРОВИНОГРАДНОЙ КИСЛОТЫ. ПОСЛЕДОВАТЕЛЬНОСТЬ РЕАКЦИЙ. СТРОЕНИЕ ПИРУВАТДЕГИДРОГЕНАЗНОГО КОМПЛЕКСА, ЭНЕРГЕТИЧЕСКИЙ ВЫХОД, РЕГУЛЯЦИЯ.
Этот вариант дыхательной цепи удлинен по сравнению с полной цепью за счет того, что первое звено катализируется не никотинамидным ферментом, а мультиферментным комплексом. Это единая надмолекулярная структура. В состав этого комплекса входят 3 фермента и 5 коферментов. Такой комплекс называется мультиферментным комплексом окислительного декарбоксилирования -кетокислот, и он окисляет два субстрата:
1. Пировиноградную кислоту (пируват, ПВК)
Окисляется с помощью ферментов пируватдегидрогеназного комплекса; 2. -кетоглутаровую кислоту ( -КГ)
Окисляется с помощью ферментов -кетоглутаратдегидрогеназного комплекса.
Оба комплекса ферментов работают одинаково. Они катализируют реакции окислительного декарбоксилирования соответствующей -кетокислоты.
ПОСЛЕДОВАТЕЛЬНОСТЬ
Процесс окислительного декарбоксилирования пирувата происходит в матриксе митохондрий. В нем принимает участие сложный мультиферментный пируватдегидрогеназный комплекс, который включает:
3 фермента (пируватдегидрогеназа, дигидролипоат-ацетилтрансфераза, дигидролипоатдегидрогеназа);
5 коферментов (ТПФ, амид липоевой кислоты, коэнзим А, ФАД и НАД), из которых три относительно прочно связаны с ферментами (ТПФ-E1, липоамид-Е2 и ФАД-Е3), а два – легко диссоциируют (HS-KoA и НАД)
СТРОЕНИЕ ПИРУВАТДЕГИДРОГЕНАЗНОГО КОМПЛЕКСА
1)Пируватдегидрогеназа (Е1, ПВК-дегидрогеназа), ее коферментом является тиаминдифосфат, катализирует 1-ю реакцию.
2)Дигидролипоат-ацетилтрансфераза (Е2), ее коферментом является липоевая кислота, катализирует 2-ю и 3-ю реакции.
3)Дигидролипоат-дегидрогеназа (Е3), кофермент ФАД,
катализирует 4-ю и 5-ю реакции.
ЭНЕРГЕТИЧЕСКИЙ ВЫХОД
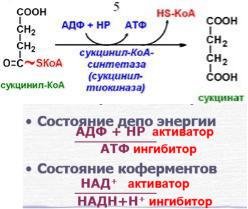
Образуются 3 молекулы АТФ путем окислительного фосфорилирования. Продукты окислительного декарбоксилирования (ацетил-КоА и сукцинил-КоА) содержат макроэргическую связь. Энергия макроэргической связи сукцинил-КоА используется двумя способами.
1)Субстратное фосфорилирование в ЦТК (так расходуется большая часть этого вещества).
2)Реакции синтеза гема (меньшая часть сукцинил-КоА).
Энергия макроэргической связи Ацетил-КоА используется только в реакциях синтеза: а) Синтез лимонной кислоты (цитрата).
б) Синтез кетоновых тел в) Синтез жирных кислот г) Синтез холестерина
Среди субстратов МтО почти нет веществ, которые организм получает с пищей - только глутаминовая кислота. Субстраты МтО - в основном органические кислоты, которые образуются в организме в процессе катаболизма. В процессе катаболизма из большого количества разнообразных пищевых веществ образуется всего 2 вида общих метаболитов: Ацетил-КоА и ПВК.
РЕГУЛЯЦИЯ
Ускорение утилизации АТФ вызывает ускорение окисления NADH и повышение концентрации NAD+. Это стимулирует окислительное декарбоксилирование пирувата. Напротив, повышение концентрации АТФ и NADH понижает скорость этого процесса. То есть каталитическая активность пируватдегидрогеназного комплекса снижается, когда в клетках имеется достаточно «топлива» в виде жирных кислот и ацетил-КоА.

47.ЦИКЛ ЛИМОННОЙ КИСЛОТЫ: ПОСЛЕДОВАТЕЛЬНОСТЬ РЕАКЦИЙ И ХАРАКТЕРИСТИКА ФЕРМЕНТОВ.. ЦИТРАТНЫЙ ЦИКЛ (Цикл лимонной кислоты, цикл Кребса, цикл трикарбоновых кислот, ЦТК)
-заключительный этап катаболизма, в котором углерод ацетильного остатка ацетил-КоА окисляется до 2 молекул СО2.
Атомы водорода, освобождающиеся в окислительно-восстановительных реакциях, доставляются в ЦПЭ при участии NAD- и FAD-зависимых дегидрогеназ, в результате чего происходят синтез воды и окислительное фосфорилирование АДФ. Связь между атомами углерода в ацетил-КоА устойчива к окислению. В условиях организма окисление ацетильного остатка происходит в несколько этапов, образующих циклический процесс из 8 реакций:
Функции ЦТК.
• Интегративная функция (объединяющая обмен белков, жиров и углеводов через образование ацетил-КоА).
• Водородгенерирующая функция – образуется 4 пары протонов Н+.
• Энергетическая функция – образуется 1 молекула АТФ между сукцинил-КоА и сукцинат (субстратное фосф)
• Анаболическая (пластическая) – метаболиты ЦТК используются для синтеза других веществ: ЦТК играет важную роль в процессах анаболизма (промежуточные продукты ЦТК):
-из цитрата -------> синтез жирных кислот
-из aльфа-кетоглутарата и ЩУК ---------> синтез аминокислот
-из ЩУК ----------> синтез углеводов
-из сукцинил-КоА -----------> синтез гема гемоглобина
-ацетил-КоА – в синтезе холестерина и его производных (желчных кислот, стероидных гормонов, провитамина Д3), высших жирных кислот, кетоновых тел, ацетилхолина и др;
-α-кетоглутаровая кислота – глутаминовая, глутамин, ГАМК, пролин, аргинин;
-сукцинил-КоА – гем;
-СО2 – глюкоза, высшие жирные кислоты, пуриновые и пиримидиновые нуклеотиды;
-фумаровая кислота – в синтезе мочевины;
-ЩУК – аспарагиновая кислота, аспарагин, глюкоза, метионин, треонин.
ПОСЛЕДОВАТЕЛЬНОСТЬ РЕАКЦИЙ
СВЯЗЬ МЕЖДУ ОБЩИМИ ПУТЯМИ КАТАБОЛИЗМА И ЦЕПЬЮ ПЕРЕНОСА ЭЛЕКТРОНОВ И ПРОТОНОВ
При окислении субстрата в общих путях катаболизма происходит восстановление коферментов, которые затем окисляются в дыхательной цепи, то есть сбрасывают протоны и электроны в дыхательную цепь:
-НАД на первичный акцептор (НАД зависимая дегидрогеназа) – 3 молекулы АТФ;
-ФАД на вторичный акцептор (ФАД зависимая дегидрогеназа) – 2 молекулы АТФ.
Энергетический баланс ЦТК.
Субстраты ЦТК: изоцитрат, α-кетоглутарат и малат отдают протоны и электроны на НАД-зависимые дегидрогеназы, которые транспортируют протоны и электроны в ЦПЭ на I комплекс, следовательно протоны и электроны проходят все три пункта сопряжения (I, III, IV комплексы). Коэффициент окислительного фосфорилирования для:
-изоцитрат – 3/1=3АТФ;
-α-кетоглутарат – 3/1=3АТФ; 9АТФ в ЦПЭ
-малат – 3/1=3АТФ
Субстрат ЦТК: сукцинат отдает протоны и электроны на сукцинат-фумарат-дегидрогеназу (II комплекс), которая переносит протоны и электроны на убихинон, минуя I комплекс ЦПЭ, следовательно, электроны проходят два пункта сопряжения (III, IV комплексы).
Коэффициент окислительного фосфорилирования для сукцинат – 2/1=2АТФ.
Между сукцинил-КоА и сукцинат образуется 1 молекула АТФ (субстратное фосфорилирование).
Энергетический баланс ЦТК= 9АТФ (ЦПЭ) + 2АТФ (ЦПЭ) + 1АТФ (субстратное фосфорилирование) = 12 молекул АТФ.
48.МЕХАНИЗМЫ РЕГУЛЯЦИИ ЦИТРАТНОГО ЦИКЛА. АНАБОЛИЧЕСКИЕ ФУНКЦИИ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ. РЕАКЦИИ, ПОПОЛНЯЮЩИЕ ЦИТРАТНЫЙ ЦИКЛ.
АВТОНОМНАЯ САМОРЕГУЛЯЦИЯ ЦТК
В ЦТК два ключевых фермента:
1)цитратсинтаза (1-я реакция)
2)изоцитратдегидрогеназа (3-я реакция)
Оба фермента аллостерически ингибируются избытком АТФ и НАДН2. Изоцитратдегидрогеназа сильно активируется АДФ. Если АДФ нет, то этот фермент неактивен. В условиях энергетического покоя концентрация АТФ увеличивается, и скорость реакций ЦТК мала - синтез АТФ уменьшается.
Изоцитратдегидрогеназа ингибируется АТФ намного сильнее, чем цитратсинтаза, поэтому в условиях энергетического покоя повышается концентрация цитрата, и он выходит в цитоплазму по градиенту концентраций путем облегченной диффузии. В цитоплазме цитрат превращается в Ацетил-КоА, который участвует в синтезе жирных кислот.
Регуляция ЦТК:
Аллостерицеская регуляция:
-цитратсинтетаза (первая реакция);
-изоцитратдегидрогеназа (третья реакция).
Эти ферменты имеют аллостерический центр. С помощью активаторов и ингибиторов происходит изменения их активности.
-активаторы: НАД+, АМФ, АДФ;
-ингибиторы: НАДН+Н+, АТФ.
Состояние депо энергии:
-АДФ + НР – Активатор;
-АТФ – ингибитор.
Состояние коферментов:
-Окисленные коферменты (НАД+ и ФАД) – активатор;
-Восстановленные коферменты (НАДН+Н+, ФАДН2) – ингибитор.
Проницаемость мембран митохондрий.
РЕАКЦИИ, ПОПОЛНЯЮЩИЕ ЦИТРАТНЫЙ ЦИКЛ.
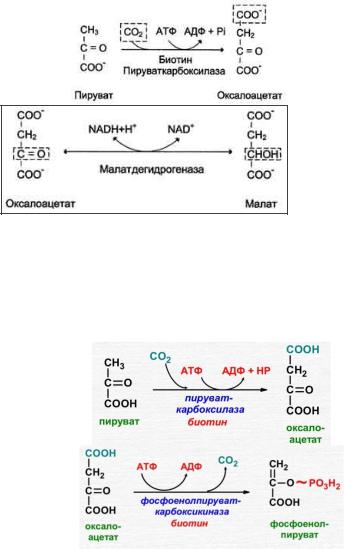
Реакция трансаминирования – аспартата в оксалоацетат (аминокислота в кетокислоту).
Реакция карбоксилирования – пируват в оксалоацетат (кофермент – биотин).
Реакция карбоксилирования – фосфоенолпируват в оксалоацетат.
49.ОСНОВНЫЕ УГЛЕВОДЫ ЖИВОТНЫХ, ИХ СОДЕРЖАНИЕ В ТКАНЯХ, БИОЛОГИЧЕСКАЯ РОЛЬ. ОСНОВНЫЕ УГЛЕВОДЫ ПИЩИ. ПЕРЕВАРИВАНИЕ УГЛЕВОДОВ.
ОСНОВНЫЕ УГЛЕВОДЫ ЖИВОТНЫХ
Веществами, широко распространенными в природе, являются углеводы, поступающие в организм человека в составе животной и растительной пищи в форме
полимеров (крахмал, гликоген, целлюлоза),
дисахаридов (лактоза, сахароза) - 2-10 мономеров в составе
моносахаридов (глюкоза, фруктоза, пентозы).
—по структуре альдегидоили кетоспирты (обладают восстанав-ливающими свойствами и выполняют целый ряд жизненно важных функций)
БИОЛОГИЧЕСКАЯ РОЛЬ
1)1—основной источник энергии в организме человека. 60% энергетических затрат взрослого человека и 40%
– ребенка покрываются за счет аэробного и анаэробного окисления углеводов. При окислении 1 грамма углеводов выделяются 4,1 ккал энергии и 0,4 г воды.
2)2— резервная форма энергии. Полисахарид гликоген за счет высокополимерной, разветвленной структуры молекулы способен концентрировать значительные количества энергии в печени и мышцах, не обладая при этом осмотическим эффектом. Участвуют в построении АТФ, ДНК и РНК
3)3—структурная роль, т. к. глюкозоаминогликаны являются структурными компонентами соединительной ткани, обеспечи-вая ее прочность, упругость и нормальную проницаемость.
4)4—защитную функцию. Гликопротеины входят в состав муцинов и мукоидов, являются факторами групповой принадлежности крови, участвуют в поддержании иммунитета, входят в состав клеточных рецепторов.
5)5—регуляторные функции, поскольку входят в состав таких соединений как нуклеотидные коферменты, нуклеиновые кислоты, гормоны. многие олигосахариды входят в состав воспринимающей части клеточных рецепторов или молекул-лигандов.
6)6 —участвуют в обеспечении осмотического давления и осморегуляции. Так, в крови содержится 100—110 мг/% глюкозы. От концентрации глюкозы зависитосмотическое давление крови.
ОСНОВНЫЕ УГЛЕВОДЫ ПИЩИ
I.У человека углеводы присутствуют в меньших количествах (2%).
II.В растительных организмах на долю углеводов приходится до 20% сухой массы тела. III. Суточная потребность 400-450 грамм в сутки(в 3-4 раза больше Б и Ж)
IV. С пищей в организм поступают дисахариды сахароза, лактоза, мальтоза, фруктоза. ГЛИКОГЕН – главный резервный полисахарид высших животных и человека, построенный из остатков D-глюкозы.
Эмпирическая формула гликогена, как и крахмала, (С6Н10О5)n. (существует в туатомерах-цикл, цепь)
содержится практически во всех органах и тканях животных и человека; наибольшее количество обнаружено в печени и мышцах.
Молекулярная масса гликогена 105–108 Да и более. Его молекула построена из ветвящихся полиглюкозидных цепей, в которых остатки глюкозы соединены α-1–>4-гликозидными связями. В точках ветвления имеются α-1– >6-гликозидные связи. По строению гликоген близок к амилопектину. В молекуле гликогена различают внутренние ветви – участки от периферической точки ветвления до нередуцирующего конца цепи. Гликоген характеризуется более разветвленной структурой, чем амилопектин; линейные отрезки в молекуле гликогена включают 11–18 остатков α-D-глюкопиранозы.
При гидролизе гликоген, подобно крахмалу, расщепляется с образованием сначала декстринов, затем мальтозы и, наконец, глюкозы.
КРАХМАЛ - наиболее важный углеводный компонент пищевого рациона резервный полисахарид растений, содержащийся в наибольшем количестве (до 45% от массы сухого
вещества) в зёрнах злаков (пшеница, кукуруза, рис и др.), а также луковицах, стеблях и клубнях растений (в картофеле примерно 65%).
разветвлённый полисахарид, состоящий из остатков глюкозы (гомогликан)
находится в клетках растений в виде гранул, практически нерастворим в воде
состоит из амилозы и амилопектина. Амилоза - неразветвлённый полисахарид, включающий 200-300 остатков глюкозы, связанных α-1,4-гликозидной связью. Благодаря α-конфигурации глюкозного остатка, полисахаридная цепь имеет конформацию спирали. Синяя окраска при добавлении йода к раствору крахмала обусловлена наличием такой спирали. Амилопектин имеет разветвлённую структуру. В местах ветвления остатки глюкозы соединены α-1,6-гликозидными связями. Линейные участки содержат примерно 20-25 остатков глюкозы. При этом формируется древовидная структура, в которой имеется лишь одна аномерная ОН-группа
высокомолекулярное соединение, включающее сотни тысяч остатков глюкозы. Его молекулярная масса составляет порядка 105-108 Д.
ПЕРЕВАРИВАНИЕ УГЛЕВОДОВ
Пищеварение углеводов можно разделить на несколько этапов:
Пищеварение, происходящее в полости рта
Пищеварение в желудке
Пищеварение и всасывание в тонком кишечнике.
Эпителиальные клетки кишечника способны всасывать только моносахариды. Поэтому процесс переваривания заключается в ферментативном гидролизе гликозидных связей в углеводах, имеющее олигоили полисахаридное строение.
Переваривание углеводов в полости рта
В полости рта начинается расщепление крахмала (и гликогена) под действием фермента слюны — амилазы. Известны 3 вида амилаз, которые различаются главным образом по конечным продуктам их ферментативного действия:
α-амилаза
β-амилаза
γ-амилаза
α-Амилаза (КФ 3.2.1.1) расщепляет в полисахаридах внутренние α-1,4-связи, поэтому её иногда называют эндоамилазой. Молекула α-амилазы содержит в своих активных центрах ионы Ca2+ необходимые для ферментативной активности. Кроме того, характерной особенностью α-амилазы животного происхождения является способность активироваться одновалентными анионами. Прежде всего Сl-.
Слюнная α-амилаза представляет собой смесь близких электрофоретически разделяемых изоферментов. Каждый из них — одноцепочечный полипептид (мол. масса 56000 Да), к которому присоединен олигосахарид. Структура этого олигосахарида, а также число его молекул на одну молекулу белка и способ прикрепления к белку неизвестны. Удивительно, что не существует соответствующих ферментов в слюне некоторых приматов, например у бабуинов или резусов.
В ротовой полости не может происходить полное расщепление крахмала, так как действие фермента на крахмал кратковременно. Кроме того, амилаза слюны не расщепляет α- 1,6-гликозидные связи (связи в местах разветвлений), поэтому крахмал переваривается лишь частично с образованием крупных фрагментов — декстринов и небольшого количества мальтозы. Следует отметить, что амилаза слюны не гидролизует гликозидные связи в дисахаридах.

Под действием β-амилазы от крахмала отщепляется дисахарид мальтоза, то есть β-амилаза является экзоамилазой. Она обнаружена у высших растений где играет важную роль в мобилизации резервного (запасного) крахмала.
γ-амилаза отщепляет один за другим глюкозные остатки от конца полигликозидной цепочки. Различают 2 вида γ-амилаз: кислые и нейтральные, в зависимости от того в какой области pH они проявляют максимальную активность. В органах и тканях человека и млекопитающих кислая γ-амилаза локализована в лизосомах, а нейтральная — в микросомах и гиалоплазме. Амилаза слюны является α-амилазой. Под влиянием этого фермента происходят первые фазы распада крахмала (или гликогена) с образованием декстринов (в небольшом количестве образуется и мальтоза).
Желудок
Желудочный сок не содержит ферментов расщепляющие сложные углеводы (например целлюлозу). В желудке действие α-амилазы слюны прекращается так как желудочное содержимое имеет очень кислую среду (pH 1,5
— 2,5). Однако в более глубоких слоях пищевого комка, куда не сразу проникает желудочный сок, действие амилазы некоторое время продолжается и происходит расщепление полисахаридов с образованием декстринов и мальтозы. Наиболее важная фаза распада крахмала (или гликогена) протекает в двенадцатиперстной кишке под действием α-амилазы поджелудочного сока. Здесь pH возрастает до нейтральных значений, при этих условиях α-амилаза панкреатического сока обладает почти максимальной активностью. Этот фермент завершает превращение крахмала и гликогена в мальтозу, начатое амилазой слюны.
Переваривание углеводов в кишечнике
Расщепление крахмала и гликогена до мальтозы в кишечнике происходит под действием 3-х ферментов:
панкреатической α-амилазы
амило-1,6-глюкозидазы
олиго-1,6-глюкозидазы
Образующаяся мальтоза оказывается только временным продуктом, так как она быстро гидролизуется под влиянием фермента мальтазы (α-глюкозидазы) на 2 молекулы глюкозы. Кишечный сок также содержит активную сахаразу, под действием которой образуются глюкоза и фруктоза.
Всасывание моносахаридов в кишечнике (нарушениемальабсорбция)
Моносахариды образовавшиеся в результате переваривания, всасываются эпителиальными клетками тощей и подвздошной кишок с помощью специальных механизмов транспорта через мембраны клеток.
Активный транспорт: глюкоза и Na+ проходят через мембраны с люминальной стороны, связываясь с разными участками белка-переносчика. При этом Na+ поступает в клетку по градиенту концентрации, и одновременно глюкоза транспортируется против градиента концентрации (вторично-активный транспорт). Следовательно, чем больше градиент Na+, тем больше поступление глюкозы в энтероциты. Если концентрация Na+ во внеклеточной жидкости уменьшается, транспорт глюкозы снижается. Градиент концентрации Na+, являющийся движущей силой активного сим-порта, создаётся работой Nа+, К+-АТФ-азы. Перенос в клетки слизистой оболочки кишечника по механизму вторично-активного транспорта характерен также для галактозы. При разной концентрации глюкозы в просвете кишечника «работают» различные механизмы транспорта. Благодаря активному транспорту эпителиальные клетки кишечника могут поглощать глюкозу при её очень низкой концентрации в просвете кишечника. Если же концентрация глюкозы в просвете кишечника велика, то она может транспортироваться в клетку путём облегчённой диффузии. Таким же способом может всасываться и фруктоза. Следует отметить, что скорость всасывания глюкозы и галактозы гораздо выше, чем других моносахаридов.
Облегченная диффузия: после всасывания моносахариды (главным образом, глюкоза) покидают клетки слизистой оболочки кишечника через мембрану, обращённую к кровеносному капилляру, с помощью облегчённой диффузии. Часть глюкозы (более половины) через капилляры кишечных ворсинок попадает в кровеносную систему и по воротной вене доставляется в печень. Остальное количество глюкозы поступает в клетки других тканей.
Транспорт глюкозы в клетки

50.ГЛЮКОЗА КАК ВАЖНЕЙШИЙ МЕТАБОЛИТ УГЛЕВОДНОГО ОБМЕНА. ОБЩАЯ СХЕМА ИСТОЧНИКОВ И ПУТЕЙ РАСХОДОВАНИЯ ГЛЮКОЗЫ В ОРГАНИЗМЕ.
ГЛЮКОЗА КАК ВАЖНЕЙШИЙ МЕТАБОЛИТ УГЛЕВОДНОГО ОБМЕНА
Основным углеводом, участвующим в метаболизме, является глюкоза. Центральная роль молекулы глюкозы в углеводном обмене обусловлена:
1.Высокой растворимостью глюкозы.
2.Наличием реакционно-способной карбонильной группы в молекуле.
3.Оптимальной стабильностью пиранозного кольца.
Источники глюкозы для организма:
–животная и растительная пища;
–собственные резервные полисахариды (гликоген);
–другие моносахара (взаимопревращения);
–гликонеогенез (синтез глюкозы из неуглеводов). Пути расходования глюкозы:
–анаэробное и аэробное окисление в тканях –
60-65%;
–превращение в липиды – 30%;
–синтез гликогена – 3%;
–превращения в другие моносахара – 5-7%. Катаболизм глюкозы:
–дихотомический распад – анаэробный гликолиз и аэробное окисление;
–апотомическое окисление – пентозофосфатный путь.
Поскольку в составе основных углеводов пищи преобладает глюкоза, её можно считать основным продуктом переваривания углеводов. Другие моносахариды, поступающие из кишечника в процессе метаболизма, могут превращаться в глюкозу или продукты её метаболизма. Часть глюкозы в печени депонируется в виде гликогена, а другая часть через общий кровоток доставляется и используется разными тканями и органами.
Глюкоза является альдогексозой. Она может существовать в линейной и циклической формах. Циклическая форма глюкозы, предпочтительная в термодинамическом отношении, обусловливает химические свойства глюкозы. Как и все гексозы, глюкоза имеет 4 асимметричных углеродных атома, обусловливающих наличие стереоизомеров. Возможно образование 16 стереоизомеров, наиболее важные из которых D- и L-глюкоза. Эти типы изомеров зеркально отображают друг друга. Расположение Н- и ОН-групп относительно пятого углеродного атома определяет принадлежность глюкозы к D- или L-ряду. В организме млекопитающих моносахариды находятся в D-конфигурации, так как к этой форме глюкозы специфичны ферменты, катализирующие её превращения. В растворе при образовании циклической формы моносахарида образуются ещё 2 изомера (α- и β-изомеры), называемые аномерами, обозначающие определённую конформацию Н- и
ОН-групп относительно С, У α-D-глюкозы ОН-группа располагается ниже плоскости кольца, а у β-D-глюкозы, наоборот, над плоскостью кольца.
ОБЩАЯ СХЕМА ИСТОЧНИКОВ И ПУТЕЙ РАСХОДОВАНИЯ ГЛЮКОЗЫ В ОРГАНИЗМЕ
КАТАБОЛИЗМ ГЛЮКОЗЫ.
Окисление глюкозы до СО2 и Н2О (аэробный распад). Этот процесс включает несколько стадий:
Аэробный гликолиз — процесс окисления глюкозы с образованием двух молекул пирувата;
Общий путь катаболизма, включающий превращение пирувата в ацетил-КоА и его дальнейшее окисление в цитратном цикле;
ЦПЭ на кислород, сопряжённая с реакциями дегидрирования, происходящими в процессе распада глюкозы Обеспечение кислородом тканей может не
соответствовать их потребностям. Например, на начальных стадиях интенсивной мышечной работы при стрессе сердечные сокращения могут не достигать нужной частоты, а потребности мышц в кислороде для аэробного распада глюкозы велики. В подобных случаях включается процесс, который протекает без кислорода и заканчивается образованием лактата из пировиноградной кислоты. Анаэробный распад глюкозы энергетически мало эффективен, но именно этот процесс может стать единственным источником энергии для мышечной клетки в описанной ситуации.
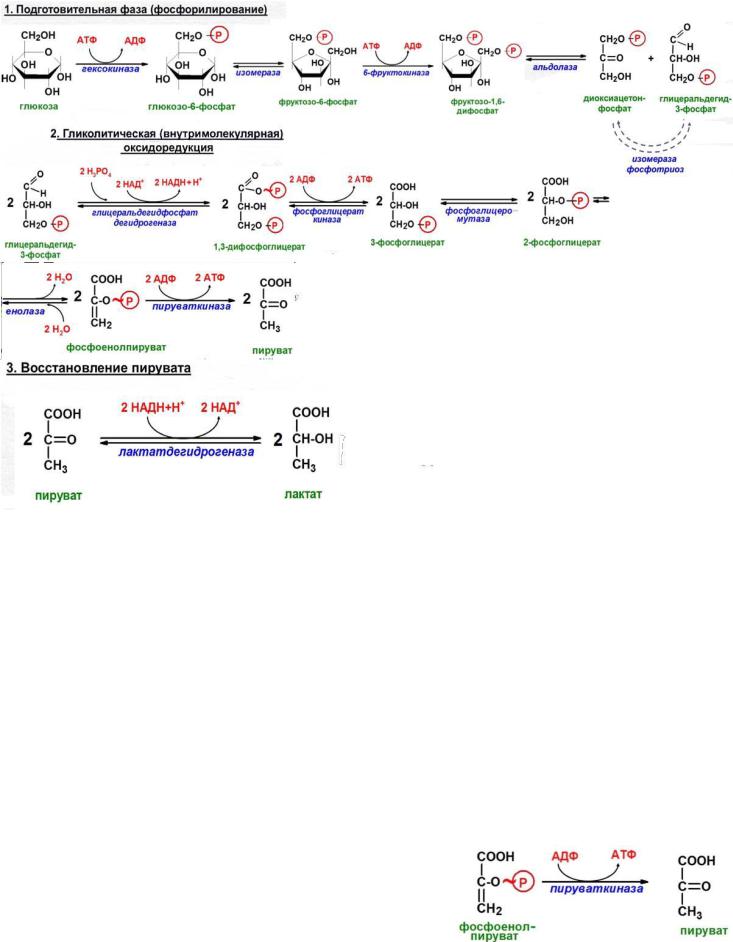
51.АНАЭРОБНЫЙ РАСПАД ГЛЮКОЗЫ (АНАЭРОБНЫЙ ГЛИКОЛИЗ). ГЛИКОЛИТИЧЕСКАЯ ОКСИДОРЕДУКЦИЯ, ПИРУВАТ КАК АКЦЕПТОР ВОДОРОДА. СУБСТРАТНОЕ ФОСФОРИЛИРОВАНИЕ. РАСПРОСТРАНЕНИЕ И ФИЗИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ЭТОГО ПУТИ РАСПАДА ГЛЮКОЗЫ.
АНАЭРОБНЫЙ ГЛИКОЛИЗ
Реакции анаэробного гликолиза При анаэробном гликолизе в цитозоле протекают все 10 реакций, идентичных аэробному гликолизу. Лишь 11-я реакция, где происходит восстановление пирувата цитозольным NADH, является специфической для анаэробного гликолиза. Восстановление пирувата в лактат катализирует лактатдегидро-геназа (реакция обратимая, и фермент назван по обратной реакции). С помощью этой реакции обеспечивается регенерация NAD+ из NADH без участия митохондриальной дыхательной цепи в ситуациях, связанных с недостаточным снабжением клеток кислородом. Роль акцептора водорода от NADH (подобно кислороду в дыхательной цепи) выполняет пируват. Таким образом, значение реакции восстановления пирувата заключается не в образовании лактата, а в том, что данная цитозольная реакция обеспечивает регенерацию NAD+. К тому же лактат не является конечным продуктом метаболизма, удаляемым из организма. Это вещество выводится в кровь и утилизируется, превращаясь в печени в глюкозу, или при доступности кислорода превращается в пируват, который вступает в общий путь катаболизма, окисляясь до СО2 и Н2О
Локализация:
1)В эритроцитах гликолиз – единственный путь получения энергии АТФ, поскольку в них отсутствуют митохондрии, а аэробные окислительные процессы идут только в митохондриях.
2)В интенсивно работающей скелетной мышце, особенно на начальных этапах нагрузки или при длительной работе мышцы.
3)В головном мозге примерно 13-15% всей глюкозы окисляется анаэробно, но, в целом, анаэробный гликолиз для нервной ткани – «аварийный» путь.
4)В клетках злокачественных опухолей глюкоза окисляется анаэробно.
5)Преимущественно за счет анаэробного гликолиза обеспечиваются энергией сетчатка глаза, мозговое вещество надпочечников.
СУБСТРАТНОЕ ФОСФОРИЛИРОВАНИЕ
– образование АТФ из высокоэнергетических соединений. Субрстратное фосфорилирование с использованием макроэргических эфиров фосфорной кислоты имеет место в гликолизе, происходящем в цитозоле:
Также, субстратное фосфорилирование присутствует в цикле трикарбоновых кислот (образование ГТФ):
РАСПРОСТРАНЕНИЕ И ФИЗИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
Неэкономный, но в бескислородных условиях единственный способ получения полезной энергии для Эритроцитов, сетчатки, коры надпочечников
Поставщик субстратов в реакции аэробного окисления
Путь, обеспечивающий взаимосвязь аэробного и анаэробного окисления и всех видов метаболизма
Энергетика:
На стадии фосфорилирования расходуется 2 АТФ. На стадии оксидоредукции образуется 4 АТФ. Окончательный выход энергии составляет 2 АТФ.
Физиологическое значение процесса:
единственный способ получения энергии в бескислородных условиях;
поставщик субстратов в реакции аэробного окисления;
обеспечивает взаимосвязь аэробного и анаэробного окисления и всех видов метаболизма
52.БИОСИНТЕЗ ГЛЮКОЗЫ (ГЛЮКОНЕОГЕНЕЗ) ИЗ АМИНОКИСЛОТ, ГЛИЦЕРИНА И МОЛОЧНОЙ КИСЛОТЫ. ВЗАИМОСВЯЗЬ ГЛИКОЛИЗА В МЫШЦАХ И ГЛЮКОНЕОГЕНЕЗА В ПЕЧЕНИ (ЦИКЛ КОРИ).
ГЛЮКОНЕОГЕНЕЗ
Гликонеогенез – процесс синтеза глюкозы из неуглеводов (лактат, пируват, глицерин) за счет обратимости действия большинства ферментов гликолиза (за исключением трех «киназных барьеров», которые преодолеваются при помощи обходных путей и катализируются ключевыми ферментами гликонеогенеза).
Активаторами гликонеогенеза являются глюкокортикоиды.
Максимальное голодание12 часов Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и
интенсивных физических нагрузок. Процесс протекает в основном в печени и менее интенсивно в корковом веществе почек, а также в слизистой оболочке кишечника. Эти ткани могут обеспечивать синтез 80-100 г глюкозы в сутки. На долю мозга при голодании приходится большая часть потребности организма в глюкозе. Это объясняется тем, что клетки мозга не способны, в отличие от других тканей, обеспечивать потребности в энергии за счёт окисления жирных кислот .Кроме мозга, в глюкозе нуждаются ткани и клетки, в которых аэробный путь распада невозможен или ограничен, например эритроциты (они лишены митохондрий), клетки сетчатки, мозгового слоя надпочечников и др. Первичные субстраты глюконеогенеза - лактат, аминокислоты и глицерол. Включение этих субстратов в глюконеогенез зависит от физиологического состояния организма.
Лактат - продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Таким образом, лактат используется в глюконеогенезе постоянно. При гликонеогенезе на каждую молекулу лактата расходуется три молекулы АТФ, по скольку для образования глюкозы необходимы две молекулы лактата, то суммарный процесс окисления описывается так: 2 лактат + 6АТФ+6Н2О=глюкоза+6Н3РО4+6АДФ. Цикл кори обеспечивает утилизацию лактата, предотвращает накопление лактата.
Глицерол высвобождается при гидролизе жиров в жировой ткани в период голодания или при длительной физической нагрузке.
Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе.
Большинство реакций глюконеогенеза протекает за счёт обратимых реакций гликолиза и катализируется теми же ферментами. Однако 3 реакции гликолиза термодинамически необратимы. На этих стадиях реакции глюконеогенеза протекают другими путями. Необходимо отметить, что гликолиз протекает в цитозоле, а часть реакций глюконеогенеза происходит в митохондриях.
1. Образование фосфоенолпирувата из пирувата
происходит в ходе двух реакций первая из которых протекает в митохондриях. Пируват, образующийся из лактата или из некоторых аминокислот, транспортируется в матрикс митохондрий и там карбоксилируется с образованием оксалоацетата. Пируват-карбоксилаза, катализирующая данную реакцию, - митохондриальный фермент, коферментом которого является биотин. Реакция протекает с использованием АТФ.
Дальнейшие превращения оксалоацетата протекают в цитозоле. Следовательно, на этом этапе должна существовать система транспорта оксалоацетата через митохондриальную мембрану, которая для него непроницаема. Оксалоацетат в митохондриальном
матриксе восстанавливается с образованием малата при участии NADH (обратная реакция цитратного цикла). Образовавшийся малат затем проходит через митохондриальную мембрану с помощью специальных переносчиков. Кроме того, оксалоацетат способен транспортироваться из митохондрий в цитозоль в виде аспартата в ходе малат-аспартатного челночного механизма. В цитозоле малат вновь превращается в оксалоацетат в ходе реакции окисления с участием кофермента NAD+. Обе реакции: восстановление оксалоацетата и окисление малага катализируют малатдегидрогеназа, но в первом случае это митохондриальный фермент, а во втором - цитозольный. Образованный в цитозоле из малата оксалоацетат затем превращается в фосфоенолпируват в ходе реакции, катализируемой фосфоенолпируваткарбоксикиназой - ГТФ-зависимым ферментом.
1.Пируваткиназный барьер – 1-я реакция. Пируват под влиянием пируваткиназы и при участии СО2 и АТФ карбоксилируется с образованием оксалоацетата.
2.Пируваткиназный барьер – 2-я реакция. Оксалоацетат в результате декарбоксилирования и фосфорилирования по влиянием фермента фосфоенолпируваткарбоксилазы превращается в фосфоенолпируват. Донором фосфатного остатка в реакции служит гуанозинтрифосфат (ГТФ).
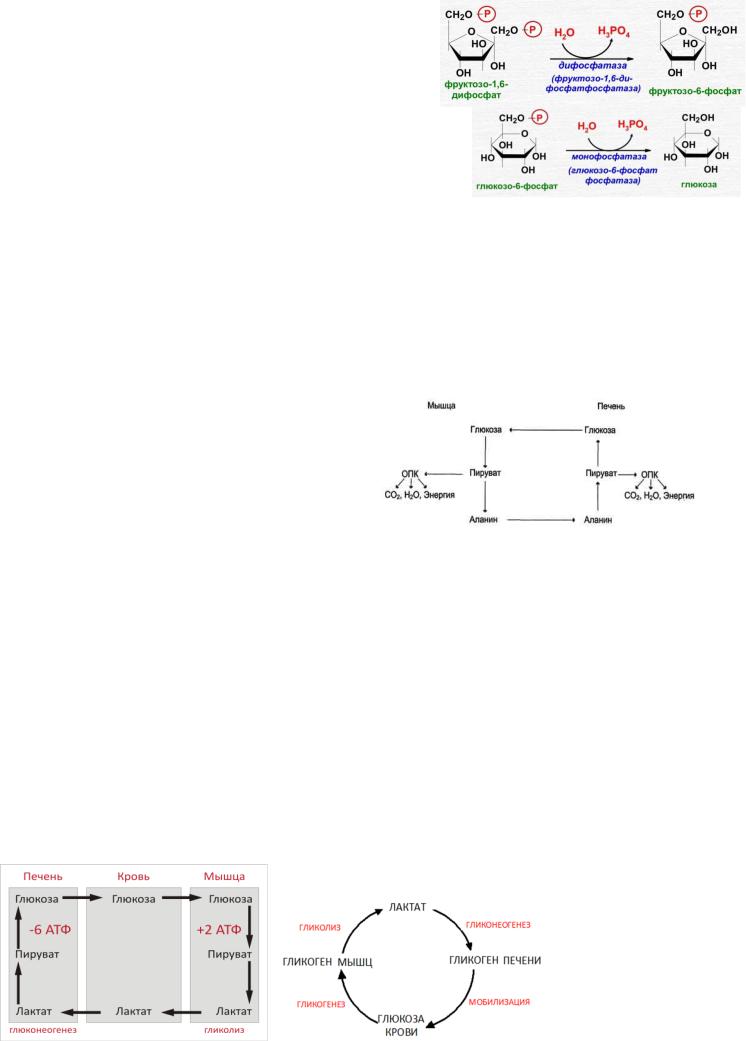
3.Фруктокиназный барьер. Фосфоенолпируват в результате ряда обратимых реакций гликолиза превращается во фруктозо-1,6-бисфосфат. Далее следует фосфофруктокиназная реакция, которая необратима. Глюконеогенез идет в обход этой эндергонической реакции. Превращение фруктозо-1,6-бис- фосфата во фруктозо-6-фосфат катализируется специфической фосфатазой.
4.Глюкокиназный барьер. Фруктозо-6-фосфат превращается в глюкозо-6-фосфат. Последний может дефосфорилироваться (т.е. реакция идет в обход гексокиназной реакции) под влиянием фермента глюкозо-6- фосфатазы.
2.Образование глюкозы из лактата. Лактат, образовавшийся в интенсивно работающих мышцах или в клетках с преобладающим анаэробным способом катаболизма глюкозы, поступает в кровь, а затем в печень. В печени отношение NADH/NAD+ ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в обратном направлении, т.е. в сторону образования пирувата из лактата. Далее пируват включается в глюконеогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами. Эту последовательность событий называют "глюкозо-лактатным циклом", или "циклом Кори".
Функции:
1- обеспечивает утилизацию лактата;
2- предотвращает накопление лактата и, как следствие этого, опасное снижение рН (лактоацидоз). Часть пирувата, образованного из лактата, окисляется печенью до СО2 и Н2О. Энергия окисления может использоваться для синтеза АТФ, необходимого для реакций глюконеогенеза.
3.Образование глюкозы из аминокислот.
Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, окса-лоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что
при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах. Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.
4. Образование глюкозы из глицерола. Глицерол образуется при гидролизе триацил-глицеролов, главным образом в жировой ткани. Использовать его могут только те ткани, в которых имеется фермент глицерол киназа, например печень, почки. Этот АТФ-зависимый фермент катализирует превращение глицерола в α-глицерофосфат (глицерол-3-фосфат). При включении глицерол-3-фосфата в глюконеогенез происходит его дегидрирование NAD-зависимой дегидрогеназой с образованием дигидроксиацетонфосфата, который далее превращается в глюкозу.
ВЗАИМОСВЯЗЬ ГЛИКОЛИЗА В МЫШЦАХ И ГЛЮКОНЕОГЕНЕЗА В ПЕЧЕНИ
при максимальной активности мышц в результате усиления гликолиза образуется избыток молочной кислоты, диффундирующей в кровь, в печени значительная ее часть превращается в глюкозу (глюконеогенез). Такая глюкоза затем может быть использована как энергетический субстрат, необходимый для деятельности мышечной ткани.
ЦИКЛ КОРИ – совокупность биохимических ферментативных процессов транспорта лактата из мышц в печень, и дальнейшего синтеза глюкозы из лактата, катализируемое ферментами глюконеогенеза.
