
лекции Астахова
.pdf
Физико-химические свойства белков:
1)Форма молекул;
2)Молекулярная масса;
3)Суммарный заряд;
4)Растворимость;
5)Изоэлектрическая точка
Растворимость белков зависит от суммарного заряда
иобщего количества полярных групп:
1.Растворимость белка тем больше, чем больше суммарный заряд.
2.Если у двух белков одинаковый суммарный заряд, то растворимость больше у того белка, у которого больше полярных групп.
Также на растворимость белков влияет pH среды, присутствие солей в растворе и др.
Изоэлектрическая точка белка (pI) – это такое
значение pH, при котором суммарный заряд белка равен нулю.
В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково.
Если суммарный заряд белка в нейтральной среде то pI < 7.
Если суммарный заряд белка в нейтральной среде то pI > 7.
Если суммарный заряд белка в нейтральной среде = 0
то pI = 7.

Ферменты – это биологические катализаторы белковой природы.
Катализаторы – это вещества, принимающие участие в химических реакциях, ускоряя их, но сами в них не расходующиеся.
Ферменты катализируют химические реакции, происходящие в организме.
Ферменты катализируют превращение веществ, которые называются субстратами (S) в продукты
(P):
E
S  P
P
Отличие ферментов от небиологических катализаторов:
1.Высокая эффективность действия (скорость ферментативных реакций в 106 – 1012 раз выше, чем соответствующих неферментативных реакций).
2.Высокая специфичность действия (фермент катализирует превращение одного конкретного субстрата, либо схожей группы субстратов).
3.Мягкие условия протекания ферментативных реакций (t ~ 37 °C,
нормальное атмосферное давление, pH, близкий к нейтральному).
4.Способность к регуляции.
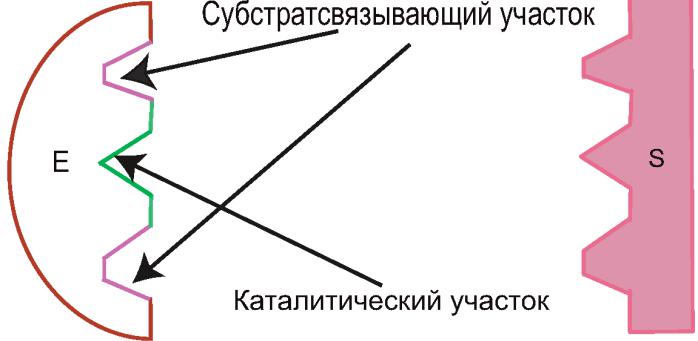
Активный центр фермента:
1.Участок молекулы фермента, сформированный на уровне третичной структуры, ответственный за связывание с субстратом по принципу комплементарности и участвующий в катализе.
2.Расположен в узком гидрофобном углублении (щели) поверхности молекулы фермента.
3.Активный центр фермента в отличие от активного центра белка имеет 2 участка:
1)Субстратсвязывающий участок;
2)Каталитический участок.
4.В активный центр фермента часто входит участок или домен для связывания кофактора.
Типы специфичности ферментов
I. Субстратная |
II. Каталитическая |
|
|
|
(пути превращения) |
Абсолютная |
Стерео- |
|
1. |
специфичность |
|
|
|
3. |
Относительная (групповая)
2.
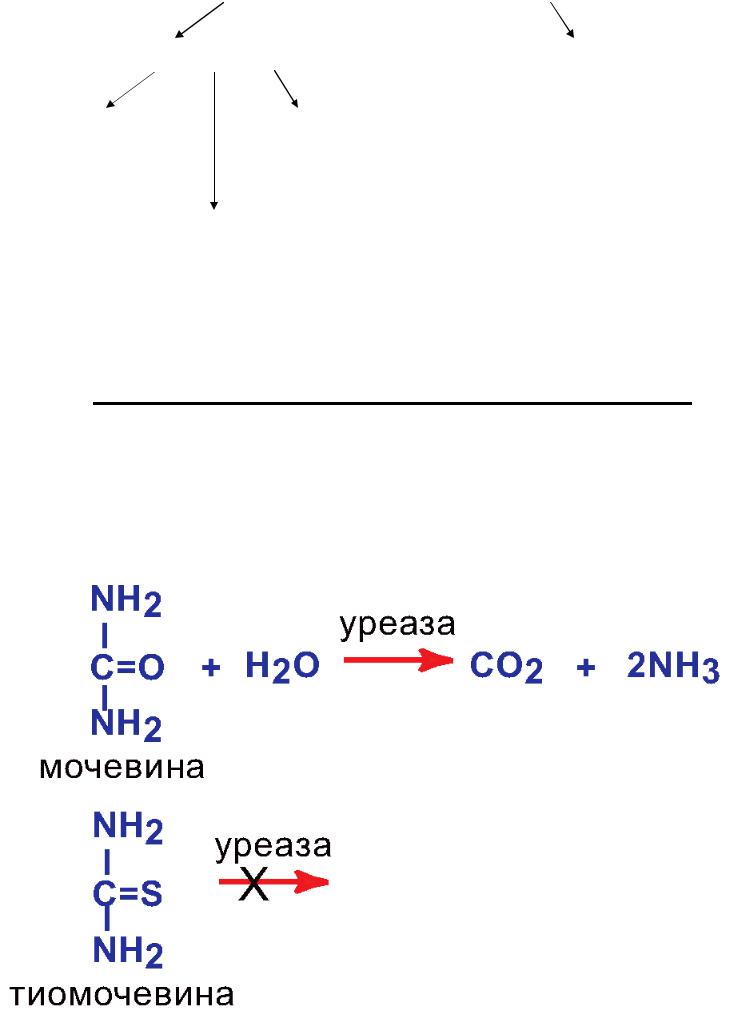
I.1. Абсолютная субстратная специфичность –
Фермент катализирует превращение только одного конкретного субстрата.
Пример:
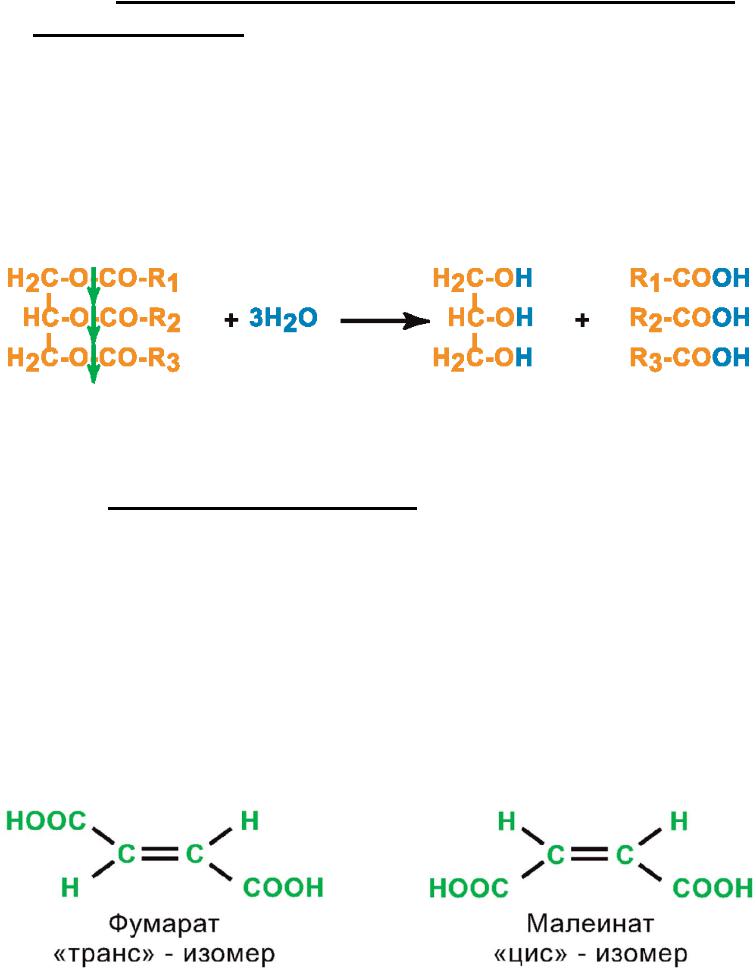
I.2. Относительная (групповая) субстратная специфичность – Фермент катализирует однотипные превращения схожих по строению веществ.
Пример: Фермент Липаза катализирует гидролиз жиров:
I.3. Стереоспецифичность – Фермент
катализирует превращение только одного из стереоизомеров для данного вещества.
Пример: Фермент Фумараза катализирует присоединение воды только к фумарату, но не к малеиновой кислоте:
II. |
Каталитическая |
|
специфичность |
||
|
(специфичность пути превращения) – фермент |
||||
|
катализирует |
только |
одно |
|
превращение |
|
субстрата из всех возможных: |
|
|
||
A
E1
S E2  B
B
E3
C
Пример:
|
|
|
|
|
|
|
|
N |
|
|
|
|
CH2 |
|
CH |
|
|
COOH |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
гистидин- |
|
|
|
|
|
N |
гистидаза |
||||||||||||||||||||||
декарбоксилаза |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
гистидин |
|
|
|
|
|
|
NH3 |
||||||||||||||
|
|
|
|
|
|
|
CO2 |
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
N |
|
|
|
|
CH2 |
|
|
CH2 |
N |
|
|
|
|
|
|
|
CH |
|
CH |
|
COOH |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
NH2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
N |
|
|
|
|
|
|
|
|
|
N |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
||||||||||||
гистамин |
|
|
|
|
|
|
|
|
уроканиновая |
||||||||||||||||||||
кислота
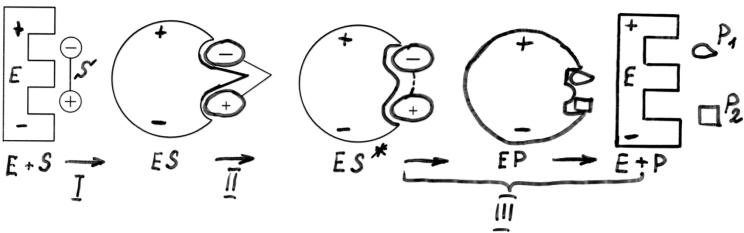
Этапы ферментативного катализа.
I – образование фермент-субстратного комплекса:
На этом этапе: а) субстрат приближается к активному центру фермента.
б) происходит взаимное изменение конформации E
иS, возникает строгая комплементарность между S
иактивным центром E (индуцированное соответствие).
II. Дестабилизация связей в молекуле субстрата.
III. Образование продуктов реакции и выход их из области активного центра фермента.
(III этап часто делят на III и IV:
III этап: образование продуктов реакции.
IV этап: выход продуктов из области активного центра фермента.)
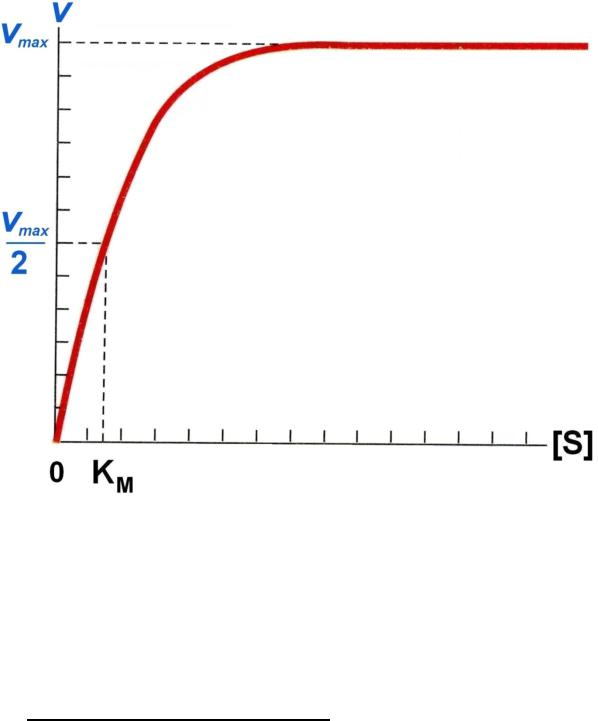
Кинетика ферментативных реакций.
I. Зависимость скорости реакции от концентрации субстрата:
Vmax – это такая V ферментативной реакции, при которой достигается полное насыщение фермента субстратом, т.е. когда все активные центры фермента связаны с субстратом.
KM – константа Михаэлиса:
1)KM численно равна концентрации субстрата, при которой скорость реакции равна ½ Vmax.
2)KM показывает сродство E к S. Чем меньше KM, тем больше сродство и наоборот.
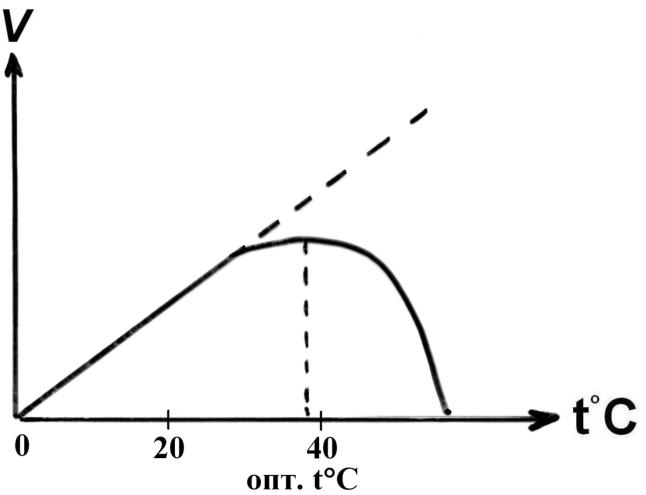
II. Зависимость скорости реакции от температуры:
При нагревании:
рвутся слабые связи в молекуле фермента (гидрофобные, ионные и водородные) => меняется конформация E => нарушается структура активного центра E => уменьшается активность E.
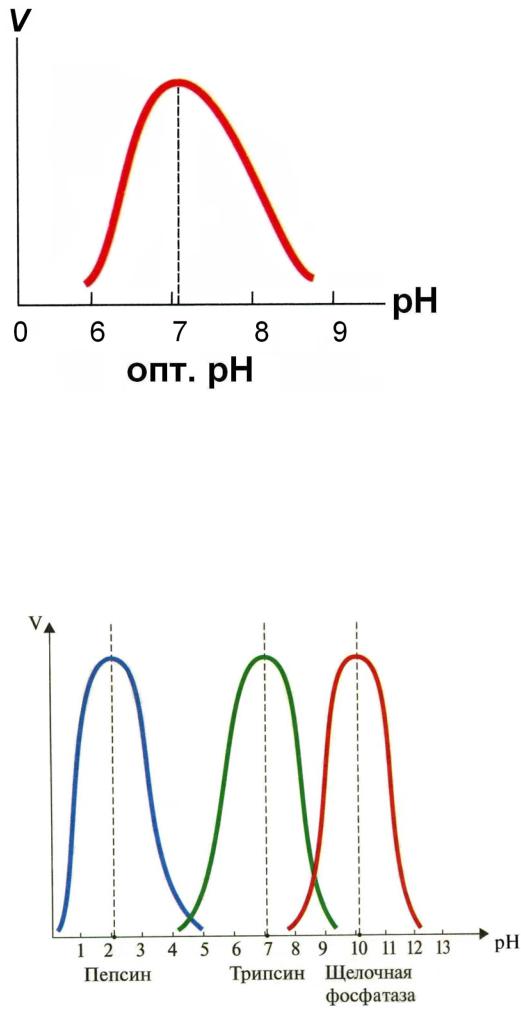
III. Зависимость скорости реакции от pH среды:
Оптимум pH – это такое значение pH, при котором E проявляет максимальную активность.
Для каждого E характерен довольно узкий интервал pH, при котором он активен:
