
лекции Астахова
.pdf
В водной среде третичная структура начинает образовываться с гидрофобных связей.
Гидрофобные радикалы, «прячась» от воды, погружаются внутрь белковой молекулы, максимально сближаясь друг с другом и образуя между собой гидрофобные связи.
Они составляют гидрофобное ядро белка.
Гидрофильные радикалы стремятся располагаться снаружи, образуя с водой водородные связи, и составляют гидрофильную оболочку белка.
За счет гидрофильной оболочки крупная молекула белка хорошо растворима в воде.
Те гидрофильные радикалы, которые оказались внутри белковой молекулы, образуют друг с другом водородные и ионные связи.
В белках, которые функционируют в гидрофобном окружении (белки мембран), обратное строение: внутри – гидрофильные радикалы, а снаружи – гидрофобные.
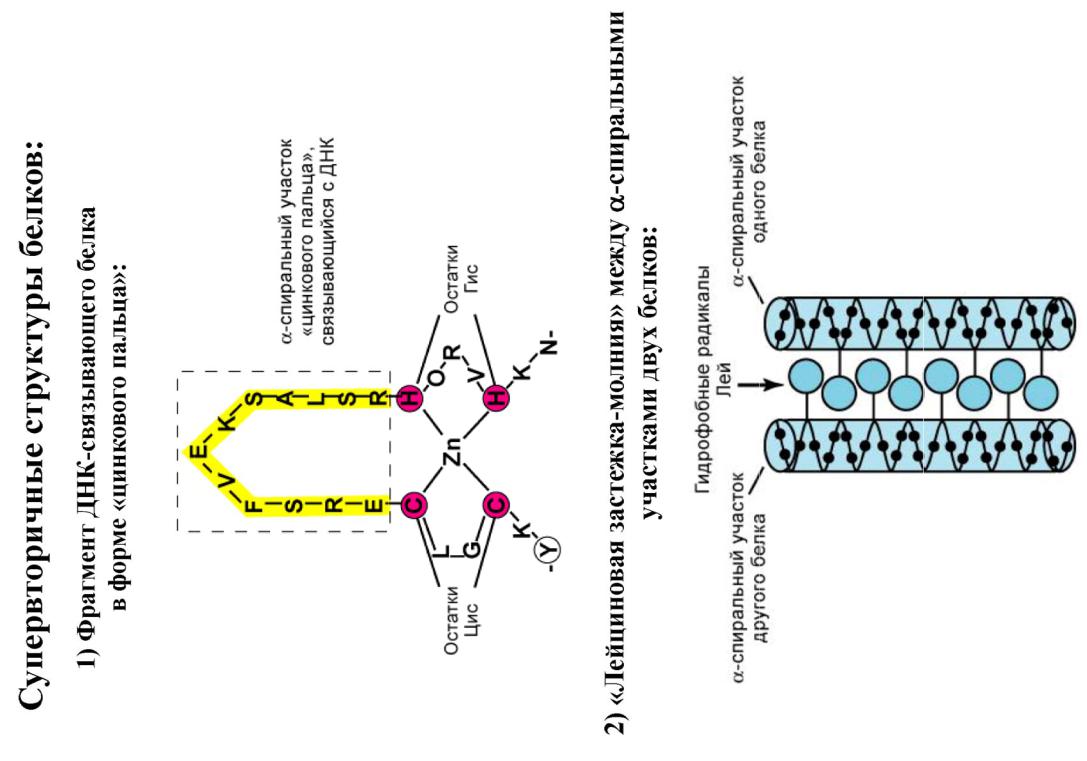
Супервторичная структура белка
Супервторичная структура белка – это сходные сочетания и взаиморасположение вторичных структур в белке.
Это специфическое сочетание элементов вторичной структуры при формировании третичной стр-ры белка.
В формировании супервторичной стр-ры могут принимать участие межрадикальные взаимодействия.
Примеры: "α-спираль – поворот – α-спираль"; "лейциновая застежка молния", "цинковые пальцы", "β-бочонок" и др.

Все связи, стабилизирующие вторичную и третичную структуру (кроме дисульфидных) – слабые. Они могут разрываться даже при комнатной t°.
Поэтому, для белков характерно уникальное свойство: конформационная лабильность.
Конформационная лабильность – это способность белков к небольшим изменениям конформации в результате разрыва одних и образования других слабых связей.
Эта способность помогает белкам функционировать.
Функции белков:
1.Структурная: белки соединительной ткани, фибрин тромбов;
2.Транспортная: гемоглобин – транспорт O2, трансферрин – транспорт Fe;
3.Ферментативная: белки-ферменты, катализирующие химич. реакции в организме;
4.Сократительная: актин, миозин;
5.Регуляторная: белковые гормоны, активаторы и ингибиторы других белков;
6.Защитная: белки-иммуноглобулины
7.Энергетическая
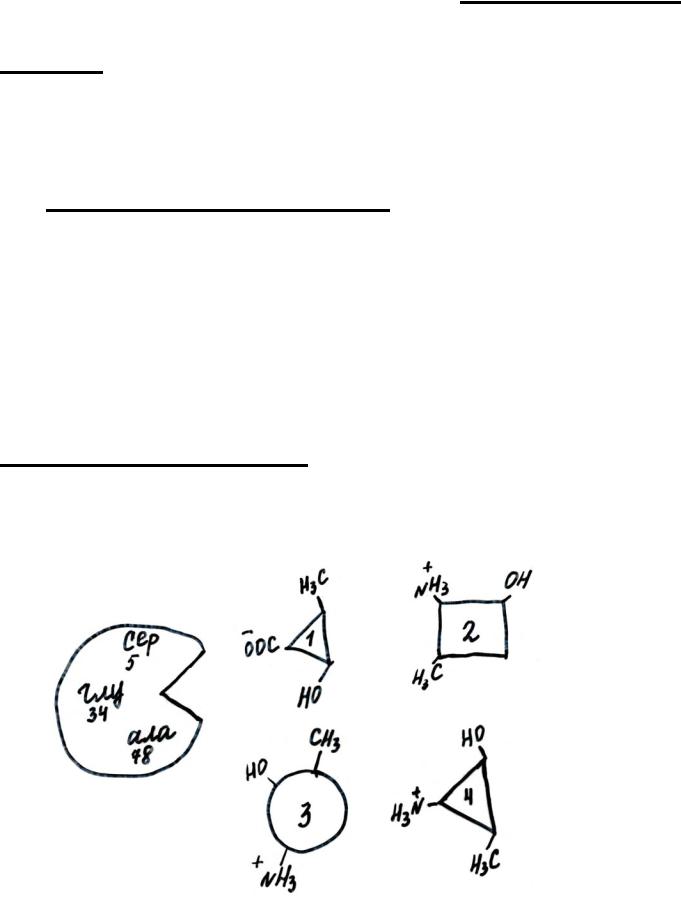
Выполнение белком его функции обеспечивается специфическим участком, к которому присоединяется лиганд. Этот участок называется: активный центр.
Лиганд – это вещество, которое взаимодействует с активным центром белка по принципу комплементарности.
1. Активный центр белка – это участок молекулы белка, сформированный на уровне третичной структуры (иногда, четвертичной), ответственный за связывание с лигандом.
2.Расположен в узком гидрофобном углублении (щели) поверхности молекулы белка.
Комплементарность – это пространственное и химическое соответствие взаимодействующих поверхностей (активного центра белка и лиганда).
ДНК (гены)
↓
мРНК
↓
первичная стр-ра белка
↓
конформация
активный центр
L →↓
функция

Простые и сложные белки
|
|
Белки |
|
Простые |
Сложные (Холопротеины) |
||
|
|
|
|
|
|
|
|
Имеют только |
Имеют белковую и |
||
белковую часть |
небелковую часть |
||
1. |
Альбумины |
1. |
Липопротеины |
(липиды) |
||||
2. |
Глобулины |
2. |
Гемопротеины |
(гем) |
||||
3. |
Гистоны |
3. |
Фосфопротеины |
(H3PO4) |
||||
4. |
Инсулин |
4. |
Гликопротеины |
(углевод) |
||||
|
|
5. |
Нуклеопротеины |
(нукл. к-та) |
||||
|
|
|
|
|
|
|
|
|
Небелковый
компонент
Олигомерные белки и их способность к регуляции функций.
Белки
Состоящие из одной |
Состоящие из нескольких |
полипептидной цепи |
полипептидных цепей |
Мономерные белки |
Олигомерные белки |
Протомер (субъединица) – это часть олигомерного белка, состоящая из одной полипептидной цепи.
Причем, каждая полипептидная цепь такого белка имеет собственную первичную, вторичную и третичную структуру и приобретает собственную конформацию.
Олигомерные белки – это белки, состоящие из нескольких протомеров.
Олигомерные белки могут содержать от 2-х до нескольких тысяч субъединиц.
Примеры: гемоглобин (4 субъединицы); аспартаттранскарбомоилаза (12 субъединиц); белок вируса табачной мозаики (2120 субъединиц).
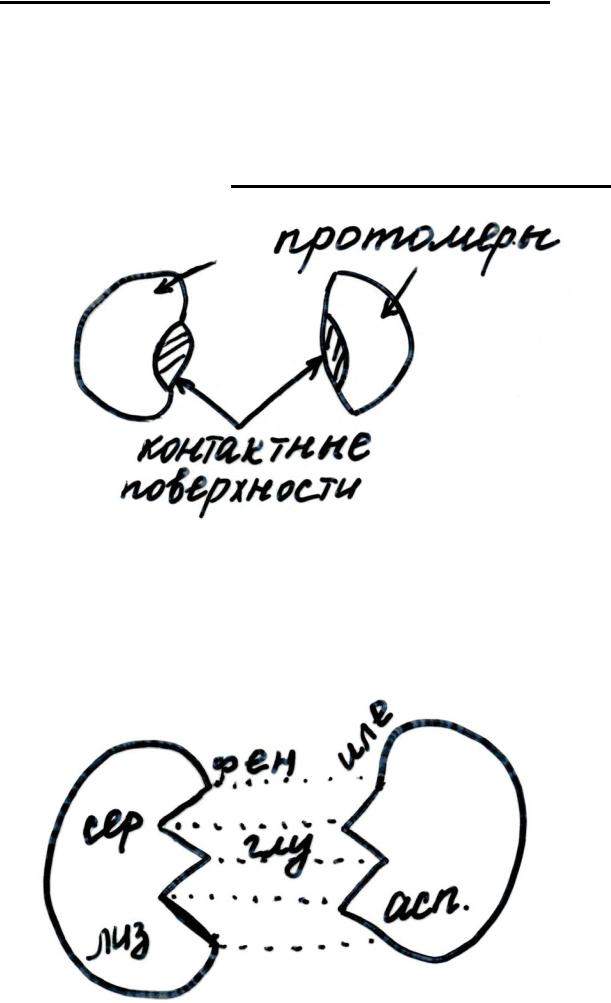
Четвертичная структура белка – это количество, способ расположения и пространственной укладки протомеров в олигомерном белке.
Участки, с помощью которых протомеры объединяются между собой при сборке олигомерного белка, называются: контактные поверхности.
Протомеры объединяются друг с другом по принципу комплементарности их контактных поверхностей. Связи между протомерами: водородные, ионные и гидрофобные.
Способность олигомерных белков к регуляции функций
Два родственных белка – гемопротеина:
Миоглобин (Mb)
Mb – белок красных мышц. Запасает O2 и отдает его только при очень интенсивной работе, т.к. имеет очень
высокое сродство к O2.
I стр-ра: Одна полипептид. цепь – 153 аминокислоты.
II стр-ра: 8α-спиралей
(названия от A до H)
III стр-ра: компактная глобула
IV стр-ра: отсутствует.
Гемоглобин (Hb)
Hb – содержится в эритроцитах. Транспортирует O2 из легких в ткани. (Из тканей в легкие переносит CO2 и H+) Количество O2, отдаваемое в ткани, может регулироваться.
I стр-ра: α-цепь – 141 аминок-та β-цепь – 146 аминок-т.
------------ // ------------
------------ // ------------
Олигомер: 2α-цепи и 2β-цепи.
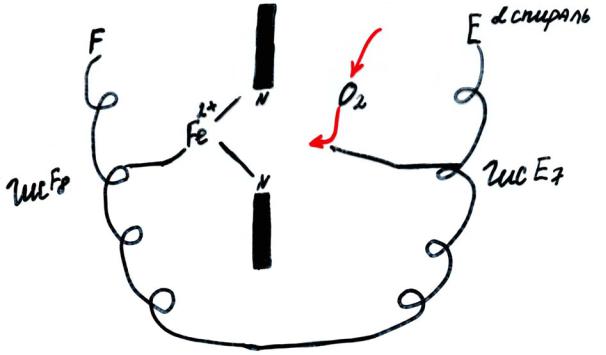
Строение активного центра Mb и Hb:
1)Активный центр Mb и Hb расположен в «кармане», образованными двумя спиралями F и E, имеющие гидрофобные радикалы аминокислот, за исключением 2 остатков гистидина F8 и E7.
2)В центре гема располагается ион Fe2+, связанный 4 связями с атомами азота пиррольных колец.
3)Fe гема связывается в активном центре ещё одной
прочной связью с Гис F8 и выходит из плоскости гема.
4)O2 – гидрофобная молекула, легко проникает в активный центр и связывается с Fe гема по другую сторону его плоскости.
5)Гис E7 – создает оптимальные условия для связывания O2 и уменьшает сродство гема к CO.
