
- •Вирусология. Этапы развития и связь с другими науками.
- •2. Природа и происхождение вирусов, уникальные черты, отличающие вирусы от других инфекционных агентов.
- •3.Место и роль вирусов в биосфере, сходство с другими формами жизни, роль в патологии животных и человека.
- •5. Химический состав вирионов вирусов.
- •6. Структура вирионов (нуклеоид, нуклеокапсид, капсид, капсомеры, суперкапсид, Моболочка). Типы симметрии вирусных частиц, простые и сложные вирионы.
- •7. Нуклеиновые кислоты вирусов, их строение и функции, отличие от клеточных. Типы вирусных геномов.
- •8. Вирусные белки, их виды, свойства и функции, отличие от клеточных.
- •9. Основные принципы систематики и номенклатуры вирусов.
- •10. Краткая характеристика семейств безоболочечных днк-содержащих вирусов.
- •11.Краткая характеристика семейств оболочечных днк-содержащих вирусов.
- •12.Краткая характеристика семейств безоболочечных рнк-содержащих вирусов.
- •13.Краткая характеристика семейств оболочечных рнк-содержащих вирусов с позитивным геномом.
- •14.Краткая характеристика семейств оболочечных рнк-содержащих вирусов с негативным геномом.
- •15.Стадии репродукции вирусов: адсорбция, проникновение, депротеинизация.
- •1. Начало инфекции (эклипс-фаза, теневая фаза)
- •16.Стадии репродукции вирусов: экспрессия вирусного генома (транскрипция, трансляция вирусных белков, репликация генома).
- •2. Экспрессия вирусного генома
- •17.Стадии репродукции вирусов: сборка вирионов и выход их из клетки.
- •18.Культивирование вирусов в организме естественно восприимчивых и лабораторных животных.
- •19.Культивирование вирусов на куриных эмбрионах.
- •20.Культивирование вирусов на культурах клеток и тканей, преимущества клеточных культур перед лабораторными животными и куриными эмбрионами, значение в вирусологии.
- •21.Виды культур клеток: органные, первично-трипсинизированные, диплоидные и перевиваемые; их свойства, особенности, области применения.
- •22.Действие на вирусы физических и химических факторов (температура, ультрафиолетовое облучение, кислоты, щелочи, жирорастворители, антибиотики). Методы уничтожения и консервации вирусов.
- •23.Пути и формы циркуляции вирусов в природе, сохранение популяции вирусов в межэпизоотический период.
- •24.Влияние антропогенных факторов на циркуляцию вирусов (загрязнение окружающей среды, использование вакцин, химиопрепаратов, пестицидов, концентрация животных и др.).
- •25.Генотип и фенотип вирусов. Наследственность, изменчивость, эволюция вирусов, генофонд вирусной популяции.
- •26.Генетические и негенетические взаимодействия вирусов.
- •27.Спонтанные и индуцированные мутации вирусов. Методы селекции и клонирования вирусов, отбор мутантов и их использование в профилактике вирусных болезней.
- •28. Классификация вирусных инфекций на уровне клетки. Цитопатология зараженной клетки.
- •29. Тропизм вирусов, проникновение в организм и распределение в нем. Классификация вирусных инфекций на уровне организма.
- •30. Клеточные и гуморальные факторы противовирусного иммунитета, их формирование, взаимодействие, значение для организма.
- •31. Иммунный ответ хозяина на вирусную инфекцию, особенности противовирусного иммунитета. Типы вирусных антигенов.
- •32. Иммунопатология вирусных инфекций, способы "ускользания" вирусов от иммунной защиты организма.
- •33.Интерферон: виды, свойства, индукторы. Применение интерферона и его индукторов в лечении вирусных заболеваний.
- •34.Специфическая профилактика вирусных болезней животных. Типы вирусных вакцин, их достоинства, недостатки, контроль вакцинных препаратов.
- •35.Химиотерапия вирусных болезней животных. Основные группы химиотерапевтических веществ.
- •36.Общая схема лабораторной диагностики вирусных инфекций: экспресс-методы, выделение вируса из патологического материала, идентификация вируса и доказательство его этиологической роли.
- •1. Устройство вирусологической лаборатории.
- •2. Правила работы с вируссодержащим материалом.
- •3. Учет, хранение и этикетирование вирусного сырья в лаборатории
- •4. Виды патологического материала и общие принципы его отбора.
- •5. Упаковка, транспортировка, хранение и консервирование вируссодержащего материала.
- •6. Подготовка вируссодержащего материала для исследования.
- •7.Вирусоскопия как метод диагностики вирусных инфекций. Световая, электронная, иммуноэлектронная микроскопия.
- •8. Устройство и принцип работы электронного микроскопа, приготовление препаратов для электронной микроскопии.
- •9. Тельца-включения при вирусных заболеваниях: морфология, состав, расположение в клетке, диагностическое значение.
- •10.Цели использования в вирусологии лабораторных животных, их виды, требования к ним, животные-гнотобиоты, спф-животные. Латентные инфекции лабораторных животных.
- •11.Методы экспериментального заражения лабораторных животных, признаки размножения вируса в их организме, "слепые пассажи".
- •12. Порядок и основные принципы вскрытия лабораторных животных, отбор патматериала.
- •13. Цели использования в вирусологии кэ, их строение и требования, предъявляемые к ним.
- •14.Методы экспериментального заражения куриных эмбрионов.
- •15.Культивирование зараженных кэ и признаки размножения вирусов в них.
- •16.Порядок вскрытия куриных эмбрионов и отбор вируссодержащего материала.
- •17. Способы и техника культивирования эукариотических клеток вне организма (монослойный, роллерный, суспензионный, на микроносителях), преимущества и недостатки каждого метода.
- •18. Питательные среды и растворы для культивирования эукариотических клеток.
- •19.Хранение, консервирование и транспортировка кк. Проблема контаминации клеточных культур и ее решение.
- •20. Культивирование вирусов в кк: подбор культуры, заражение, культивирование зараженных культур.
- •21. Методы индикации вирусов в культуре клеток.
- •22. Получение первично-трипсинизированной культуры клеток.
- •23. Титр вируса, единицы измерения, титрование вируса в инфекционных единицах локальных повреждений.
- •24. Титр вируса, единицы измерения, титрование вируса в инфекционных единицах 50%-ного действия на чувствительные объекты.
- •25. Титр вируса, единицы измерения, титрование вируса по гемагглютинирующей активно-
- •26. Ртга (задержки): принцип реакции, компоненты, контроли, варианты постановки, учет результатов, цели применения, достоинства и недостатки.
- •27. Рнга (пассивной): принцип реакции, компоненты, контро-ли, варианты постановки, учет результатов, цели применения, достоинства и недостатки.
- •28. Рн: принцип реакции, компоненты, контроли, варианты постановки, учет результатов, цели применения, достоинства и недостатки.
- •29. Рдп: принцип реакции, компоненты, контроли, варианты постановки, учет результатов, цели применения, достоинства и недостатки.
- •30. Метод флюорохромирования, принцип метода, приготовление препаратов, диагностическая ценность. Люминесцентная микроскопия, устройство и принцип работы люминесцентного микроскопа.
- •31. Метод флюоресцирующих антител (мфа): принцип реакции, компоненты, контроли, варианты постановки, учет результатов, цели применения, достоинства и недостатки.
- •32. Иммунопероксидазная (гистохимическая) реакция: принцип, компоненты, контроли, варианты постановки, учет результатов, цели применения, достоинства и недостатки.
- •33. Твердофазный иммуноферментный анализ: принцип реакции, компоненты, контроли, варианты постановки, учет результатов, цели применения, достоинства и недостатки.
- •34. Реакция связывания комплемента: принцип реакции, компоненты, контроли, учет результатов, цели применения, достоинства и недостатки.
- •35. Метод днк-зондов: принцип метода, получение днк-зондов, постановка реакции, цели применения, достоинства и недостатки метода.
- •36. Полимеразная цепная реакция (пцр): принцип метода, компоненты, постановка реакции, цели применения, достоинства и недостатки метода.
- •Вирус бешенства.
- •2. Вирус ящура.
- •3. Вирус оспы.
- •4. Вирус болезни Ауески.
- •5. Вирусы гриппа.
- •6. Возбудители губкообразной энцефалопатии.
- •7. Вирус чумы жвачных.
- •8. Вирус ирт крс. Инфекционного ринотрахеита
- •9. Вирус парагриппа-3 крс.
- •10.Респираторно-синцитиальный вирус крс.
- •11.Возбудитель вирусной диареи крс.
- •12.Возбудитель аденовирусной инфекции крс.
- •13.Вирус лейкоза крс.
- •14.Вирус катаральной лихорадки овец.
- •15.Вирус контагиозной эктимы овец.
- •16.Вирус ачс. Африканской чумы свиней
- •17. Вирус кчс. Вирус классической чумы свиней
- •18. Вирус болезни Тешена.
- •19. Вирус трансмиссивного гастроэнтерита свиней.
- •20.Вирус респираторно-репродуктивного синдрома свиней.
- •21.Вирус ачл. Африканской чумы лошадей
- •22. Вирус инан. Инфекционной анемии лошадей
- •23. Вирус ньюкаслской болезни.
- •24. Вирус инфекционного ларинготрахеита птиц.
- •25.Вирус болезни Марека.
- •26.Вирус инфекционного бронхита кур.
- •27.Вирус инфекционного бурсита кур.
- •28.Аденовирусная инфекция птиц.
- •29.Вирусы лейкоза птиц.
- •30.Вирус чумы плотоядных.
- •31.Вирус алеутской болезни норок.
- •32.Вирус инфекционного гепатита собак. Болезнь рубарта
- •33.Вирус панлейкопении кошек.
- •34.Вирус инфекционного перитонита кошек.
- •35.Вирус миксоматоза кроликов.
- •36.Вирус геморрагической болезни кроликов.
34. Реакция связывания комплемента: принцип реакции, компоненты, контроли, учет результатов, цели применения, достоинства и недостатки.
Отбор материала: отбирают от 2-3 больных животных стенки и содержимое афт (не менее 5 г) на слизистой оболочке языка у крупного рогатого скота, на пятачке у свиней, на коже венчика и межпальцевой щели у жвачных, свиней, верблюдов и др. При отсутствии афт берут кровь в момент повышения температуры, у трупов – лимфатические узлы головы и заглоточного кольца, поджелудочную железу и сердце. Для исследования на вирусоносительство берут пищеводноглоточную слизь (специальным зондом).
Получение материала необходимо производить так, чтобы предупредить вынос вируса за пределы неблагополучного очага и лаборатории, обезопасить персонал, работающий с инфекционным материалом. Для этого:
а) ветврач хозяйства должен иметь определенные навыки взятия материала от больных животных;
б) необходимо подготовить все для отбора материала пинцеты, ножницы, салфетки, толстостенные флаконы, лейкопластырь, резиновые пробки, 50 % стерильный глицерин на физиологическом растворе, термос с охлаждающей смесью, дезинфицирующий раствор – 2 % NaOH; спецодежду халаты, комбинезоны, косынки или шапочки, маски, резиновые сапоги, перчатки и т. д. Переодеваются, прежде чем войти в помещение с больными животными;
в) после взятия материала инструменты, маску, перчатки погружают в дезинфицирующий раствор, наружную поверхность флаконов и термоса обрабатывают дезинфицирующим раствором. В санпропускнике снимают всю одежду и принимают душ.
Пробы материала замораживают или заливают консервирующей жидкостью (50 % стерильный глицерин на физиологическом растворе). Этикетируют. Флаконы ставят в контейнер, опечатывают и помещают в термос со льдом, который тоже опечатывают. К материалу прилагают сопроводительное письмо. Материал отправляют с нарочным.
Для работы с вирусом ящура в лаборатории выделяют отдельную комнату (бокс с предбоксником), где должны быть все необходимое оборудование и материалы для проведения диагностической работы. При работе в боксе полностью сменяют спецодежду и обувь, надевают резиновые перчатки и маску. После работы ничего не обезвреженного из бокса выносить нельзя.
В лаборатории ведут строгий учет поступившего материала и его расход с точностью до 1 мг. Поступивший в лабораторию материал хранят до исследования и в период использования в закрытом на ключ и опечатанном холодильнике. По окончании работы составляют акт на уничтожение оставшегося от исследования материала и животных после биопробы.
Лабораторные исследования
обнаружение и идентификацию вируса ящура в РСК (определение его типовой и вариантной принадлежности);
обнаружение и титрование антител к ящуру у переболевших животных (реконвалесцентов) в реакции радиальной иммунодиффузии (РРИД) и непрямой РИФ (НРИФ).
РСК
На первом этапе участвуют антиген, антитело (один из этих ингредиентов известен) и предварительно оттитрованный комплемент. При соответствии антигена и антитела их комплекс связывает комплемент, что выявляют на втором этапе с помощью индикаторной системы (смесь бараньих эритроцитов и антисыворотки к ним гемолизина). Если комплемент связался при взаимодействии антигена и антитела, то лизиса эритроцитов не происходит положительная РСК. При отрицательной РСК несвязанный комплемент способствует гемолизу эритроцитов.
Основными компонентами РСК служат антигены (известные или выявляемые), антитела (известные антисыворотки или исследуемые сыворотки), комплемент (свежая или сухая нормальная сыворотка морских свинок), гемолизин и эритроциты барана; в качестве разбавителя используют физраствор (рН 7,2-7,4) или различные буферные растворы. Антигены и сыворотки могут обладать антикомплементарностью, т.е. способностью адсорбировать комплемент, что задерживает гемолиз и искажает результаты реакции. Чтобы избавиться от антикомплементарности, антигены очищают различными методами: ацетоном, фреоном, эфиром, хлороформом и т.д. в зависимости от вида ткани, используемой в качестве антигена и вируса. Сыворотки освобождают от антикомплементарности путем прогревания, обработкой комплемента и другими методами.
Антигены готовят из органов зараженных животных, аллантоисной, амниотической жидкости зараженных КЭ, из жидкой среды инфицированных КК.
Подготовка антигена для РСК при вирусных инфекциях отличается от его подготовки при бактериальных инфекциях. Это обусловлено рядом специфических свойств вирусов.
для освобождения вирусного антигена из клетки приходится часто дополнительно обрабатывать инфекционный материал с целью разрушения клеток и освобождения антигена.
большая термолабильность вирусных антигенов по сравнению с бактериальными. У большинства вирусов комплементфиксирующий антиген связан с инфекционной частицей, и разрушение его идет параллельно с потерей инфекционности. Поэтому материалы для получения антигена необходимо брать от павших животных только в первые часы после гибели их, а лучше при жизни. Консервирование вируссодержащего материала различными дезинфицирующими средствами часто не дает положительных результатов, т.к. многие из них вызывают разрушение вирусного антигена.
неравномерность фиксации комплемента при различном соотношении концентраций антиген + антитело. Комплекс антиген + антитело образуется только при строгих количественных соотношениях их; при избытке антител фиксация комплемента резко снижается, т.к. активный комплекс антиген + антитело представлен в основном в форме антител и активная поверхность комплемента незначительна. То же самое наблюдается и в зоне избытка антигена, где подавление фиксации комплемента происходит еще быстрее. Поэтому для установления оптимальной зоны фиксации комплемента необходимо предварительное титрование антигена и антител.
незначительный объем комплекса антиген + антитело. Размер вирусных частиц, вступающих в комплекс, очень ничтожен, и поэтому площадь фиксации комплемента незначительна. С увеличением объема комплекса антиген + антитело путем удлинения периода фиксации комплемента (до 18 ч при 4°С) повышается чувствительность реакции, но снижается ее специфичность, т.к. при продолжительном периоде фиксации увеличивается фиксация комплемента неспецифическими антигенами (тканевыми).
высокая прокомплементарная активность вирусного антигена. Для исключения неспецифической фиксации комплемента необходима более полная очистка вирусного антигена от тканевых фрагментов.
Большой помехой для использования РСК в диагностике вирусных болезней животных и человека является неравномерное накопление вирусного антигена в различные периоды болезни, и особенно, при разных инфекциях.
РСК применяют для определения типов и подтипов (вариантов) вируса ящура, вызывающих заболевание, для проверки производственных штаммов вируса ящура при изготовлении вакцин и лабораторных штаммов в научноисследовательской работе.
Приготовление антигена вируса ящура. Стенки афт от больных животных отмывают от консервирующей жидкости физраствором, высушивают, взвешивают, измельчают и тщательно растирают со стерильным стеклом до получения однородной массы, к которой добавляют физиологический раствор. Полученную 33 % суспензию экстрагируют при комнатной температуре в течение 2 ч, промораживают при минус 10 – минус 20 °С в течение 5 18 ч. После размораживания центрифугируют 30-15 мин. Надосадочную жидкость инактивируют при 58 °С 40 мин. После инактивации, если жидкость с хлопьями, ее повторно центрифугируют при 10-15 мин и затем используют в качестве антигена в РСК.
Подготовка гемолизина. Гемолизин титруют при получении его новой серии. Выпускаемый биофабриками гемолизин иногда консервирован глицерином (1:1), поэтому для приготовления основного разведения гемолизина (1:1000) берут 0,2 мл гемолизина и 9,8 мл физиологического раствора (1:100), затем из этого разведения готовят разведение 1:1000 (к 1 мл гемолизина 1:100 добавляют 9 мл физиологического раствора). Из основного раствора (1:1000) готовят все после дующие по указанной схеме.
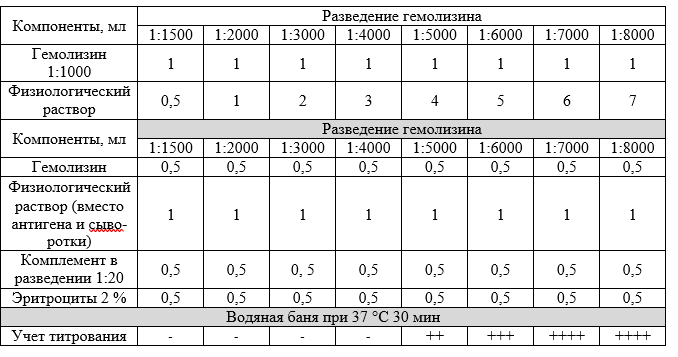
При титровании гемолизина необходимы:
контроль эритроцитов для исключения спонтанного гемолиза (0,5 мл 2 % суспензии эритроцитов + 2 мл физиологического раствора);
контроль гемолизина для исключения гемолиза эритроцитов без комплемента (0,5 мл разведения 1:1000 гемолизина + 0,5 мл 2 % суспензии эритроцитов + 1,5 мл физиологического раствора);
контроль комплемента для исключения гемолиза эритроцитов без участия гемолизина (0,5 мл разведения 1:20 комплемента + 0,5 мл 2 % суспензии эритроцитов + 1,5 мл физиологического раствора);
контроль гемолитической системы (0,5 мл разведения 1:1000 гемолизина + 0,5 мл 2 % суспензии эритроцитов + 0,5 мл разведения 1:20 комплемента + 1,0 мл физиологического раствора).
В результате титрования устанавливают предельный титр гемолизина, т.е. его минимальное количество, способное вызвать лизис эритроцитов (гемолиз) в присутствии комплемента. На приведенной схеме это количество гемолизина получено в разведении 1:3000. В первых трех контролях должна быть полная задержка, в четвертом контроле полный гемолиз.
В главный опыт берут гемолизин в 4-кратной концентрации от его предельного титра (рабочее разведение). Например, предельный титр гемолизина 1:3000, его рабочее разведение будет 1:750. А если он консервирован глицерином (1:1), то для приготовления рабочего разведения берут 2:750 или 0,2 мл цельного гемолизина и 74,8 мл физиологического раствора.
Приготовление гемолитической системы (гемосистемы). Смешивают гемолизин в рабочем разведении с равным количеством 2 % взвеси эритроцитов барана. Перед использованием гемосистему выдерживают в термостате при 37 °С 30 мин для сенсибилизации эритроцитов.
Приготовление 2 % суспензии эритроцитов барана. На 2 мл осадка отмытых эритроцитов добавляют 98 мл физиологического раствора.
Титром комплемента считается то его наименьшее количество, которое вызывает полный гемолиз эритроцитов. При определении типа вируса ящура используют комплемент с титром не ниже 2,5 %.
Для постановки главного опыта РСК комплемент берут с излишком в 1 % или в две условные единицы от титра его в гемосистеме. Например, титр комплемента в гемосистеме 2 %, в главный опыт берут 3 %, для приготовления рабочей дозы к 3 мл нативного цельного комплемента добавляют 97 мл физиологического раствора.
Приготовление разведений комплемента, определение его активности и вычисление рабочей дозы требуют в подготовке РСК наибольшего внимания. Правильно избранная рабочая доза комплемента непременное условие нормального течения реакции, что обеспечивает достоверность результатов. Избыток комплемента ведет к частичной или полной потере возможности выявить специфический антиген или антитело. Недостаток комплемента вызывает задержку гемолиза и при отсутствии специфического антигена и антитела.
Сыворотки. При определении типа вируса ящура позитивные типоспецифические ящурные сыворотки используют в рабочем титре, который представляет собой удвоенный предельный титр. Так, если предельный титр сыворотки, указанный на этикетке, равен 1:40, то рабочий титр 1:20.
Антигены. Типоспецифические ящурные антигены (выпускаемые биофабриками) используют в удвоенных титрах. Так, если на этикетке указан предельный титр 1:6, то удвоенный титр его 1:3.
В качестве испытуемого антигена используют патматериал (стенки и содержимое афт, тушки больных и павших при постановке биопробы мышат и крольчат), культуральную вируссодержащую жидкость. Испытуемый антиген в реакции исследуют цельным (33 % взвесь) и в разведениях 1:2, 1:4, 1:8.
Постановка главного опыта для определения типа вируса ящура. Одновременно с главным опытом ставят контроль всех специфических ящурных антигенов и сывороток.
Компоненты разливают в следующем порядке:
специфические сыворотки в рабочем титре по 0,2 мл для каждой сыворотки один ряд пробирок по вертикали;
2) специфические антигены в рабочем титре по 0,2 мл в первые семь рядов по горизонтали, для каждого антигена один ряд;
3) испытуемый антиген в разведениях по 0,2 мл для каждого разведения один ряд пробирок по горизонтали;
4) физиологический раствор по 0,2 мл в последний ряд по горизонтали (контроль сывороток) вместо антигена и в последний ряд по вертикали (контроль антигенов) вместо сывороток;
5) комплемент по 0,2 мл в рабочем разведении во все пробирки главного опыта. Пробирки осторожно встряхивают и помещают в водяную баню на 20 мин при 37-38 °С;
6) во все пробирки наливают по 0,4 мл гемолитической системы. Пробирки снова встряхивают и помещают в водяную баню на 30 мин при 37-38 °С.
Учет реакции ведут через 5-10 мин после водяной бани, и окончательный результат получают через 10-12 ч. Степень задержки гемолиза оценивают в крестах: (+ + + +) – 100 % задержка гемолиза; (+ + +) – 75 % задержка гемолиза; (+ +) – 50 % задержка гемолиза; (+) – 25 % задержка гемолиза; (-) полный гемолиз.
Если испытуемый антиген гомологичен специфическим антителам, то будет задержка гемолиза и реакция положительная; если же гомологичные антитела отсутствуют, реакция отрицательная и наблюдается полный гемолиз.
При установлении типовой принадлежности ящура используют вариантные сыворотки и антигены установленного типа, причем вариантные сыворотки используют в предельном титре, а антигены в удвоенном. Антиген (исследуемый) относят к тому варианту, с сывороткой которого он дает положительную реакцию в более высоких разведениях.
Заключение: испытуемый штамм относится к варианту А22.
Когда доставленное количество вирусного материала из хозяйства недостаточно для исследования в РСК, проводят его расплодку на культурах клеток или на 36-дневных мышатах-сосунах, или взрослых морских свинках. Мышатам исследуемую суспензию вводят подкожно в области спины в дозе 0,1-0,2 мл, морским свинкам – внутрикожно в подушечки обеих задних конечностей в дозе 0,2-0,5 мл. За животными наблюдают 5-7 дней.
В случае гибели мышат из их тушек готовят антиген для РСК. У морских свинок в положительных случаях на лапках образуются афты; стенки афт и их содержимое используют в РСК. При необходимости проводят 2-3 «слепых» пассажа. Пробу исследуемого материала считают отрицательной, если в третьем пассаже не будет отмечено дегенерации клеток и падежа белых мышей, а при исследовании полученных из них суспензий в РСК не будет обнаружен антиген вируса ящура
Ретроспективная диагностика ящура
Материалом служат сыворотки крови животных. Они должны быть взяты не ранее 7 дней с момента появления признаков заболевания. На исследование следует направлять 5-10 проб сыворотки от каждой возрастной группы. При сомнительных результатах первичного исследования необходимо отобрать кровь повторно от тех же животных спустя 7 10 дней.
Сыворотку консервируют антибиотиками (по 500 ЕД/мл пенициллина и стрептомицина) или замораживают при -20°С. На исследование направляют не менее 5 мл сыворотки от каждого животного в термосе со льдом.
В лаборатории сыворотку исследуют с помощью РРИД и НРИФ.
РРИД. Сущность заключается в формировании зоны специфической преципитации вирусных антигенов антителами, включенными в состав агарового геля. РРИД является типоспецифичной. Для постановки реакции расплавленный 2 % агар смешивают с равным объемом нагретой (50-55 °С) испытуемой сыворотки в разведениях 1:5, 1:10, 1:20 и т.д. до 1:320 и наносят (по 4 мл) на предметное стекло. В застывшем агаре вырезают лунки (диаметр 4-7,7 мм), которые заполняют эталонными типовыми антигенами. Затем стекла помещают во влажную камеру при 37 °С.
Учет результатов через 6 7 ч и окончательно через 18 ч.
Положительная реакция кольцо преципитации в виде опалесцирующей зоны вокруг лунки с антигеном, гомологичным возбудителю, вызвавшему заболевание.
Антитела, обнаруженные в испытуемой пробе сыворотки, относят к тому серотипу, с антигеном которого они дали положительную реакцию. Их титром считают максимальное разведение испытуемой сыворотки, с которым наблюдается положительная реакция.
После переболевания животных титры антител обычно превышают 1:160.
НРИФ. Наличие антител в сыворотке крови переболевших животных выявляет специфическое свечение (комплекса антиген + антитело), а при использовании сывороток от вакцинированных животных свечение комплекса не наблюдается. На препарат из КК ВНК-21, ПЭК, ПЭС, инфицированных ящуром любого типа, наносят испытуемую сыворотку (в разведении 1:10 и 1:20), инкубируют во влажной камере при 37 °С 30 мин, отмывают несвязавшиеся антитела, подсушивают на воздухе и окрашивают смесью рабочих разведений флуоресцирующей антивидовой сыворотки и бычьего альбумина, меченного родамином, инкубируют во влажной камере при 37 °С 30 мин, отмывают, подсушивают и просматривают под люминесцентным микроскопом (объектив х40, окуляр х4 или х5). Положительная реакция зеленое или изумрудно-зеленое свечение цитоплазмы клеток. Реакция сопровождается постановкой соответствующих контролей. Диагностический результат считают положительным при обнаружении специфического свечения хотя бы в одной из 5-10 сывороток, присланных из данного хозяйства.
Для определения уровня обнаруженных таким образом антител в испытуемой сыворотке проводят ее титрование: испытуемую сыворотку разводят от 1:40 до 1:1280 и каждым разведением обрабатывают заведомо инфицированный препарат, как было указано выше. О титре постинфекционных антител в сыворотке судят по предельному ее разведению, которое способно давать положительную НРИФ. Наличие специфического свечения в препаратах, обработанных испытуемой сывороткой в разведениях 1:10, 1:20 и 1:40, свидетельствует о том, что сыворотка была получена в период острого переболевания животного ящуром, т.е. с момента его заболевания прошло около 7 дней, а в разведениях 1:80 и выше что сыворотка взята от животного-реконвалесцента.
Результаты исследования на ящур оформляют в виде протокола, в котором указывают дату исследования, наименование хозяйства, материала, краткие эпизоотологические данные и т. д. и обязательно наименования компонентов, используемых в исследовании, характеристику контролей.
Специфическая терапия: сыворотка крови реконвалесцентов (переболевших).
Специфическая профилактика: моно и поливалентные сорбированные вакцины из вируса, выращенного в организме 2-3 дневных крольчат (лапинизированная); из вируса, культивированного по методу Френкеля на эпителии языка крупного рогатого скота; из вируса, выращенного на клетках ВНК-21.
Этиология. Picornaviridae, Aphtovirus (рисунок 62). Мелкие вирусы до 60 нм. Содержит одну молекулу одноцепочечной позитивной РНК. Гемагглютинирующими свойствами вирус не обладает. В настоящее время известно семь антиген ных типов вируса ящура: А, О, С, Сат-1, Сат-2, Сат-3 и Азия-1. Внутри типов существуют варианты или подтипы. Так, тип А имеет 32 варианта, тип О 11, тип С 5, Сат-1 7, Сат-2 3, Сат-3 4, Азия-1 2. Антигенные типы, установленные в РСК, различаются и иммунологически. Переболевшие животные приобретают выраженный иммунитет к гомологичному вирусу. Внутри основных типов существуют подтипы или варианты. Каждый тип вызывает заболевание.
Культивируют на морских свинках, восприимчивых животных, культурах клеток из почки КРС, свиней коз и т.д.
Устойчивость. Чувствителен к изменению рН среды. Низкие температуры консервируют. Относительно чувствителен к дезинфектантам.
Патогенез. Вирус эпителиотропный. В местах проникновения вируса (ротовая полость или дыхательные пути) формируются первичные афты. Вирус → воспалительный процесс → отёк → много мелких пузырьков → они сливаются, формируя афты. Экссудат в начале серозный, затем скопление лейкоцитов (гнойный) → афты лопаются → язвы → с кровью и лимфой разносится по организму → образование вторичных афт.
Иммунитет продолжительный от 1 года до 2 лет к данному типу возбудителя. В организме естественно восприимчивых животных вирус индуцирует образование вируснейтрализующих, комплементсвязывающих и преципитирующих антител.
