
- •Нарушения кислотно-основного состояния
- •1. Что понимают под кислотно-основным состоянием (кос)?
- •2. Какими основными показателями характеризуется кос в организме.
- •3. Какие буферные системы существуют в организме? Какова их роль в стабилизации кос?
- •4. Какую роль выполняют легкие, почки и печень в компенсации нарушений кос?
- •6. Какие виды ацидоза существуют? 11. Какие виды алкалоза существуют ?
- •7. Какие причины и последствия газового (дыхательного) ацидоза? 8. Каким образом компенсируются нарушения в организме при газовом ацидозе? Газовый ацидоз
- •9. Каковы причины и последствия негазового (метаболического) ацидоза? 10. Каков механизм компенсации метаболического ацидоза? Негазовый ацидоз
- •12. Каковы причины и последствия газового алкалоза? 13. Какие системы организма участвуют в компенсации изменений при газовом алкалозе? Газовый алкалоз
- •14. Каковы причины и последствия негазового алкалоза? 15. Каков механизм компенсации негазового алкалоза? Негазовый алкалоз
- •16. При каких состояниях могут возникать сочетания нарушения кос? Сочетанные нарушения кислотно-основного состояния
Нарушения кислотно-основного состояния
1. Что понимают под кислотно-основным состоянием (кос)?
КОС — соотн. конц. водородных (Н+) и гидроксильных (ОН-) ионов в биологич. средах. Необходимым усл. сущ-я живого организма является поддержание постоянства этого параметра внутренней среды. От величины рН зависят стабильность мембран, функции ферментов, нервно-мышечная возбудимость и проводимость и другие процессы.
Белковый, липидный и углеводный обмены являются источниками образования летучих (угольная) и нелетучих (фосфорная, серная, пировиноградная, молочная и др.) кислот. Основные соединения (ОН-, креатинин и др.) образуются в организме в значительно меньших количествах.
Возрастание концентрации Н+ (и, соответственно, снижение рН) называется ацидозом, снижение концентрации Н+ (повышение рН) - алкалозом. Значения рН в крови ниже 6,8 и выше 8,0 считаются несовместимыми с жизнью и в клинике практически не встречаются.
2. Какими основными показателями характеризуется кос в организме.
КОС в организме характеризуется следующими основными показателями.
1. Актуальный рН - отрицательный десятичный логарифм концентрации водородных ионов - является интегральным показателем КОС. В норме рН артериальной крови составляет 7,36-7,44, венозной - 7,32-7,42.
2. pCO2 отражает концентрацию углекислоты (под термином «углекислота» подразумеваются различные соединения двуокиси углерода в крови). Парциальное напряжение углекислого газа в артериальной крови (раС02) в норме составляет 4,7-6,0 кПа (35-45 мм рт.ст.), в венозной - 5,6-7,3 кПа (42-55 мм рт.ст.).
3. pO2 отражает концентрацию растворенного в крови кислорода. Парциальное напряжение кислорода в артериальной крови (pa02) в норме составляет 11,3-12,7 кПа (85-95 мм рт.ст.), в венозной - 4,0- 6,7 кПа (30-50 мм рт.ст.).
4. Концентрация бикарбонатов плазмы в артериальной крови составляет в норме 22-26 мэкв/л, в венозной - 24-28 мэкв/л.
5. Стандартный бикарбонат плазмы крови (SB) - концентрация бикарбоната в плазме крови, уравновешенной при 37 °С со стандартной газовой смесью при рС02 = 5,33 кПа и p02 >13 кПа, - в норме составляет 21,3-21,8 ммоль/л.
6. Буферные основания крови (BB) - сумма анионов буферных систем, в основном ионов бикарбоната и анионов белков. В норме соответствует 40-60 ммоль/л.
7. Нормальные буферные основания крови (NBB) - показатель, определяемый при рН = 7,38 и рС02 = 5,33 кПа.
8. Избыток (или дефицит) оснований (BE) - показатель избытка (или недостатка) буферных мощностей (BB - NBB). В норме колеблется от +2,3 до -2,3 ммоль/л.
3. Какие буферные системы существуют в организме? Какова их роль в стабилизации кос?
Стабилизация КОС организма обеспечивается буферными системами (бикарбонатная, фосфатная, белковая и гемоглобиновая), а также функционированием специфических физиол-х механизмов компенсации КОС в некоторых органах (легкие, почки, печень, костная ткань).
1. Бикарбонатная буферная система (10% от буферной емкости крови) представляет собой сопряженную кислотно-основную пару, состоящую из молекул угольной кислоты H2CO3, играющей роль донора протона, и бикарбонат-ионов HCO3- (во внекл. жидкости в виде натриевой соли NaHCO3, во внутрикл. - ICHCO3). Конц. недиссоциированных молекул H2CO3 в крови незначительна и находится в прямой зависимости от концентрации растворенного CO2, поэтому известное уравнение Гендерсона-Хассельбаха1 для бикарбонатной системы представимо в следующем виде:
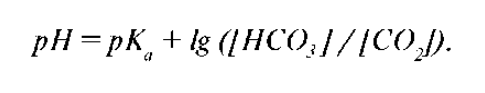
Отношение концентраций H2CO3 и HCO3- в крови в норме составляет 1:20. Эта буферная система эффективно функционирует при значениях рН около 7,4.
1 Уравнение Гендерсона-Хассельбаха выражает рН буферного раствора через константу диссоциации Ка и соотношение концентраций акцептора и донора протонов: рН = рКа + lg [(акцептор протонов) / (донор протонов)].
2. Фосфатная буферная система (только 1% от буферной емкости крови, при этом ее роль в тканях, особенно в почках, весьма существенна). В ее состав входят однозамещенный фосфат Н2РО4- (донор протона) и двузамещенный фосфат НРО42- (акцептор протона), соотношение которых в норме - 1:4. Фосфатный буфер способен оказывать влияние на концентрацию протонов в растворе в диапазоне рН от 6,1 до 7,7, наиболее эффективен при рН=7,2.
3. Белковая буферная система наиболее эффективна в области значений рН от 7,2 до 7,4. Белки, являясь амфотерными электролитами за счет наличия в составе их молекул свободных кислотных и основных групп, в кислой среде связывают ионы водорода, в щелочной - отдают.
4. Гемоглобиновая буферная система является наиболее мощной (около 70% от буферной емкости крови). Она состоит из HHb и ННbО2 (слабые органические кислоты, доноры протонов) и КНb и КНbО2 (сопряженные основания, акцепторы протонов). Система, состоящая из взаимопревращающихся гемоглобина и оксигемоглобина, функционирует как единое целое.
Буферные системы оказывают компенсаторное дей-е на изменение КОС непосредственно в момент его возникновения, влияние легких сказывается в теч. неск. минут, время восстановления почками физиолог. соотн конц компонентов буферных систем и нарушенного КОС измеряется часами.
