
Перечень вопросов к экзамену ТХ с примером КИМ
.pdf1.Быстрота (анализ можно провести в течение одного рабочего дня).
2.Меньшее количество операций, меньшие потери искомых веществ (алкалоиды извлекаются на 30 – 40 %).
3.Экономичность и дешевизна, т.к. дорогой спирт заменён водой.
Недостаток: образование эмульсий при экстрагировании веществ из водной фазы хлороформом, т.к. метод не предусматривает очистки извлечений
13.Метод Крамаренко.
Частный метод изолирования алкалоидов водой, подкисленной серной кислотой (по В.Ф.Крамаренко)
Схема метода состоит из следующих этапов:
1).Настаивание измельченного объекта с водой, подкисленной 20% раствором серной кислоты до рН2-3, в течение двух часов. Вода берется в количестве 1:2 по отношению к навеске объекта. Водное извлечение фильтруется. Операция повторяется двукратно.
2).Очистка водного извлечения от белковых соединений путем насыщения его сульфатом аммония, настаивания в течение часа и фильтрования образовавшегося осадка.
3).Очистка фильтрата от жиров, смол, пигментов путем экстракции эфиром. Эфирное извлечение отбрасывают.
4).Подщелачивание водного извлечения 20% раствором гидроксида натрия и экстрагирование веществ основного характера хлороформом при рН=9-10 (трехкратная экстракция), отделение органической фазы и концентрирование полученного извлечения упариванием.

Достоинства:
1.Частный метод ля алкалоидов, для синтетических веществ основного характера.
2.Быстро.
3.Вытяжка получается чистая.
Недостатки:
1. Для веществ кислого характере – не подходит. Для некоторых групп алкалоидов – плохое извлечение.
14.Классификация иммунохимических методов. Основные этапы.
Выделяют следующие виды иммунохимического анализа:
Метод |
Способ детектирования |
Иммуноферментный анализ (ИФА) |
Ферментная активность |
Иммуносенсорные методы |
Электрический сигнал |
Иммунохроматографический анализ (ИХА) |
Образование окрашенного комплекса |
Люминесцентный иммуноанализ (ЛИА) |
Интенсивность люминесценции |
Флуоресцентно-поляризационный иммуноана- |
Интенсивность флуоресцентной поля- |
лиз (ФПИА) |
ризации |
Радиоиммунный анализ (РИА) |
Радиоактивность |
Металлоиммуноанализ (МИА) |
Атомарные спектры поглощения |
Рефрактометрический иммуноанализ |
Преломление света |
Все методы иммунохимического исследования включают 4 этапа. 1 этап. Нанесение метки на препарат или его аналог.
2 этап. Добавление антисыворотки с антителами и образование комплекса антителомеченый препарат.
3 этап. Добавление исследуемого образца (крови, мочи). Происходит вытеснение токсическим веществом меченого препарата из комплекса и образование нового комплекса: анализируемое вещество-антитело.
4 этап. Измерение радиоактивности, интенсивности флуоресценции, активности фермента и т.д.
15. Основные преимущества ИХМ. Типы применяемых меток и способы их детектирования.
В основе иммунохимических методов анализа лежит высокоспецифичная и высокочувствительная иммунная реакция антигена с антителами.
Основные достоинства иммуно-химических методов
1.Определение производится непосредственно в биологической жидкости
2.Не требует изолирования и очистки
3.Позволяет одновременно производить анализ на большое количество проб
4.Просты в исполнении
5.Высокочувствительные
6.Высокая скорость определения
7.Возможность автоматизации и использования для массовых анализов в полевых условиях
8.Высокая точность
9.Не требуется дорогостоящее оборудование
Метки, используемые в ИХА. В качестве меток в ИХА используются различные вещества и частицы.
1.Красящие вещества (хромогенные субстраты) - нано-частицы коллоидного золота или углерода, или частицы окрашенного латекса.
2.Люминофоры (Флуоресцентные, фосфоресцентные и биолюминисцентные метки, ковалентно связанные с частицами латекса). Эти метки используются только в приборных вариантах ИХА. Среди вышеуказанных наиболее распространены флуоресцентные метки.
3.Парамагнитные метки (также закрепленные на частицах латекса). Данный вид меток используется в ИХА с применением приборов, регистрирующих силу магнитного поля.
4.Ферментные метки. Ферментативная реакция регистрируется с помощью окрашивания субстратов, и результат анализа является визуальным.
5)Новым направлением в разработке различных разновидностях ИХА является использование липосом в качестве носителей различного рода меток (красящих, флуоресцентных, ферментативных, электроактивных и пр.)
6)Радионуклиды – используют изотопы I, Au, P
Иммунохроматографический тест сочетает в себе хроматографию в тонком слое (ТСХ) и принципы иммунохимии.
В тест-зоне полоски нанесены искусственные антигены. Антитела к ним, связанные с красителем, также нанесены на полоску у линии ее погружения в исследуемый образец биожидкости. При погружении тест-полоски в биожидкость происходит ее миграция по принципу ТСХ. Вместе с биожидкостью движутся антитела. Если в биожидкости отсутствует исследуемый антиген, то антитела доходят до искусственных антигенов, связываются с ними, и в тест-зоне появляется окрашивание. Если исследуемый антиген присутствует в биожидкости, он связывает антитела и окрашивания в тест-зоне не наблюдается.
16.Радиоиммунный анализ
Радиоиммунный метод анализа основан на конкурентном связывании определяемого ве- щества-антигена и антигена меченого радиоактивной меткой со специфическими антителами. Концентрацию комплекса меченный Аг-Ат определяют посредством измерения радиоактивности. Предварительно необходимо удалить непрореагировавший меченый Аг.
В качестве метки наиболее часто используют изотопы веществ часто используют изотопы
P, C, Co, I.
Достоинства
1.Определение вещества в следовых концентрациях
2.Высокая специфичность анализа
3.Высокая воспроизводимость
4.Экспрессность
5.Малый объем биологического материала для анализа
Недостатки
1.Короткий срок жизни метода, обусловленный периодом полураспада
2.Дорогое оборудование для измерения
3.Возможность радиоактивного загрязнения окружающей среды
4.Необходимость специальных мер предосторожности
5.Высокая квалификация персонала
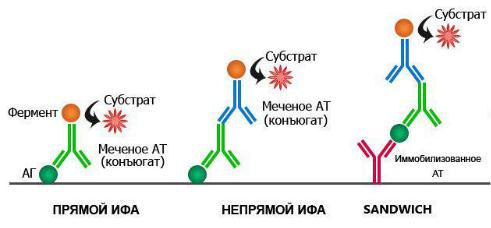
17.Иммуноферментный анализ
Иммуноферментный анализ (ИФА) — один из видов иммунохимического анализа. Он основан на реакции антигена (АГ) с соответствующим антителом (АТ) с образованием иммунного комплекса. При этом один из компонентов конъюгирован с ферментом. Только после образование комплекса АГ-АТ фермент может прореагировать со своим субстратом образуется окрашенный продукт, количество которого можно определить спектрофотометрически.
Прямой ИФА
Впрямом иммуноферментном анализе используют антитела к выявляемому антигену, соединенные со специфической меткой. Этой меткой выступает фермент (реже субстрат).
Непрямой ИФА
Внепрямом иммуноферментном анализе два этапа. При проведении первого этапа используют немеченые антитела к выявляемым антигенам, а во втором этапе применяют меченые антитела к первым немеченым антителам. То есть получается не прямое связывание антитела с антигеном.
Сендвич метод
Аг предварительно связан с иммобилизированным Ат и к этому комплексу мы добавляем наше меченной ферментом Ат напрямую или не напрямую
Достоинства метода:
·Быстрота и простота определения;
·Возможность автоматизации и использования для массовых анализов в полевых условиях;
·Не сложная пробоподготовка;
·Высокая точность;
·Не требуется дорогостоящей аппаратуры.
Недостатками можно назвать узкую специфичность и влияние компонентов матрицы.
18.Метод хромато-масс-спектрометрии в ХТА.
Метод хромато-масс-спектрометрии
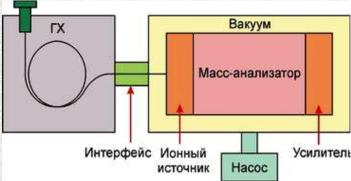
Этот метод получил название хроматомасс-спектрометрии. С помощью хроматографии происходит разделение смеси на отдельные компоненты c помощью масс-спектрометрии проводят обнаружение и количественное определение разделенных веществ смеси.
Хроматомасс-спектрометры выпускаются в двух вариантах — в комбинации с газовым хромтогрофами для анализа веществ, находящихся в газовой фазе или в комбинации с жидкостным хроматографом для анализа труднолетучих, полярных и термолабильных веществ.
Принцип работы:
•введенный образец испаряется в инжекторе хроматографа под действием температуры и переносится в колонку (полностью либо частично)
•вещества с различной скоростью проходят через колонку, за счет чего происходит их разделение
•из колонки соединения попадают в ионизатор где они ионизируются (обычно, электронным ударом)
•образовавшиеся ионы направляются в масс-анализатор, в котором они разделяются по отношению массы к заряду и специальным детектором определяется их количество.
•в результате анализа получается трехмерный массив данных - каждая точка хроматограммы содержит масс-спектр.
19. Дайте определение термина «ложноположительный» и «ложноотрицательный» результат.
Ложноотрицательный ответ (результат) — это отрицательный ответ на присутствие подозреваемого вещества, полученный при исследовании объекта,
содержащего это вещество. Причина - чувствительности метода анализа: чем выше чувствительность метода, тем меньше ложноотрицательных ответов и больше положительных. Причиной так же может быть фальсификация пробы, недостаточной квалификацией эксперта, систематическими ошибками исследований.
Ложноположительный ответ (результат) — это положительный ответ на присутствие подозреваемого вещества, полученный при анализе объекта, не
содержащего это вещество. Ложноположительные результаты теста приведут к
дополнительным тестам, но не к ложному заключению. Ложноположительные результаты обусловлены недостаточной специфичностью метода, за счет перекрестных реакций, слабой подготовки эксперта, загрязненными реагентами.
20. Методы изолирования лекарственных и наркотических веществ при проведении судебно-химической экспертизы. Их характеристика и сравнительная оценка.
Общими методами изолирования «нелетучих» ядов являются:
1.Изолирование подкисленным этанолом (метод Стаса-Отто)
2.Изолирование водой, подкисленной щавелевой кислотой (метод Швайковой-Василье- вой)
3.Изолирование нейтральным ацетоном.(метод Карташова)
Частные методы изолирования
изолирование барбитуратов подщёлоченной водой (метод Валова);
метод Е. Грусц-Харди - изолирование смесью спирта и хлороформа
изолирование алкалоидов водой, подкисленной серной кислотой (метод Крамаренко)
Изолирование алкалоидов водой подкисленной серной кислотой с последующей гель фильтрацией (Метод Поповой)
Изолирование производных фенотиазина подкисленным спиртом (Метод Салома-
тина)
Изолирование подкисленным спиртом
Метод Стаса-Отто.
В настоящее время метод применим для выделения не только алкалоидов, но и веществ кислотного, слабоосновного характера, в том числе синтетических лекарственных и наркотических средств.
Схема метода
1-й этап. Навеску объекта настаивают три раза по 24 ч с этиловым спиртом, подкисленным щавелевой кислотой. Спиртовые вытяжки упаривают и в полученном остатке многократно осаждают белки спиртом фильтруют и выпаривают досуха. Очищенный остаток растворяют в 20-25 мл воды.
2-й этап. Водный раствор последовательно экстрагируют хлороформом при рН=2 и рН=10 после подщелачивания 25% раствором аммиака. В экстракт при рН=2 переходят вещества кислотного и слабоосновного характера. В экстракт при рН=10 переходят вещества основного характера.
Оценка метода.
Достоинство метода: извлекает вещества различной природы. Имеется стадия осаждения белков (важно при работе с трупами).
Недостатком метода длительность, потери искомых веществ за счет адсорбции их белками. Используется часто особенно при исследовании объектов, подвергшихся сильным гнилостным изменениям.
Метод Е.М. Соломатина. Экстракция подкисленным спиртом при определении производных фенотиазина в биологических объектах.
Схема метода
1 -й этап. Объект заливают этиловым спиртом, подкисляют щавелевой кислотой до рН=2 и настаивают. Спиртовые вытяжки упаривают. В остатке осаждают белки 96% спиртом, фильтруют и выпаривают досуха. Очищенный остаток растворяют в 100 мл воды, нагретой до температуры 40-60°С, охлаждают и фильтруют.
2-й этап. Фильтрат экстрагируют дважды диэтиловым эфиром (отличие от Стаса) при рН=2-3, Затем водную фазу подщелачивают 50% раствором гидроксида натрия и вновь экстрагируют диэтиловым эфиром. Объединенные эфирные вытяжки и используют для обнаружения производных фенотиазина.
Оценка метода. Максимальная степень экстракция и уменьшает потери исследуемых веществ как при изолировании, так и при экстракции.
Изолирование нейтральным ацетоном
Метод разработан В. А. Карташовым. В качестве экстрагента им предложен амфифильный растворитель ацетон, который способен смешиваться как с водой, гак и с липидами.
Схема метода
1-й этап. биологический материал четырехкратно извлекают ацетоном встряхивая после каждого раза. Затем пробы центрифугируют. Ацетоноводный экстракт смешивают с карбонатом калия. Ацетоновый слой отделяют, добавляют раствор н-гексана в HCl. Органическую фазу, содержащую гидрофобные примеси, отбрасывают.
2-й этап. Водно-ацетоновую фазу экстрагируют эфиром, эфир испаряют и анализируют на вещества кислотного характера. Оставшийся водный раствор подщелачивают 25% раствором аммиака до рН=9-10, добавляют 3 г хлорида натрия (для высаливающего эффекта) и экстрагируют диэтиловым эфиром. Эфир испаряют и остаток исследуют на вещества основного характера.
Оценка метода. Способ позволяет получать достаточно чистые экстракты. В процессе гомогенной экстракции анализируемые вещества практически не теряются.
Изолирование подкисленной водой
Метод Степанова-Швайковой
Схема метода
1-й этап. Навеску растительного объекта массой заливают водой очищенной (1:12), подкисляют щавелевой кислотой до рН=2 и настаивают 2 ч. Водную вытяжку центрифугируют. Прозрачную жидкость отделяют от осадка.
2-й этап. Центрифугат экстрагируют последовательно хлороформом при рН=2, затем при рH = 10 после подщелачивания 25% раствором аммиака.
Метод А.А.Васильевой Схема метода
1-й этап. биологический объект заливают водой очищенной (1:2), подкисляют щавелевой кислотой до рН=2 и настаивают 2 раза (отличие): 2 ч и 1 ч при периодическом взбалтывании. Водную вытяжку процеживают через двойной слой марли и центрифугируют. Надосадочную прозрачную жидкость отделяют.
2-й этап. Центрифугат экстрагируют последовательно хлороформом при значениях рН=2, затем при рН=10 после подщелачивания 25% раствором аммиака.
Оценка методов. Методы Степанова -Швайковой и Васильевой быстрее метода Стаса-Отто. позволяют изолировать меньшие количества ряда алкалоидов. Они не требуют затраты этилового спирта, но не пригодны при анализе сильно загнивших объектов.
Метод В.Ф.Крамаренко Схема метода
1-й этап. Навеску заливают раствором серной кислоты (рН=2,5) и настаивают 2 раза: 2 ч и 1 ч. Водные вытяжки центрифугируют, отделяют от осадка, насыщают сульфатом аммония и вновь центрифугируют. Центрифугат (рН=2,5) экстрагируют диэтиловым эфиром с целью очистки. 2-й этап. Водную фазу после подщелачивания до рН=8,5—9 раствором гидроксида натрия экстрагируют 4 раза хлороформом.
Оценка метода. Метод избирателен только к алкалоидам
Метод В. И. Поповой Схема метода
1-й этап. Измельченный заливают серной кислотой (рН=2) и настаивают 3 раза (отличие). Водную вытяжку процеживают через тройной слой марли и центрифугируют. Надосадочную жидкость отделяют и очищают с помощью гель-хроматографии. Элюируют барбитураты из колонк с помощью серной кислоты.
2-й этап. Элюат повторно экстрагируют хлороформом или диэтиловым эфиром. Оценка метода. Метод обеспечивает хорошую очистку извлечений. Можно исполь-
зовать в гнилостных объектах. Избирателен к барбитуратам.
Изолирование подщелоченной водой
Метод П.Валова Схема метода
1-й этап. объект заливают 180 мл подщелоченной воды (рН=10) и настаивают в течение 30 мин. Щелочную вытяжку центрифугируют. Надосадочную жидкость (центрифугат)
подкисляют серной кислотой до рН=2. В полученном растворе с помощью вольфрамата натрия при нагревании осаждают белки и смесь вновь центрифугируют.
2-й этап. Барбитураты из центрифугата экстрагируют диэтиловым эфиром при значении рН=2. Затем экстрагируют эфиром, реэкстракцию проводят 10%-ным раствором NaOH, подкисляют H2SO4 до рН = 2 и барбитураты экстрагируют эфиром.
Оценка метода. Метод эффективен, позволяет выделить 50-90% барбитуратов и получить достаточно чистые извлечения. Недостатком метода является сорбция некоторых барбитуратов белками.
21. Твердо - жидкостная экстракция в ХТА наркотических и сильнодействующих лекарственных веществ.
Для экстракции веществ в системе твердое тело — жидкость в качестве экстрагентов применяют органические растворители.
Движущей силой процесса экстракции в системе «твёрдое тело-жидкость» является разница концентраций экстрагируемого вещества в жидкости, заполняющей поры твёрдого тела, и в основной массе экстрагента, находящегося в контакте с поверхностью твёрдых частиц.
Механизм экстрагирования состоит из следующих стадий:
-проникновение растворителя в поры частиц твёрдого материала;
-растворение целевого компонента;
-перенос экстрагируемого вещества из внутренних структур материала в объём омывающего материала.
Варианты твердо-жидкостной экстракции:
Мацерация (настаивание) - объект измельчают заливают экстрагентом и настаивают при определенной температуре, периодически перемешивая. Через несколько часов (а иногда и дней) вытяжку сливают, остаток отжимают, отжатую вытяжку промывают небольшим количеством экстрагента. Метод мало эфективен (до 50% выход) и долгий.
Ремацерация (дробная мацерация) – заключается в деление на части экстрагента, или сырья и экстрагента. Общее количество экстрагента делят на 3—4 части и последовательно настаивают сырье с первой частью экстрагента, затем со второй, третьей и четвертой, каждый раз сливая вытяжку.
Дигерирование (ремацерация с нагреванием) - экстрагирование вещества из твердой фазы отдельными порциями растворителя при нагревании.
Перфорация – экстракция непрерывно циркулирующим растворителем
