
БИОХИМИЯ КРОВИ
.pdfНормальные формы
Существует несколько нормальных вариантов гемоглобина:
o HbF – фетальный гемоглобин, содержит 2α и 2γ-цепи, появляется через 12 недель внутриутробного развития и является основным после 3
месяцев,
o HbA – гемоглобин взрослых, доля составляет 98%, содержит 2α и 2β-
цепи, у плода появляется через 3 месяца жизни и к рождению составляет 80%
всего гемоглобина,
o HbA2 – гемоглобин взрослых, доля составляет 2%, содержит 2α и 2δ-
цепи,
o HbO2 – оксигемоглобин, образуется при связывании кислорода в легких, в легочных венах его 94-98% от всего количества гемоглобина,
o HbCO2 – карбогемоглобин, образуется при связывании углекислого газа в тканях, в венозной крови составляет 15-20% от всего количества гемоглобина.
Патологические формы гемоглобина
HbS – гемоглобин серповидно-клеточной анемии. При этом нарушении в ДНК в результате точковой мутации триплет ЦТТ заменен на триплет ЦАТ,
что влечет за собой включение в 6-м положении β-цепи вместо глутамата аминокислоты валина. Изменение свойств β-цепи влечет изменение свойств всей молекулы и формирование на поверхности гемоглобина "липкого"
участка. При дезоксигенации гемоглобина участок "раскрывается" и
связывает одну молекулу гемоглобина S с другими подобными. Результатом является полимеризация гемоглобиновых молекул и образование крупных белковых тяжей, вызывающих деформацию эритроцита и при прохождении капилляров гемолиз.
MetHb – метгемоглобин, форма гемоглобина, включающая трехвалентный ион железа вместо двухвалентного. Такая форма образуется спонтанно, но обычно ферментативных мощностей клетки хватает на его
восстановление. При использовании сульфаниламидов, употреблении нитрита натрия и нитратов пищевых продуктов, при недостаточности аскор-
биновой кислоты ускоряется переход Fe2+ в Fe3+. Образующийся metHb не способен связывать кислород и возникает гипоксия тканей. Для восстановления ионов железа в клинике используют аскорбиновую кислоту и метиленовую синь.
Hb-CO – карбоксигемоглобин, образуется при наличии СО (угарный газ) во вдыхаемом воздухе. Он постоянно присутствует в крови в малых концентрациях, но его доля может колебаться от условий и образа жизни.
HbA1С – гликированный гемоглобин. Концентрация его нарастает при хронической гипергликемии и является хорошим скрининговым показателем уровня глюкозы крови за длительный период времени.
Талассемии.
Талассемии - наследственные заболевания, обусловленные отсутствием или снижением скорости синтеза α- или β-цепей гемоглобина. В результате несбалансированного образования глобиновых цепей образуются тетрамеры гемоглобина, состоящие из одинаковых протомеров. Это приводит к нарушению основной функции гемоглобина - транспорту кислорода к тканям.
При β-талассемии не синтезируются β-цепи гемоглобина. Это вызывает образование нестабильных тетрамеров, содержащих только α-цепи.
При этом заболевании в костном мозге из-за преципитации нестабильных α-
цепей усиливается разрушение эритробластов, а ускорение разрушения эритроцитов в циркулирующей крови приводит к внутрисосудистому гемолизу. Как известно, для образования фетального гемоглобина β-цепи не требуются, поэтому клинически β-талассемия не проявляется до рождения,
после чего происходит переключение синтеза HbF на HbА.
В случае α-талассемии недостаток образования α-глобиновых цепей приводит к нарушению образования HbF у плода. Избыточные γ-цепи образуют тетрамеры, называемые гемоглобином Барта. Этот гемоглобин при
физиологических условиях имеет повышенное сродство к кислороду и не проявляет кооперативных взаимодействий между протомерами. В результате гемоглобин Барта не обеспечивает развивающийся плод необходимым количеством кислорода, что приводит к тяжёлой гипоксии.
При α-талассемии отмечают высокий процент внутриутробной гибели плода. Выжившие новорождённые при переключении с γ- на β-ген синтезируют β-тетрамеры или HbН, который, подобно гемоглобину Барта,
имеет слишком высокое сродство к кислороду, менее стабилен, чем HbА и быстро разрушается. Это ведёт к развитию у больных тканевой гипоксии и к смерти вскоре после рождения.
Строение миоглобина. Отличие от гемоглобина
Миоглобин также как и гемоглобин относится к группе гемопротеинов,
является сложным белком, состоящим из белка глобина и простетической группы - гема. Однако, в отличие от гемоглобина является белком третичной структуры, состоит из 153 аминокислот с молекулярной массой 17 кДа и по структуре сходен с β-цепью гемоглобина. Белок локализован в мышечной ткани скелетных мышц и миокарда. Миоглобин обладает более высоким сродством к кислороду по сравнению с гемоглобином и его оксигенирование не подчиняется кооперативному аллостерическому эффекту.
Функции миоглобина:
1.Транспорт кислорода внутри мышечной клетки.
2.Депонирование кислорода в мышечной клетке и использование его только при значительном уменьшении парциального давления О2 в мышце
(до 1-2 мм рт.ст).
Биосинтез гема в организме человека: локализация, субстраты,
ферменты, этапы и регуляция.
Гем в составе гемоглобина синтезируется клетками костного мозга на
этапе преобразования эритробластов в ретикулоциты, а затем в эритроциты.
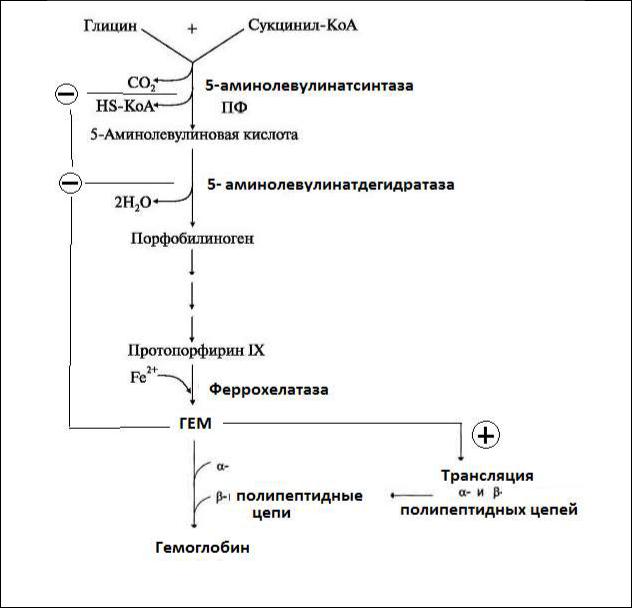
Локализация биосинтеза: гем синтезируется во всех клетках, но наиболее активно в печени и костном мозге. Эти ткани нуждаются в больших количествах гема, необходимого для образования гемоглобина и цитохромов.
Рис. Синтез гема
Ключевой реакцией синтеза порфиринов является реакция образования аминолевулиновой кислоты. Эту реакцию катализирует пиридоксальфосфат зависимый фермент митохондрий эритробластов 5-
аминоаминолевулинатсинтаза. Активность аминолевулинатсинтазы регулируется аллостерически и на уровне транскрипции гена фермента. Гем и гемоглобин являются аллостерическими ингибиторами и репрессорами синтеза аминолевулинатсинтазы. На этапе трансляции синтез аминолевулинатсинтазы регулирует и концентрация ионов железа.
Стероидные гормоны, эстрогены, прогестины и некоторые лекарственные препараты (барбитураты, диклофенак, сульфаниламиды) являются индукторами синтеза аминолевулинатсинтазы.
Транспорт гема осуществляется белком гемопексином (фракция β-
глобулина). Это предотвращает повреждение почечного фильтра прооксидантом Fe2+ и сохраняет гем и Fe2+ в организме.
В результате генетических дефектов или нарушения регуляции ферментов, участвующих в биосинтезе гема, развиваются порфирии.
Порфирии – это группа гетерогенных наследственных заболеваний,
возникающих в результате нарушения синтеза гема и повышения содержания порфиринов и их предшественников в организме.
Выделяют наследственные и приобретенные формы порфирии.
Приобретенные формы порфирий носят токсический характер и вызываются действием гексахлорбензола, солей свинца и других тяжелых металлов (ингибирование порфобилиногенсинтазы, феррохелатазы и др.),
лекарственными препаратами (антигрибковый антибиотик гризеофульфин).
При наследственных формах дефект фермента имеется во всех клетках организма, но проявляется только в одном типе клеток. Можно выделить две большие группы порфирий:
1. Печеночные – группа заболеваний с аутосомно-доминантными нарушениями ферментов различных этапов синтеза протопорфирина IX.
Наиболее ярким заболеванием этой группы является перемежающаяся острая порфирия, при которой у гетерозигот активность уропорфириноген-I-синтазы снижена на 50%.
Заболевание проявляется после достижения половой зрелости из-за повышенной потребности гепатоцитов в цитохроме Р450 для обезвреживания половых стероидов. Обострение состояния также часто бывает после приема лекарственных препаратов, метаболизм которых требует участия цитохрома Р450.
Потребление гема, необходимого для синтеза цитохрома Р450, и
снижение его концентрации активирует аминолевулинатсинтазу. В
результате больные экскретируют с мочой большие количества порфобилиногена и аминолевулиновой кислоты. На свету порфириноген окисляется в окрашенные порфобилин и порфирин, и это является причиной потемнения мочи при ее стоянии на свету при доступе воздуха. Симптомами являются острые боли в животе, запоры, сердечно-сосудистые нарушения,
нервно-психические расстройства.
2. Эритропоэтические – аутосомно-рецессивные нарушения некоторых ферментов синтеза протопорфирина IX в эритроидных клетках.
При этом смещается баланс реакций образования уропорфириногенов в сторону синтеза уропорфириногена I. Симптомы заболевания схожи с предыдущим, но дополнительно наблюдается светочувствительность кожи, обусловленная наличием уропорфириногенов, кроме этого отмечаются трещины на коже и гемолитические явления.
Связывание гемоглобина с кислородом (триггерный механизм),
кооперативный эффект. Кривая насыщения гемоглобина кислородом.
Дыхательная функция крови состоит в доставке кислорода от легких к тканям и углекислого газа от тканей к легким.
Кровь осуществляет дыхательную функцию прежде всего благодаря наличию в ней гемоглобина.
В тканях диффундирующий в кровь из клеток СО2 большей частью
(около 90%) попадает в эритроциты. Движущей силой этого процесса является быстрая, постоянно идущая реакция превращения его в угольную кислоту при участии фермента карбоангидразы. Угольная кислота диссоциирует и подкисляет содержимое эритроцита, что улучшает отдачу оксигемоглобином кислорода..
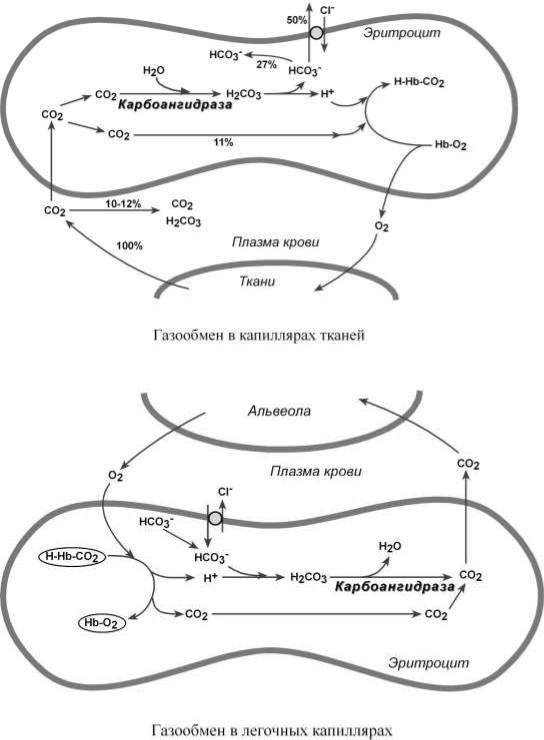
Одновременно с концевыми NH2-группами β-цепей гемоглобина связывается 10-12% карбонат-иона с образованием карбаминогемоглобина
(карбогемоглобин, H-HbCO2).
Hb-NH2 + CO2 → Hb-NH-COO– + H+
Остальные бикарбонаты выходят в плазму крови в обмен на ионы хлора (гипохлоремический сдвиг).
В легких в альвеолярном воздухе имеется высокая концентрация кислорода и относительно низкая концентрация углекислого газа. Поэтому идет высокоэффективная диффузия СО2 из плазмы через альвеолярные мембраны и его удаление с выдыхаемым воздухом. Далее происходит:
o уменьшение концентрации СО2 в плазме стимулирует его образование в карбоангидразной реакции внутри эритроцита и снижает в нем концентрацию иона HCO3– ,
o одновременно высокая концентрация кислорода вытесняет СО2 из комплекса с гемоглобином с образованием оксигемоглобина – более сильной кислоты, чем угольная,
o диссоциирующие от оксигемоглобина ионы Н+ нейтрализуют поступающий извне ион HCO3– с образованием угольной кислоты. После карбоангидразной реакции образуется СО2, который выводится наружу.
Триггерный механизм присоединения кислорода к гемоглобину
При оксигенации гемоглобина запускается механизм конформационных переходов, который заключается в изменении распределения электронов в Fe2+ по d-орбиталям и их спиновом состоянии,
что ведет к изменению ионного радиуса железа.
В молекуле дезоксигемоглобина из шести 3d электронов железа Fe(2+)
два электрона спарены на одной из низших d-орбиталей, а четыре электрона занимают оставшиеся d-орбитали, их спиновые моменты, согласно правилу Хунда, параллельны и суммарный спин S = 2. Железо находится над плоскостью порфиринового кольца.
Присоединение кислорода ведет к спариванию электронов на 3d
подуровне. Все шесть d-электронов спарены на трех низших d-орбиталях, S = 0, радиус уменьшается, и ион железа втягивается в плоскость порфиринового кольца.
Таким образом, связывание О2 с атомом Fe2+ вызывает его перемеще-
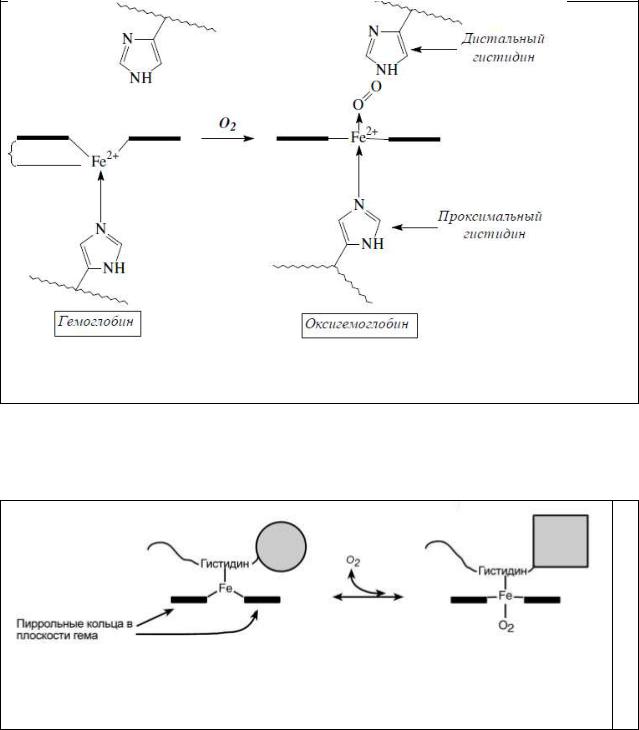
ние в плоскость гема. А это, в свою очередь, вызывает перемещение остатка гистидина, связанного с атомом Fe2+. Изменение положения гистидина приводит к разрыву некоторых слабых связей в протомере, вследствие чего изменяется конформация этого протомера, а поскольку все протомеры связаны между собой, то и других протомеров, и в конечном счете всего белка.
Рис.
Конформационные изменения в полипептидной цепи глобина при взаимодействии с кислородом вызывают различия в пространственной организации гемоглобина и его окси-формы.
Схема изменения конфигурации протомеров при присоединении кислорода к гемоглобину
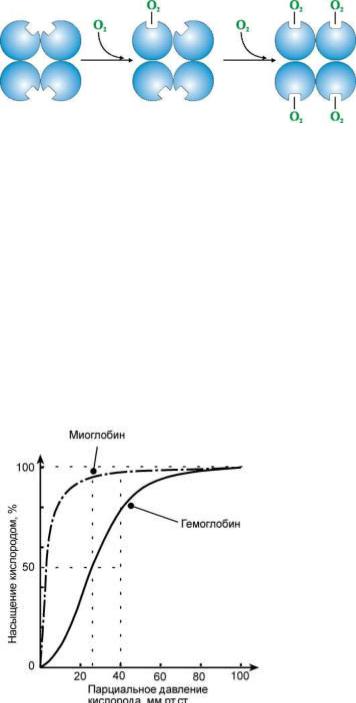
Как только первая гемсодержащая полипептидная субъединица свяжет молекулу кислорода, она передает информацию об этом остальным субъединицам, у которых сразу же резко повышается сродство к кислороду.
Такой обмен информацией между четырьмя гемсодержащими полипептидными субъединицами гемоглобина обусловлен кооперативным взаимодействием между субъединицами.
|
|
|
В |
результате |
этого |
||
|
|
|
последующее |
|
присоединение |
||
|
|
|
кислорода |
к |
гемоглобину |
||
|
|
|
происходит |
намного |
легче: |
||
Рис. |
Кооперативные |
изменения |
четвертая |
молекула |
О2 |
||
|
|
|
|
|
|||
конформации протомеров гемоглобина |
связывается с гемоглобином |
||||||
|
|
|
|
|
|||
|
|
|
|
|
|
||
примерно в 300 раз легче, чем первая. |
|
|
|
|
|
||
Кривая насыщения гемоглобина кислородом.
Для миоглобина и гемоглобина характерны разные кривые связывания кислорода Кривая насыщения миоглобина кислородом имеет вид простой гиперболы, а кривая насыщения гемоглобина кислородом имеет сигмовидную, т.е. S-образную, форму.
\ |
Разные |
формы кривых насыщения |
|||
|
миоглобина |
и |
гемоглобина |
О2 |
|
|
обусловлены различием их структуры, |
||||
|
функций и свойств. |
|
|
||
|
Миоглобин – белок третичной структуры, |
||||
|
может связывать только одну молекулу |
||||
|
кислорода, |
обладает более высоким |
|||
|
сродством к кислороду по сравнению с |
||||
|
гемоглобином. 50%-ное насыщение миог |
||||
|
лобина |
кислородом |
достигается |
уже |
|
|
тогда, когда парциальное давление 02 |
|
|||
|
|
|
|
|
|
