
БИОХИМИЯ КРОВИ
.pdf-защитная функция, обеспечивают лизис бактериальных клеток;
-регуляция проницаемости и тонуса сосудов;
-обеспечивают хемотаксис клеток;
-обеспечивают взаимодействие между клетками (реакции агрегации тромбоцитов).
Существует два пути активации белков системы комплемента:
-классический – инициируется иммуноглобулинами и их комплексами с антигенами;
-альтернативный – инициируется микробными полисахаридами и липополисахаридами бактериальных клеток.
Остаточный азот: понятие, состав, физиологическая роль и клинико-диагностическое значение исследования содержания его и его компонентов. Безазотистые органические соединения сыворотки крови
Остаточный азот
Низкомолекулярные азотистые вещества в крови представлены,
главным образом, продуктами обмена белков и нуклеиновых кислот. Эти вещества остаются в надосадочной жидкости или фильтрате после осаждения крупномолекулярных белков и составляют остаточный азот крови.
Увеличение остаточного азота (азотемия) по своему характеру может быть абсолютным, связанным с действительным накоплением азотистых компонентов в крови, и относительным, связанным с дегидратацией. В свою очередь, абсолютная азотемия может быть ретенционная (почечного происхождения) и продукционная.
Ретенционная возникает в результате задержки выведения и различается на азотемии почечного происхождения (заболевания клубочков – нефриты, туберкулез почек, нефросклероз и т.д.) и
внепочечного происхождения. Внепочечные в свою оче редь подразделяются на надпочечные (результат нарушений гемодинамики и падения филь-
трационного давления при сердечно-сосудистой недостаточности, снижении артериального
давления) и подпочечные (при гипертрофии или аденоме простаты,
почечнокаменной болезни).
Продукционная азотемия выявляется при всех состояниях, связанных с увеличением распада белка, от ретенционной ее отличает повышение содержания аминокислот в крови, а также одновременное накопление азотистых компонентов в крови и моче.
Безазотистые органические соединения сыворотки крови
В группу безазотистых органических веществ крови входят углеводы,
жиры, липиды, органические кислоты и некоторые другие вещества. Все эти соединения являются либо продуктами промежуточного обмена углеводов и жиров, либо играют роль питательных веществ.
Ферменты плазмы крови: классификация, использование в
энзимодиагностике
Все ферменты, содержащиеся в плазме крови, можно разделить на три
группы:
1.секреторные ферменты - синтезируются в печени, выделяются в кровь, где выполняют свою функцию, например, ферменты свертывающей и противосвертывающей системы крови (тромбин, плазмин), ферменты обмена липопротеинов (ЛХАТ, ЛПЛ).
2.экскреторные ферменты - синтезируются в печени, в норме выделяются с желчью (например, щелочная фосфатаза), их содержание и активность в плазме крови возрастает при нарушении оттока желчи;
3.индикаторные ферменты - синтезируются в различных тканях и попадают в кровь при разрушении клеток этих тканей. В разных клетках преобладают различные ферменты, поэтому при повреждении того или иного органа в крови появляются характерные для него ферменты. Это может быть использовано в диагностике заболеваний.
Например, при повреждении клеток печени (гепатит) в крови возрастает активность аланинаминотраноферазы (АЛТ) и
аспартатаминотрансферазы (ACT), γ-глутамилтрансферазы (ГГТ). При
инфаркте миокарда в крови также возрастает активность ACT и АЛТ. Для уточнения диагноза определяют коэффициент де Ритиса (соотношение АСТ/АЛТ в корме = 1, 33, при инфаркте миокарда повышается). При повреждении клеток поджелудочной железы (панкреатит) в крови возрастает активность трипсина, α-амилазы, липазы.
В настоящее время особо важным лабораторным тестом стало исследо-
вание активности изоферментов в сыворотке крови, в частности изофермен-
тов ЛДГ. Известно, что в сердечной мышце наибольшей активностью обладают изоферменты ЛДГ1, а в скелетных мышцах ЛДГ5.
Диагностическое значение имеет также исследование активности изоферментов креатинкиназы в сыворотке крови. Существуют по крайней мере 3 изофермента креатинкиназы: ВВ, ММ и MB. В мозговой ткани в основном присутствует изофермент ВВ (от англ. brain – мозг), в скелетной мускулатуре – ММ-форма (от англ. muscle – мышца). Сердце содержит гиб-
ридную МВ-форму, а также ММ-форму. Изоферменты креатинкиназы особенно важно исследовать при остром инфаркте миокарда, так как МВ-
форма в значительном количестве содержится практически только в сердечной мышце.
БИОХИМИЯ ФОРМЕННЫХ ЭЛЕМЕНТОВ КРОВИ
Эритроцит: особенности структуры, химического состава
мембраны и цитозоля, функции.
Эритроциты - высокоспециализированные клетки, которые переносят кислород от лёгких к тканям и диоксид углерода, образующийся при метаболизме, из тканей к альвеолам лёгких. Транспорт О2 и СО2 в этих клетках осуществляет гемоглобин, составляющий 95% их сухого остатка.
Эритроциты, так же как и другие клетки крови, образуются из полипотентных стволовых клеток костного мозга. Продолжительность жизни эритроцитов составляет в среднем 120 суток; разрушение их происходит в клетках ретикуло-эндотелиальной системы.
Строение эритроцитов. Эритроциты - единственные клетки, которые имеют только клеточную мембрану и цитоплазму. В зрелом эритроците нет ядра, митохондрий и полисом. Обладают двояковогнутой формой и большой способностью к деформации, благодаря чему эффективно обеспечивают процессы диффузии газов и могут проходить через капилляры, диаметр которых в 3-4 раза меньше самих эритроцитов. Важную роль в сохранении формы и способности к обратимой деформации эритроцитов играют липиды и белки плазматической мембраны.
Липиды бислоя плазматической мембраны эритроцитов, так же, как плазматические мембраны других клеток, содержат глицерофосфолипиды,
сфингофосфолипиды, гликолипиды и холестерол. Увеличение содержания холестерола в составе мембраны, которое может наблюдаться при некоторых заболеваниях, снижает её текучесть и эластичность, а следовательно, и
способность к обратимой деформации. Это, в свою очередь, затрудняет движение эритроцитов через капилляры и может способствовать развитию гемостаза.
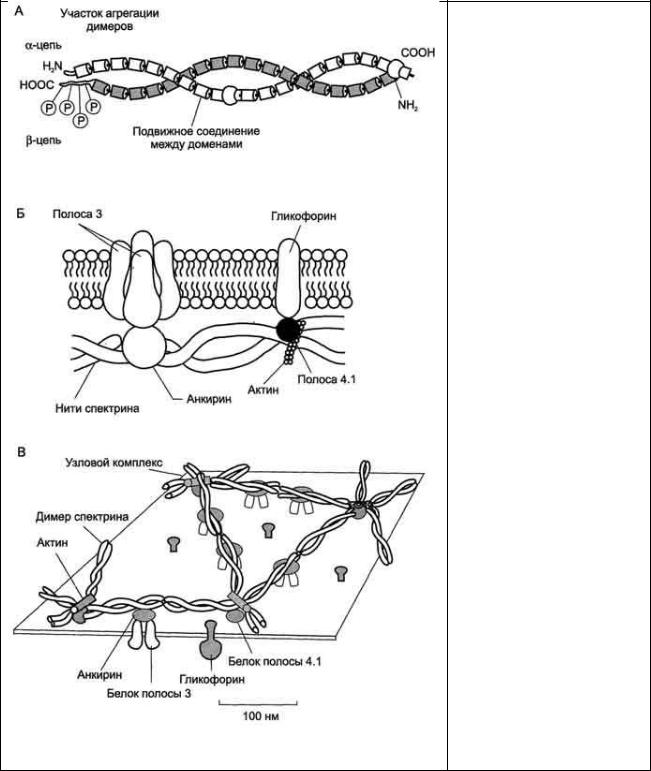
Мембранные белки:
Гликофори́ны — это группа основны́х трансмембранных гликопротеинов эритроцитов (обнаружены только в эритроцитах и состоят на
~60% из углеводного компонента, на 40% — из белкового). Благодаря наличию большого количества остатков сиаловой кислоты, гликофорины ответственны примерно за 60% отрицательного заряда на поверхности эритроцитов. Гликофори́н пронизывает плазмолемму в виде одиночной спирали, и его большая часть выступает на наружной поверхности эритроцита, где к нему присоединены около 20 отдельных цепей олигосахаридов. Олигосахариды гликофорина - антигенные детерминанты системы групп крови АВО: (для О(Н) антигена детерминанта фукоза, для А-
антигена - N-ацетилгалактоз-амин, для В – галактоза), служат рецепторами для вирусов гриппа. Гликофорины относятся к классу мембранных гликопротеинов, которые выполняют рецепторные функции. Эти молекулы
играют важную роль во взаимодействии эритроцитов между собой, с
другими клетками крови.
Белок полосы 3
(получивший название по электрической подвижности) -
интегральный белок -
переносчик ионов С1-
и НСО3через мембрану эритроцитов по механизму пассивного антипорта -
канал трансорта анионов(С1-/ НСО3- ).
Nа+, К+-АТФ-аза
обеспечивает
поддержание
градиента концентраций Na+ и
К+ по обе стороны мембраны. При снижении активности
Na +/К+-АТФ-азы концентрация Na+ в
клетке повышается,
Рис. Белки мембраны эритроцитов
так как небольшие ионы могут проходить через мембрану простой диффузией. Это приводит к увеличению осмотического давления,
увеличению поступления воды в эритроцит и к его гибели в результате разрушения клеточной мембраны - гемолизу.
Са2+-АТФ-аза - ещё один мембранный фермент, осуществляющий выведение из эритроцитов ионов кальция и поддерживающий градиент концентрации этого иона по обе стороны мембраны.
Аквапорин - белок, формирующий поры для транспорта волы.
Белки цитоскелета: спектрин и анкирин. Спектрин - периферический мембранный белок, нековалентно связанный с цитоплазматической поверхностью липидного бислоя мембраны. Он представляет собой длинную, тонкую, гибкую фибриллу и является основным белком цитоскелета эритроцитов. Спектрин состоит из α- и β-полипептидных цепей,
имеющих доменное строение; α- и β-цепи димера расположены антипараллельно, перекручены друг с другом и нековалентно взаимодействуют во многих точках. Спектрин может прикрепляться к мембране и с помощью белка анкирина. Этот крупный белок соединяется с β-
цепью спектрина и цитоплазматическим доменом интегрального белка мембраны - белка полосы 3. Анкирин не только фиксирует спектрин на мембране, но и уменьшает скорость диффузии белка полосы 3 в липидном слое. Таким образом, на цитоплазматической поверхности эритроцитов образуется гибкая сетевидная структура, которая обеспечивает сохранение их формы при прохождении через узкие капилляры сосудов
Белки цитоплазмы- основной Нb, ферменты гликолиза, ПФП.
Особенности метаболизма веществ в эритроците. Обмен
метгемоглобина, связь с гликолизом.
1.Зрелые эритроциты лишены ядра, поэтому в клетке не синтезируются белки.
2.Эритроциты не имеют митохондрий, поэтому в клетке не протекают реакции ЦТК, ЦПЭ, β-окисления жирных кислот.
3.Основным энергетическим субстратом эритроцита является глюкоза,
которая поступает из плазмы крови путём облегчённой диффузии. Около
90% используемой эритроцитом глюкозы подвергается анаэробному гликолизу с образованием конечного продукта - молочной кислоты (лактата).
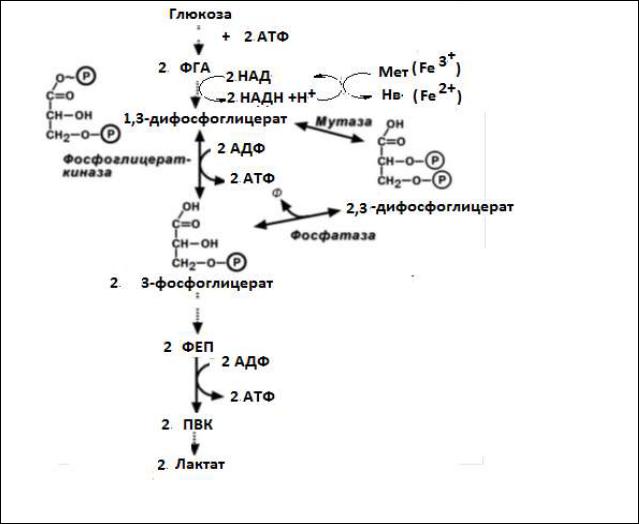
который выходит в плазму крови и используется в других клетках, прежде всего гепатоцитах.
4. Энергия, поставляемая гликолизом, обеспечивает поддержание целостности плазматической мембраны и работу Na+, K+-АТФазы.
Рис.
5. Важная особенность анаэробного гликолиза в эритроцитах по сравнению с другими клетками - присутствие в них фермента дифос-
фоглицератмутазы. Дифосфоглицератмутаза катализирует образование 2,3-
дифосфоглицерата из 1,3-дифосфоглицерата.Образующийся только в эритроцитах 2,3-дифосфоглицерат служит аллостерическим регулятором связывания О2 гемоглобином.
6. В реакции дегидрирования глицеральдегид-3-фосфата в гликолизе образуется НАДН. Этот кофермент является кофактором фермента

метгемоглобинредуктазы, участвующей в восстановлении метгемоглобина в
гемоглобин по следующей схеме:
7.10 % глюкозы распадается в эритроците в пентозофосфатном пути.
Образующийся при этом НАДФН обеспечивает восстановление глутатиона и поддерживает его оптимальную концентрацию. Восстановленный глутатион необходим для поддержания в восстановленной форме SH-групп белков;
препятствует окислению гемоглобина; предотвращает перекисное окисление липидов мембран. При снижении концентрации восстановленного глутатиона эритроцит быстро «стареет».
Механизмы свободно-радикального окисления (СРО) и
антиоксидантная защита (АОЗ)
Большое содержание кислорода в эритроцитах определяет высокую скорость образования супероксидного анион-радикала (О2-), пероксида водорода (Н2О2) и гидроксил радикала (ОН). Постоянный источник активных форм кислорода в эритроцитах - неферментативное окисление гемоглобина в метгемоглобин: Hb (Fe2+)+O2 → MetHb(Fe3+)+O2- .В течение суток до 3% гемоглобина может окисляться в метгемоглобин. Эритроциты содержат ферментативную систему, предотвращающую токсическое действие активных форм кислорода и разрушение мембран эритроцитов.
Супероксидный анион супероксиддисмутазой превращается в пероксид водорода: O2- + O2- + Н+ → H2О2 + O2.
Пероксид водорода под действием каталазы (2Н2О → 2Н2О + О2) или глутатионпероксидазы (2GSH + 2Н2О2 → GSSG + 2Н2О) превращается в Н2О и О2. Донором водорода для глутатионпероксидазы является восстановленный глутатион (GSH).
Окисленный глутатион (GSSG) восстанавливается ферментом глутатионредуктазой, кофермент которого NADPН образуется в пентозофосфатном пути катаболизма глюкозы.
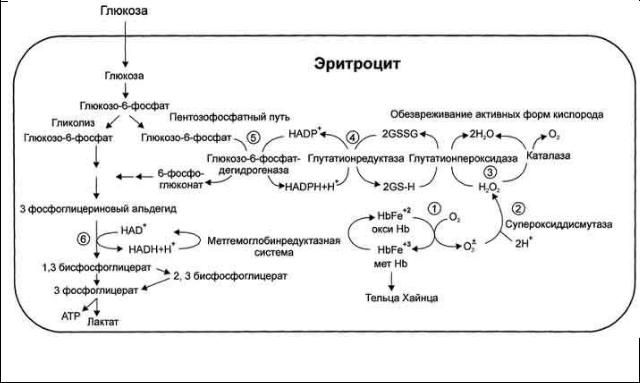
При генетическом дефекте глюкозо-6-фосфатдегидрогеназы и приеме некоторых лекарств, являющихся сильными окислителями, потенциала глутатионовой защиты может оказаться недостаточным, что приводит к увеличению содержания в клетках активных форм кислорода, вызывающих окисление SH-групп молекул гемоглобина. Образование дисульфидных связей между протомерами гемоглобина и метгемоглобина приводит к их агрегации — образованию телец Хайнца. Последние способствуют разрушению эритроцитов при попадании их в мелкие капилляры. Активные формы кислорода и сами разрушают мембраны, вызывая перекисное окисление липидов мембран: образование гидроперекисей ненасыщенных жирных кислот фосфолипидов, входящих в состав клеточных мембран, их разрушение и гемолиз эритроцитов.
Гемоглобин: строение, функции, типы. Талассемии. Миоглобин:
строение, функции, отличие от гемоглобина.
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Протомеры соединяются друг с другом благодаря образованию гидрофобных, ионных, водородных связей. При этом они взаимодействуют не произвольно, а определенным участком – контактной
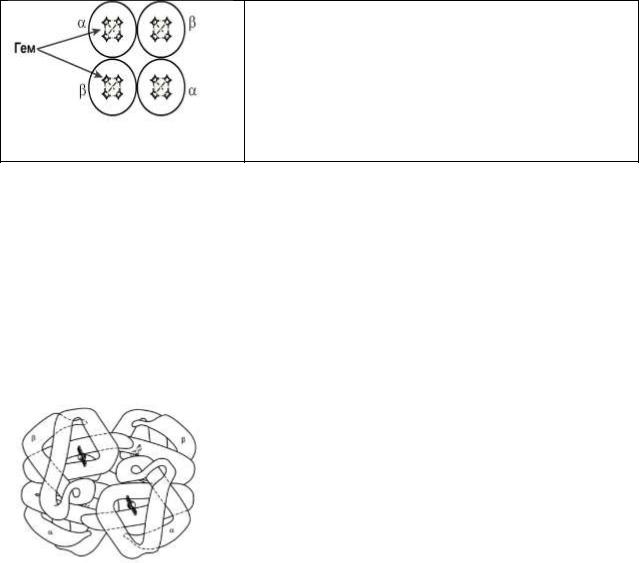
поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности.
Взаимодействие осуществляют разноименно заряженные группы,
гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей. В
состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, вопервых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы "в кармане" своей цепи и формируется гемсодержащий протомер.
Основными вариациями первичной структуры глобина являются α, β, γ, δ цепи. Первая 141, а остальные по 146 аминокислотных остатков. Друг от друга они отличаются не только количеством мономеров, но и их составом.
|
Принцип |
образования |
вторичной |
|
структуры у всех цепей однотипен: они все |
||
|
сильно (до 75% длины) спирализованы за |
||
|
счёт водородных связей. Альфа-цепи |
||
|
включают 7, а бета, гамма, дельта – 8 |
||
|
спирализованных |
фрагментов |
|
Структура Гемоглобина А |
(обозначенные |
буквами |
А-Н), |
|
|||
|
чередующихся с аморфными участками. |
||
|
|
|
|
Компактная укладка в пространстве полипептидных цепей приводит к возникновению третичной структуры. причем при этом создаётся карман,
куда и вкладывается гем.
Четвертичная структура гемоглобина представлена комплексом 4-х
попарно идентичных субъединиц.
Виды гемоглобина
